- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Закон Авогадро
Содержание
- 1. Презентация по химии на тему Закон Авогадро
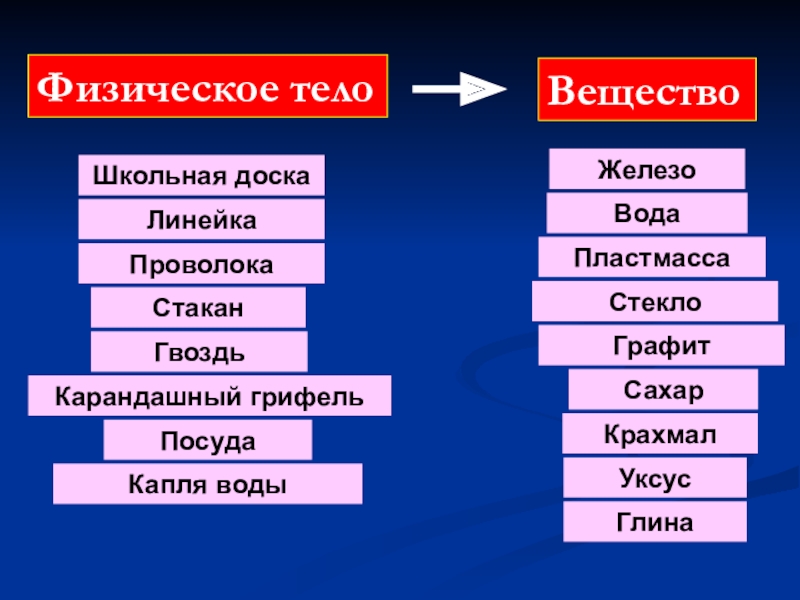
- 2. Физическое тело Вещество
- 3. Физическое тело Вещество
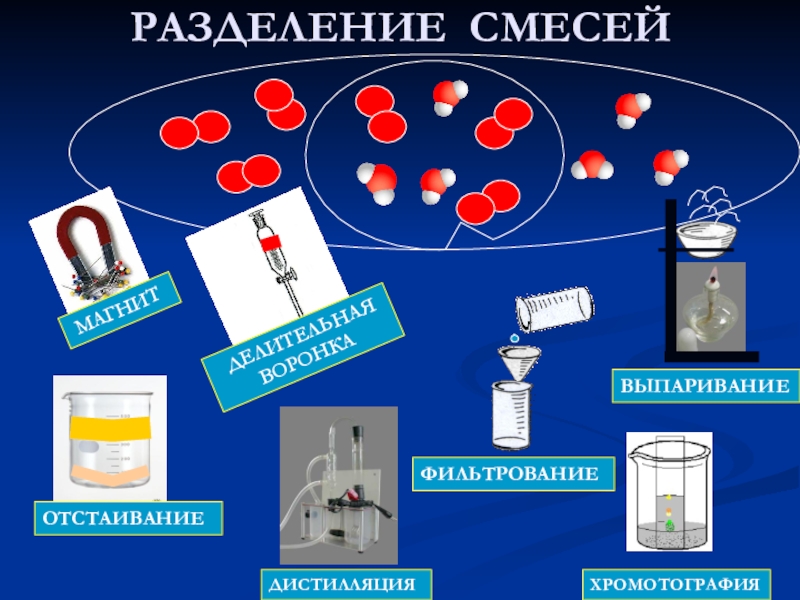
- 4. РАЗДЕЛЕНИЕ СМЕСЕЙ МАГНИТ ДЕЛИТЕЛЬНАЯ ВОРОНКАВЫПАРИВАНИЕФИЛЬТРОВАНИЕОТСТАИВАНИЕХРОМОТОГРАФИЯДИСТИЛЛЯЦИЯ
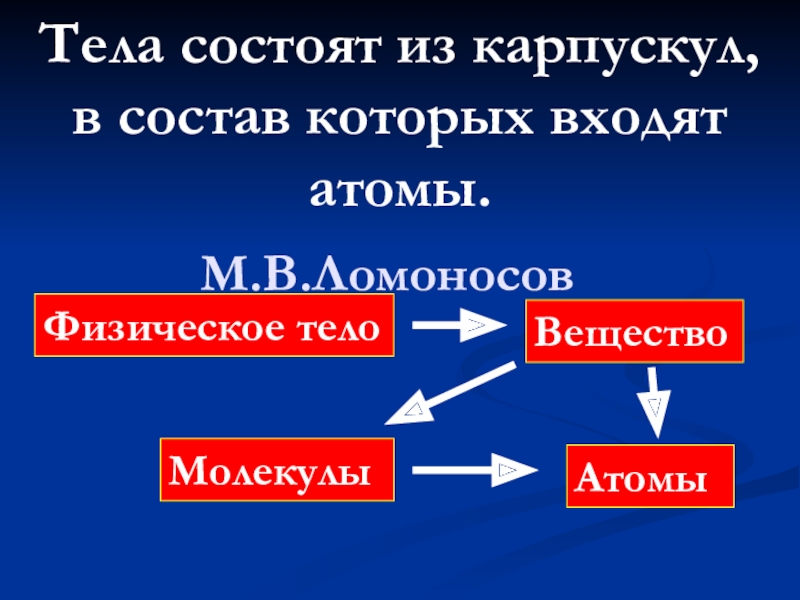
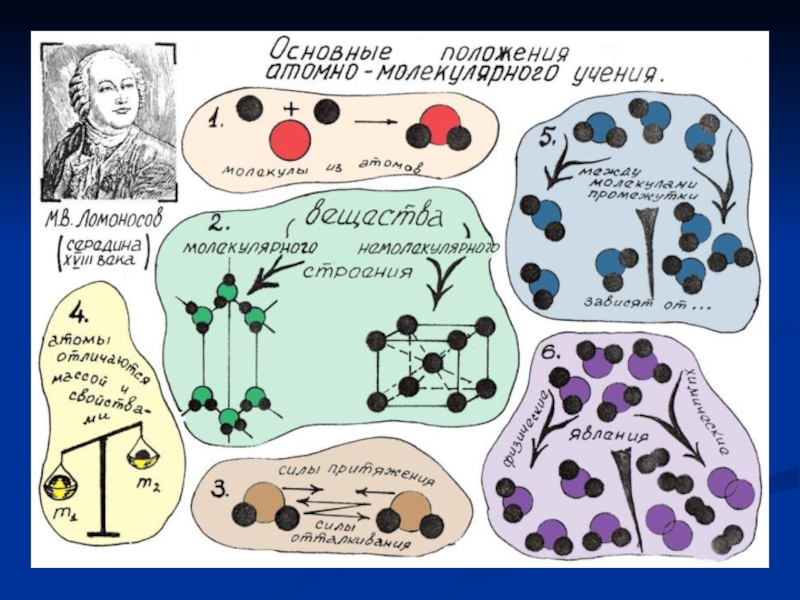
- 5. Тела состоят из карпускул, в состав которых входят атомы. М.В.Ломоносов Физическое тело ВеществоМолекулыАтомы
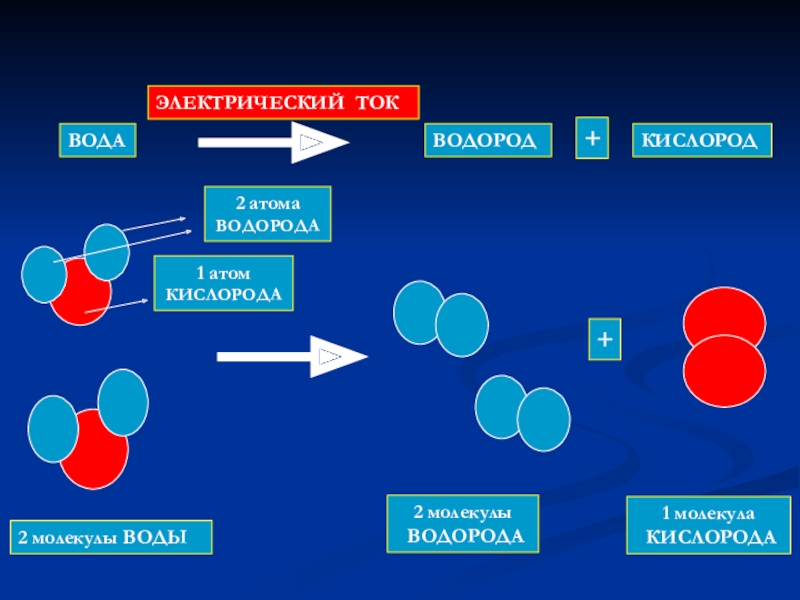
- 6. ВОДАВОДОРОДКИСЛОРОДЭЛЕКТРИЧЕСКИЙ ТОК++2 молекулы ВОДЫ2 молекулы ВОДОРОДА1 молекула КИСЛОРОДА
- 7. Слайд 7
- 8. ЯВЛЕНИЯ физические химические
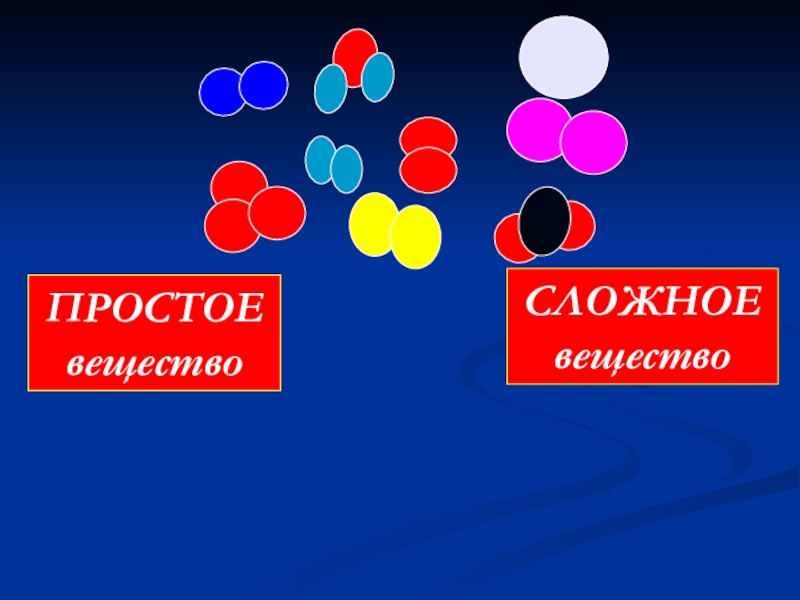
- 9. ПРОСТОЕвеществоСЛОЖНОЕвещество
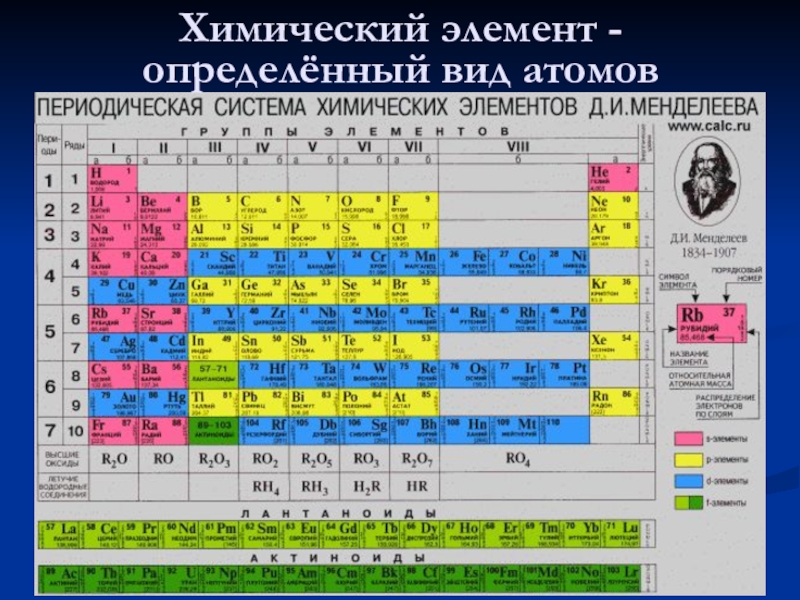
- 10. Химический элемент - определённый вид атомов
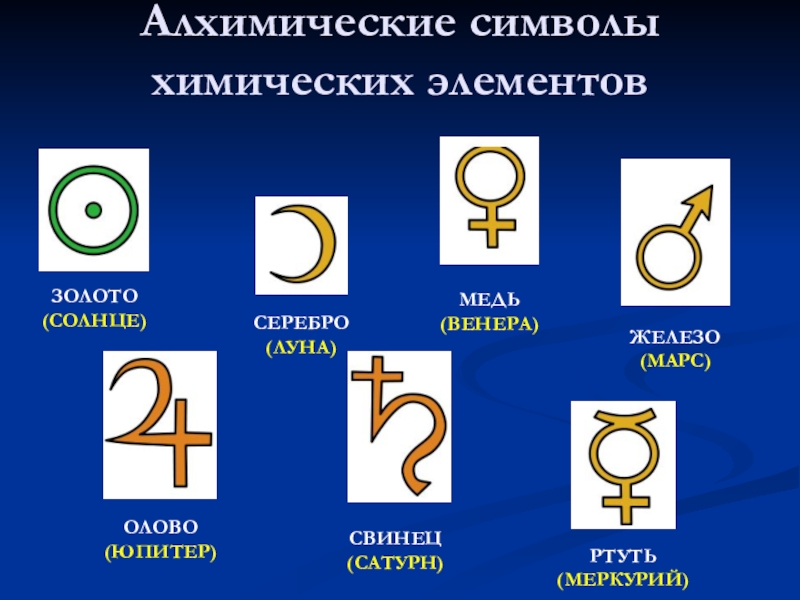
- 11. Алхимические символы химических элементовЗОЛОТО(СОЛНЦЕ)СЕРЕБРО(ЛУНА)МЕДЬ(ВЕНЕРА)ЖЕЛЕЗО(МАРС)ОЛОВО(ЮПИТЕР)СВИНЕЦ(САТУРН)РТУТЬ(МЕРКУРИЙ)
- 12. Для обозначения химических элементов Берцелиус предложил использовать начальные буквы их латинских названий (1814)
- 13. Разгадайте химические анаграммы, переставив буквы в
- 14. Слайд 14
- 15. Запишите знак химического элемента и его произношениеl ВариантКИСЛОРОДКАЛИЙАЗОТРТУТЬСУРЬМАСЕРЕБРОМЕДЬКРЕМНИЙll ВариантУГЛЕРОДКАЛЬЦИЙВОДОРОДСВИНЕЦЗОЛОТООЛОВОМЫШЬЯКЖЕЛЕЗО
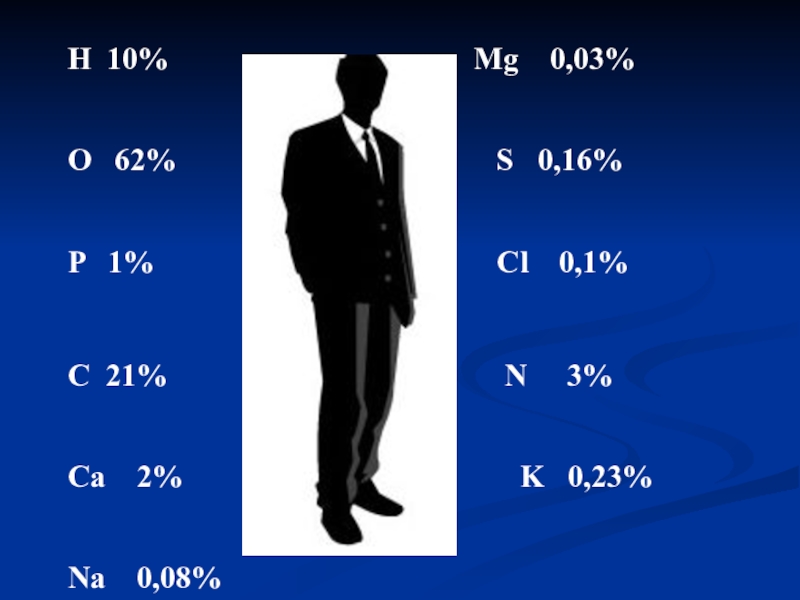
- 16. В организме человека
- 17. Слайд 17
- 18. АТОМНАЯ ЕДИНИЦА МАССЫ≈ 10-10мma≈10-27÷10-25кгАБСОЛЮТНАЯma(H)=1,67375*10-27кгАБСОЛЮТНАЯma(C)=1,9927*10-26кгАБСОЛЮТНАЯma(O)=2,656812*10-26кгАБСОЛЮТНАЯ1 а.е.м.1/12 ma(C)а.е.м. -
- 19. Относительная атомная массаAr(Э)=«relativ»относительныйЕё получают при сравнении масс
- 20. Слайд 20
- 21. Относительная атомная массапоказываетобозначаетсяизмеряетсязначенияво сколько раз масса атома
- 22. Химическая формулаусловная запись состава вещества с помощью
- 23. Относительная молекулярная массавещества BxDyпоказываетобозначаетсяизмеряетсявычисляетсяво сколько раз масса
- 24. Массовая доля элемента ввеществе(BxDy)показываетобозначаетсявыражаетсявычисляетсяКакую долю от
- 25. Химическая формулаСколько атомов?Bx DyКакое вещество?Ar элементов?Какие атомы?Мr
- 26. Сколько атомов?CO2Какое вещество?ArКакие атомы?МrУглерод;кислородсложноеω(Э) %1 атом углерода;2 атома кислородаAr(C)= 12Ar(O)= 16Mr(CO2) = 12+ 16*2 = 44
- 27. 1. Запишите формулу вещества. Ag2OОксиды - это
- 28. 3. Найдите число единиц валентности атомов известного
- 29. 4. Поделите число единиц валентности атомов на
- 30. Обобщённая формула для нахождения валентностей элементов
- 31. 1. Запишите рядом знаки химических элементов, которые
- 32. 2. Над знаками химических элементов поставьте их валентностиAlOIIIIIСоставить химическую формулу оксида алюминия
- 33. 3. Определите НОК валентностей обоих элементовAlOIIIII6Составить химическую формулу оксида алюминия
- 34. 4. Разделите НОК на валентность каждого элемента. Запишите полученный индексAlOIIIII2366IIIII::==Составить химическую формулу оксида алюминия263
- 35. Алгоритм составления химической формулы бинарного соединения по известным валентностямAx ByabAX= BY= abНОК
- 36. закон!m исходных веществ m продуктов реакции
- 37. Ссылка на кинофильмhttp://video.mail.ru/mail/ninrubcov/50-60/5317.html
- 38. ВОДАВОДОРОДКИСЛОРОДЭЛЕКТРИЧЕСКИЙ ТОК+При пропускании постоянного электрического тока через
- 39. Уравнения химических реакций H2O
- 40. Типы химических реакций+Реакции РАЗЛОЖЕНИЯРеакции СОЕДИНЕНИЯ+Реакции ЗАМЕЩЕНИЯ++
- 41. Типы химических реакций+Реакции РАЗЛОЖЕНИЯРеакции СОЕДИНЕНИЯ+Реакции ЗАМЕЩЕНИЯ++
- 42. Количество веществаэто физическая величина, которая означает определенное число структурных частиц (атомов, молекул и др.) и др.)ν(«ню»)
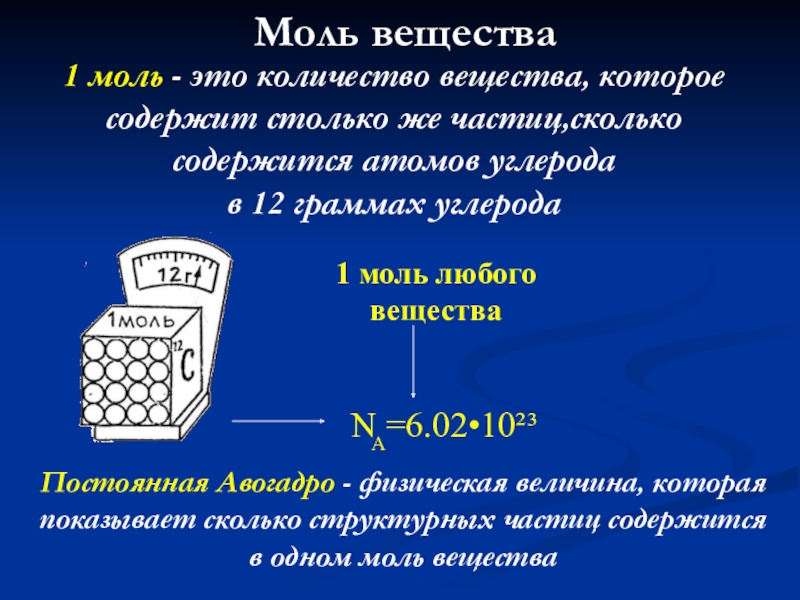
- 43. Моль вещества1 моль - это количество
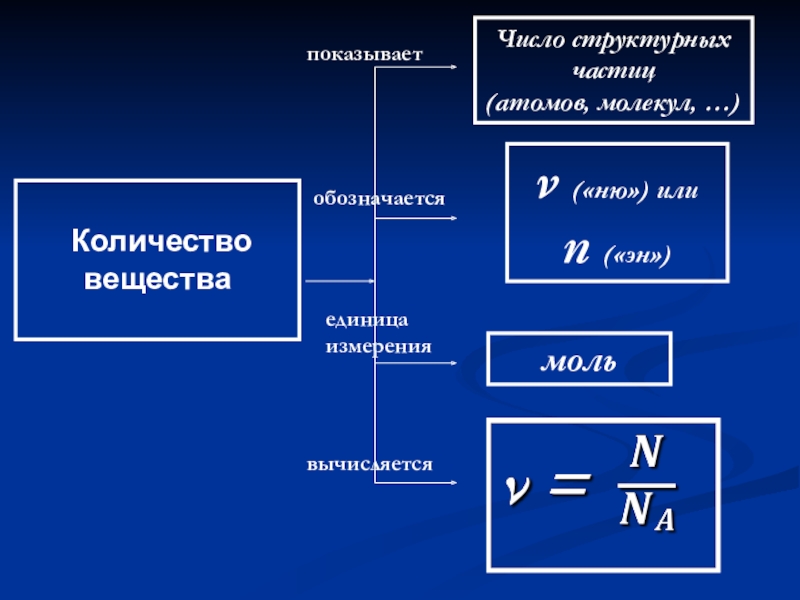
- 44. Количество веществапоказываетобозначаетсяединица измерениявычисляетсяЧисло структурных частиц(атомов, молекул, …)ν («ню») или n («эн») моль
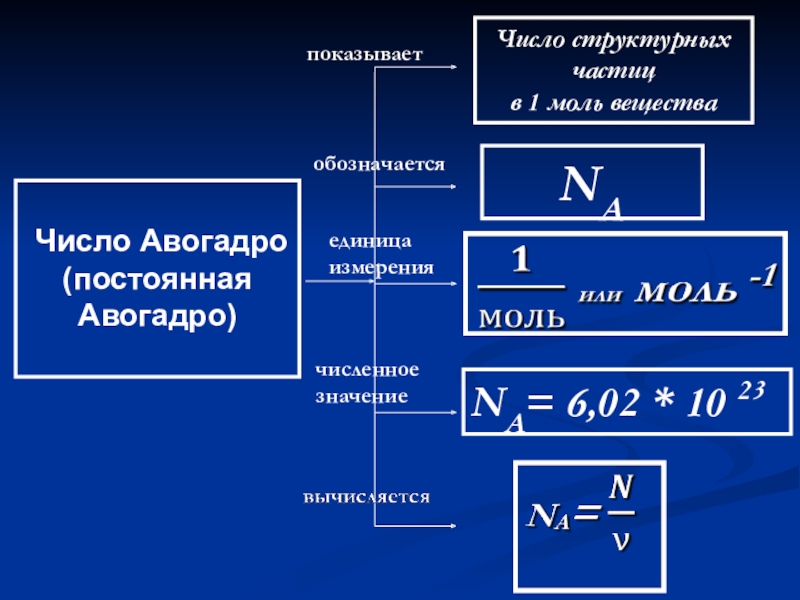
- 45. Число Авогадро(постоянная Авогадро)показываетобозначаетсяединица измерениячисленное значениеЧисло структурных частицв 1 моль веществаNANA= 6,02 * 10 23
- 46. Молярная массаэто физическая величина, которая показывает какова
- 47. Молярная масса разных веществCNaOHFe
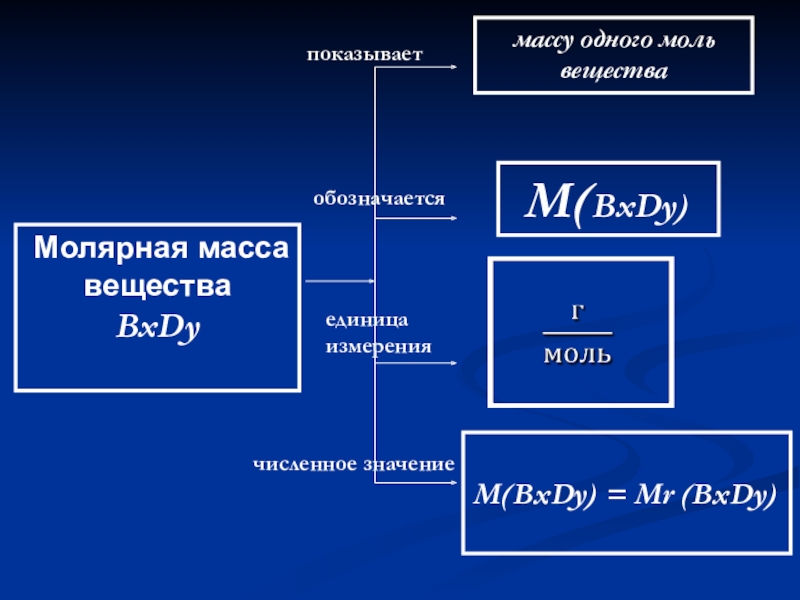
- 48. Молярная масса веществаBxDyпоказываетобозначаетсяединица измерениячисленное значениемассу одного моль веществаМ(BxDy) М(BxDy) = Мr (BxDy)
- 49. Закон АвогадроВ равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул
- 50. Молярный объём1 моль любого газа при нормальных
- 51. Молярный объём показываетобозначаетсяединица измерениявычисляетсякакой объём занимает
- 52. Связь количественных величин
- 53. Список литературы«Обобщающие опорные схемы по химии: методика
Слайд 1Презентация к пропедевтическому курсу химии
«Первоначальные
химические понятия»
7 класс
Автор: учитель химии
МОУ ТСШ 7
Фалюта А. А.
Слайд 4РАЗДЕЛЕНИЕ СМЕСЕЙ
МАГНИТ
ДЕЛИТЕЛЬНАЯ
ВОРОНКА
ВЫПАРИВАНИЕ
ФИЛЬТРОВАНИЕ
ОТСТАИВАНИЕ
ХРОМОТОГРАФИЯ
ДИСТИЛЛЯЦИЯ
Слайд 5Тела состоят из карпускул,
в состав которых входят атомы.
М.В.Ломоносов
Физическое тело
Вещество
Молекулы
Атомы
Слайд 11Алхимические символы химических элементов
ЗОЛОТО
(СОЛНЦЕ)
СЕРЕБРО
(ЛУНА)
МЕДЬ
(ВЕНЕРА)
ЖЕЛЕЗО
(МАРС)
ОЛОВО
(ЮПИТЕР)
СВИНЕЦ
(САТУРН)
РТУТЬ
(МЕРКУРИЙ)
Слайд 12Для обозначения химических элементов Берцелиус предложил использовать начальные буквы их латинских
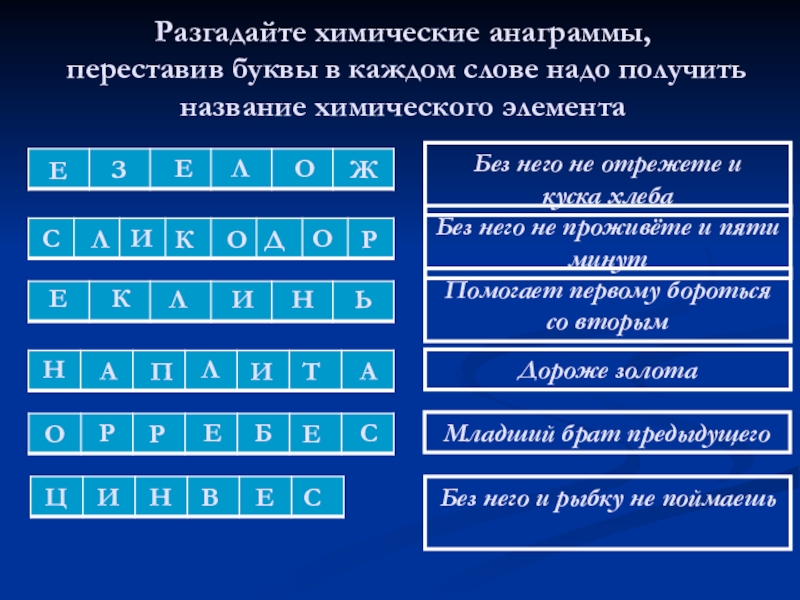
Слайд 13Разгадайте химические анаграммы, переставив буквы в каждом слове надо получить название
Без него не отрежете и
куска хлеба
Ж
Е
З
Е
Л
О
Л
И
К
О
Д
О
Р
С
Без него не проживёте и пяти минут
Е
К
Л
И
Н
Ь
Помогает первому бороться со вторым
П
Н
А
Л
И
Т
А
Дороже золота
О
Р
Р
Е
Б
Е
С
Младший брат предыдущего
С
В
И
Н
Е
Ц
Без него и рыбку не поймаешь
Слайд 15Запишите знак химического элемента и его произношение
l Вариант
КИСЛОРОД
КАЛИЙ
АЗОТ
РТУТЬ
СУРЬМА
СЕРЕБРО
МЕДЬ
КРЕМНИЙ
ll Вариант
УГЛЕРОД
КАЛЬЦИЙ
ВОДОРОД
СВИНЕЦ
ЗОЛОТО
ОЛОВО
МЫШЬЯК
ЖЕЛЕЗО
Слайд 18
АТОМНАЯ ЕДИНИЦА МАССЫ
≈ 10-10м
ma≈10-27÷10-25кг
АБСОЛЮТНАЯ
ma(H)=1,67375*10-27кг
АБСОЛЮТНАЯ
ma(C)=1,9927*10-26кг
АБСОЛЮТНАЯ
ma(O)=2,656812*10-26кг
АБСОЛЮТНАЯ
1 а.е.м.
1/12 ma(C)
а.е.м.
- это 1/12 массы атома углерода,
1 а.е.м. =
=
=
1,66 * 10-27 кг
1 а.е.м. =
Слайд 19
Относительная атомная масса
Ar(Э)=
«relativ»
относительный
Её получают
при сравнении масс атомов разных хмических элементов
безразмерная
Ar
элемента показывает во сколько раз масса его атома больше 1/12 массы атома углерода
m(He)= 4 а.е.м.
Ar(He)=4
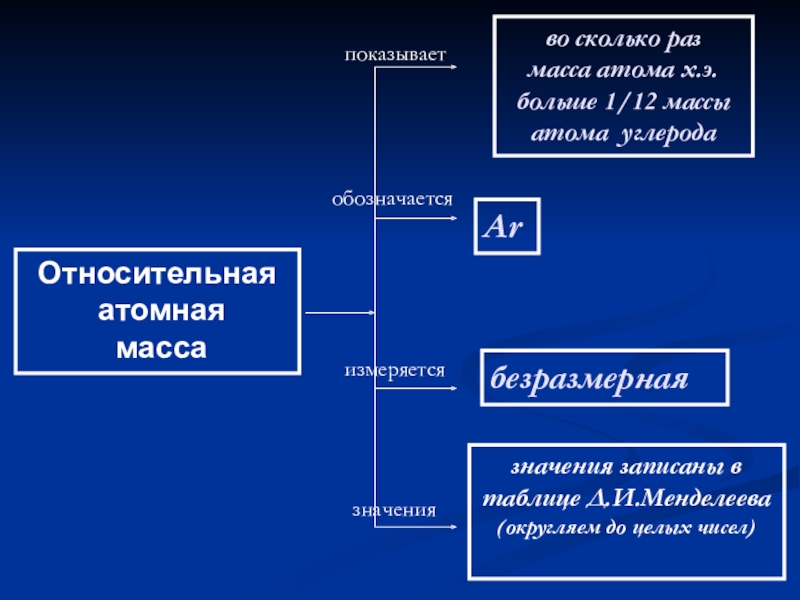
Слайд 21Относительная
атомная
масса
показывает
обозначается
измеряется
значения
во сколько раз
масса атома х.э.
больше 1/12 массы
Ar
безразмерная
значения записаны в таблице Д.И.Менделеева
(округляем до целых чисел)
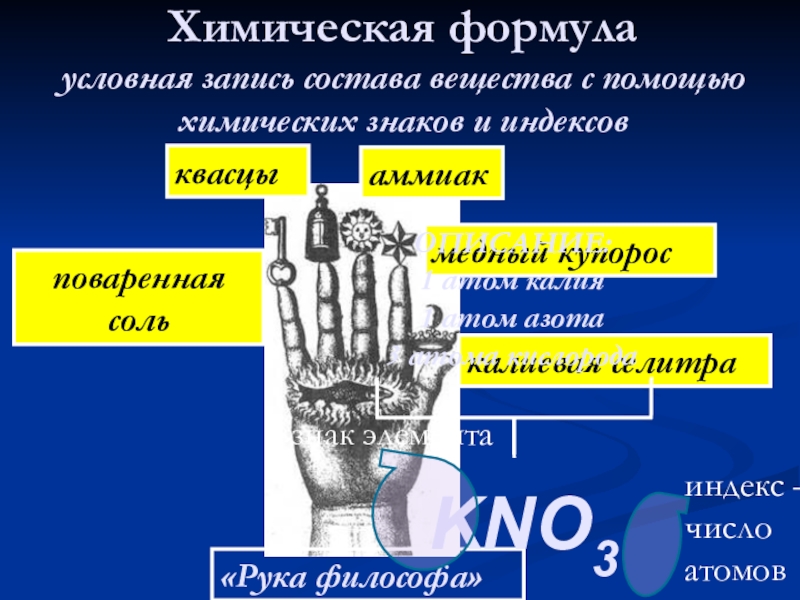
Слайд 22Химическая формула
условная запись состава вещества с помощью химических знаков и индексов
медный
аммиак
квасцы
поваренная соль
калиевая селитра
ОПИСАНИЕ:
1 атом калия
1 атом азота
3 атома кислорода
KNO3
знак элемента
индекс –
число
атомов
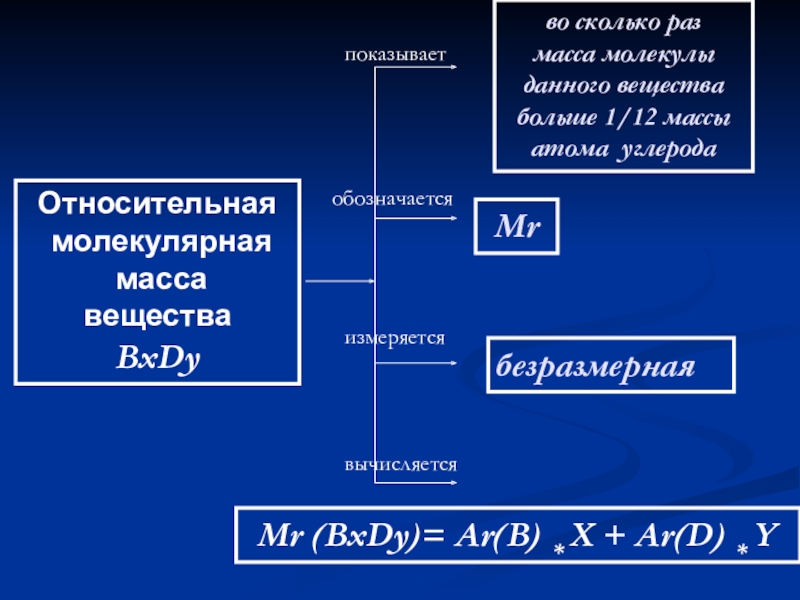
Слайд 23Относительная
молекулярная
масса
вещества
BxDy
показывает
обозначается
измеряется
вычисляется
во сколько раз
масса молекулы данного вещества
больше
Мr
безразмерная
Мr (BxDy)= Ar(B) * X + Ar(D) * Y
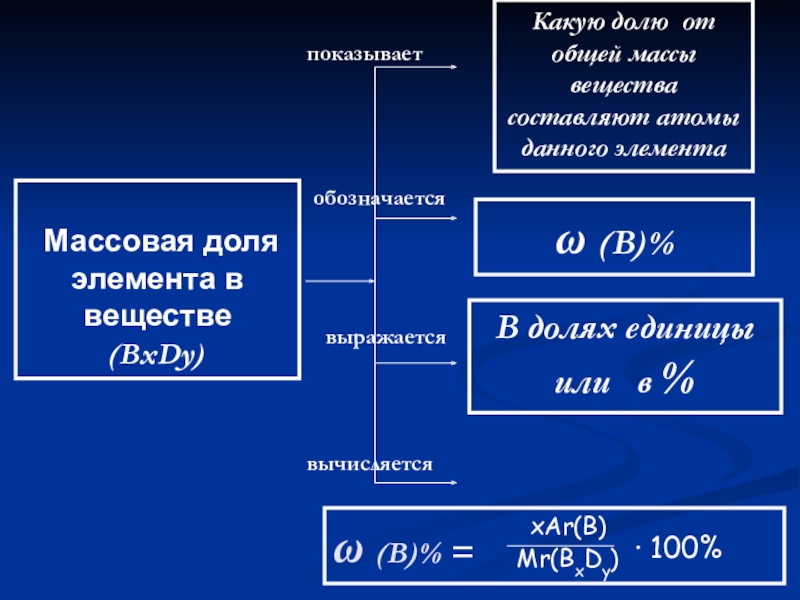
Слайд 24
Массовая доля элемента в
веществе
(BxDy)
показывает
обозначается
выражается
вычисляется
Какую долю от общей массы вещества составляют
ω (В)%
В долях единицы
или в %
ω (В)% =
∙ 100%
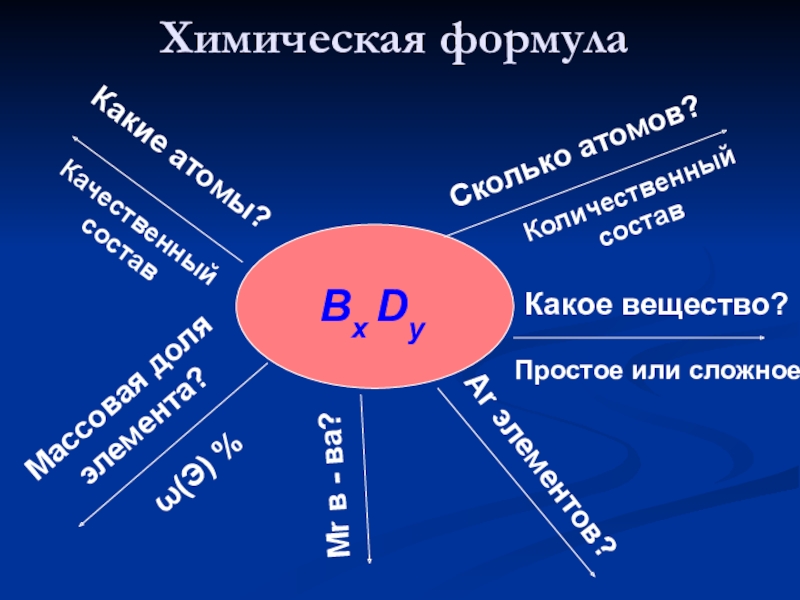
Слайд 25Химическая формула
Сколько атомов?
Bx Dy
Какое вещество?
Ar элементов?
Какие атомы?
Мr в - ва?
Количественный
состав
Качественный
состав
Простое или сложное
Массовая доля
элемента?
ω(Э) %
Слайд 26
Сколько атомов?
CO2
Какое вещество?
Ar
Какие атомы?
Мr
Углерод;
кислород
сложное
ω(Э) %
1 атом углерода;
2 атома кислорода
Ar(C)= 12
Ar(O)= 16
Mr(CO2)
Слайд 271. Запишите формулу вещества.
Ag2O
Оксиды - это сложные вещества, которые состоят
О – II !
Определить валентности элементов в оксиде серебра
2. Обозначьте известную валентность элемента
II
Алгоритм определения валентности по химической формуле вещества
Слайд 283. Найдите число единиц валентности атомов известного элемента, умножив валентность элемента
Ag2O
II
* 1=
1
2
Определить валентности элементов в оксиде серебра
Слайд 294. Поделите число единиц валентности атомов на количество атомов другого элемента.
Ag
2
2
O
: 2 =
I
2
II
Определить валентности элементов в оксиде серебра
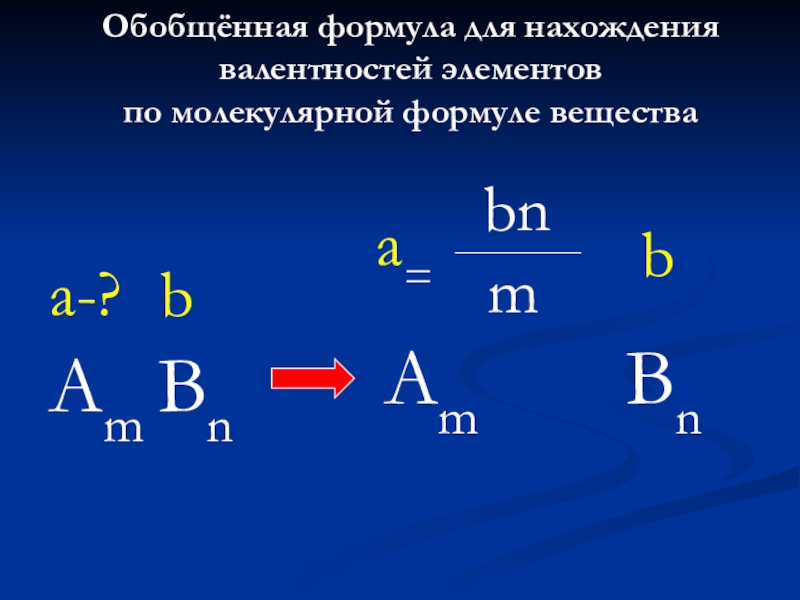
Слайд 30Обобщённая формула для нахождения валентностей элементов
по молекулярной формуле вещества
Am Bn
a-?
b
Am
a=
bn
m
b
Слайд 311. Запишите рядом знаки химических элементов, которые входят в состав вещества.
Al
O
Составить химическую формулу оксида алюминия
Алгоритм составления химической формулы бинарного соединения по известным валентностям
Слайд 322. Над знаками химических элементов поставьте их валентности
Al
O
III
II
Составить химическую формулу оксида
Слайд 333. Определите НОК валентностей обоих элементов
Al
O
III
II
6
Составить химическую формулу оксида алюминия
Слайд 344. Разделите НОК на валентность каждого элемента. Запишите полученный индекс
Al
O
III
II
2
3
6
6
III
II
:
:
=
=
Составить химическую
2
6
3
Слайд 35Алгоритм составления химической формулы бинарного соединения по известным валентностям
Ax By
a
b
AX=
a
b
НОК
Слайд 38ВОДА
ВОДОРОД
КИСЛОРОД
ЭЛЕКТРИЧЕСКИЙ ТОК
+
При пропускании постоянного электрического тока через воду образуются газы водород
Уравнения химических реакций
H2O H2 + O2
m исход. в-в
=
m продукт. р-ции
ЗАКОН!
Mr(H2O)
=
Mr(H2) + Mr(O2)
18
=
2 + 32
18
=
34
исходные в-ва
продукты р-ции
Слайд 39Уравнения химических реакций
H2O
m исход. в-в
=
m продукт. р-ции
ЗАКОН!
2 * Mr(H2O)
=
2 * Mr(H2) + Mr(O2)
2 * 18
=
2 * 2 + 32
36
=
36
2
2
КОЭФФИЦИЕНТЫ
показывают число частиц каждого вещества в реакции
Химическим уравнением называют условную запись химической реакции с помощью химических знаков и формул
Слайд 41Типы химических реакций
+
Реакции РАЗЛОЖЕНИЯ
Реакции СОЕДИНЕНИЯ
+
Реакции ЗАМЕЩЕНИЯ
+
+
H2O2
KNO3 KNO2 + O2
Fe + Cl2 Fe Cl3
CaO + CO2 CaCO3
WO3 + H2 W + H2 O
CaO + CO2 CaCO3
Al + CuCl2 AlCl3 + Cu
2
2
2
2
2
3
2
3
3
2
3
2
3
2
Слайд 42Количество вещества
это физическая величина,
которая означает
определенное число структурных частиц (атомов,
ν(«ню»)
Слайд 43 Моль вещества
1 моль - это количество вещества, которое содержит столько
в 12 граммах углерода
1 моль любого вещества
Постоянная Авогадро - физическая величина, которая показывает сколько структурных частиц содержится в одном моль вещества
Слайд 44
Количество вещества
показывает
обозначается
единица измерения
вычисляется
Число структурных частиц
(атомов, молекул, …)
ν («ню») или
n
моль
Слайд 45
Число Авогадро
(постоянная Авогадро)
показывает
обозначается
единица измерения
численное значение
Число структурных частиц
в 1 моль вещества
NA
NA=
Слайд 46Молярная масса
это физическая величина,
которая показывает какова масса
одного моль вещества
[кг/моль;г/моль]
{M
1моль
12 г /моль
0,5 моль
6 г
12 г /моль
3моль
36 г
12 г /моль
1моль
18 г /моль
0,5 моль
9 г
18 г /моль
2моль
36 г
18 г /моль
1моль
56 г /моль
0,5 моль
28 г
56 г /моль
0,25 моль
14 г
56 г /моль
1моль
32 г /моль
8 г
0,25моль
32 г /моль
4моль
128 г
32 г /моль
Слайд 48 Молярная масса
вещества
BxDy
показывает
обозначается
единица измерения
численное значение
массу одного моль вещества
М(BxDy)
М(BxDy) = Мr
Слайд 49Закон Авогадро
В равных объёмах различных газов при одинаковых условиях содержится одинаковое
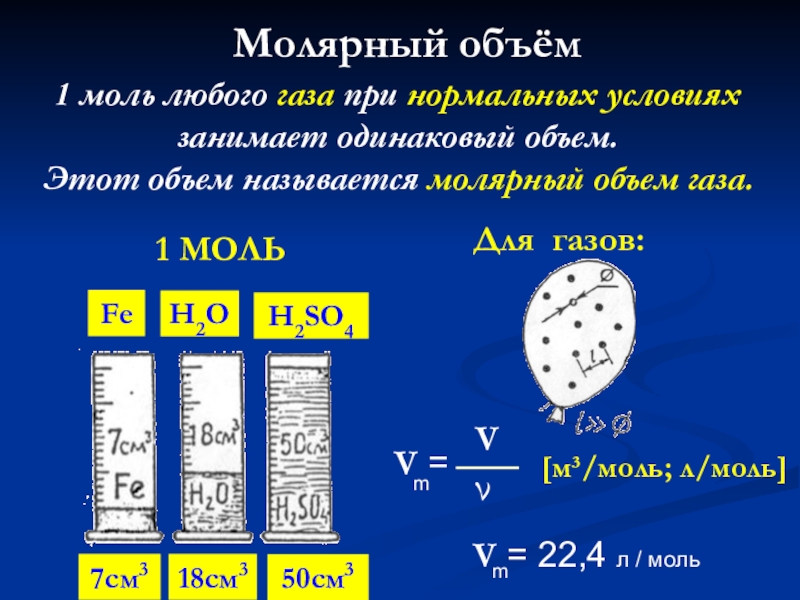
Слайд 50Молярный объём
1 моль любого газа при нормальных условиях занимает одинаковый объем.
Этот объем называется молярный объем газа.
1 МОЛЬ
[м³/моль; л/моль]
7см3
18см3
50см3
Fe
H2O
H2SO4
Для газов:
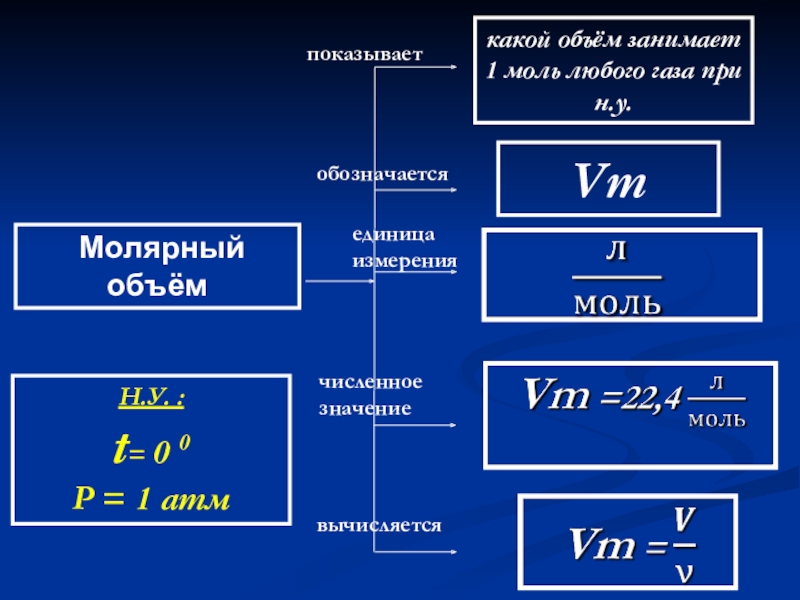
Слайд 51 Молярный объём
показывает
обозначается
единица измерения
вычисляется
какой объём занимает 1 моль любого газа
Vm
Н.У. :
t= 0 0
P = 1 атм
численное значение
Слайд 53Список литературы
«Обобщающие опорные схемы по химии: методика конструирования и использования, примеры
«Химия-8» Г.Е. Рудзитис, Ф.Г. Фельдман
рабочая тетрадь для 8 класса «Первоначальные химические понятия» И.Н. Городничева
рабочая тетрадь для 8 класса «Химические элементы и химические законы» И.А. Леенсон
рабочей тетради для 7 класса О.С. Габриелян, Г.А. Шипарева
«Использование алгоритмов при изучении валентности» Супоницкая И.И.
Авторские разработки, сайт учителя www.netschools.ru/sch518/koridor/him/site/index.htm

























![Презентация по химии на тему Закон Авогадро Молярная массаэто физическая величина, которая показывает какова масса одного моль вещества[кг/моль;г/моль]{M Молярная массаэто физическая величина, которая показывает какова масса одного моль вещества[кг/моль;г/моль]{M г/моль}=Mr1моль12 г /моль0,5 моль6 г12 г](/img/thumbs/53ce26f2a95b6efe01e8eca99ef236e8-800x.jpg)