- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Задачи на выход продукта
Содержание
- 1. Презентация по химии на тему: Задачи на выход продукта
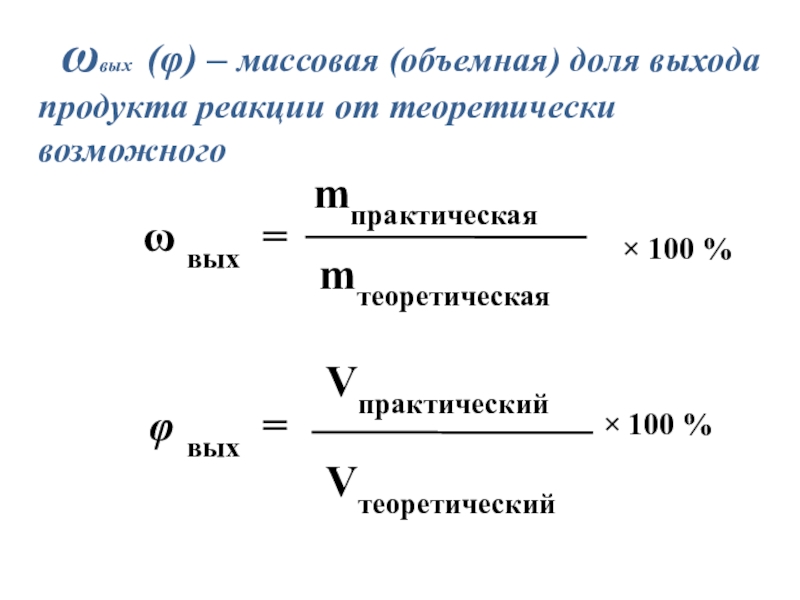
- 2. ωвых (φ) – массовая (объемная) доля выхода продукта реакции от теоретически возможного
- 3. Три варианта задач:Даны массы исходного вещества и
- 4. Прочитаем задачу, запишем условие (дано, найти),составим уравнение
- 5. Найдем количество вещества
- 6. Переведем полученное количество вещества Zn в массу
- 7. Дано: m (Al(OH)3)= 23,4 г ω
- 8. При действии оксида углерода (II) на оксид
- 9. Дано:m пр (Fe) = 11,2 гω вых
- 10. Задачи для самостоятельного решенияДля получения осадка сульфата
Слайд 3Три варианта задач:
Даны массы исходного вещества и продукта реакции. Определить выход
Даны массы исходного вещества и выход продукта реакции. Определить массу продукта.
Даны массы продукта и выход продукта. Определить массу исходного вещества.
Слайд 4Прочитаем задачу, запишем условие (дано, найти),составим уравнение реакции (поставим коэффициенты), подчеркнем,
При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.
Слайд 5
Найдем количество вещества ZnO по формуле: ν=m/М. Подпишем его количество вещества
ν(ZnО)=32,4/81 = 0,4 моль
0,4/3 = х/3
х = 0,4 моль – это теоретическое количество вещества найденное по уравнению
Слайд 6Переведем полученное количество вещества Zn в массу по формуле:
m =
m(Zn) =0,4 моль × 65 г/моль = 26 г – это теоретическая масса Zn.
В задаче в условии дана практическая масса 24 г. Теперь найдем долю выхода продукта от теоретического возможного.
ωвых = = = 0, 92 ( или 92%)
Ответ: ωвых = 92 %
Слайд 7Дано:
m (Al(OH)3)= 23,4 г
ω вых (Al2O3) = 92%
Найти:
m пр (Al2O3)
М(Al(OH)3)= 78 г/моль
Решение:
0,3 моль х
2Al(OH)3 = Al2O3 +3H2O
2 моль 1 моль
Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.
М(Al2O3) = 102 г/моль
(Al(OH)3)= 23,4 г/78 г/моль = 0,3 моль
0,3/2 = х/1 х = 0,15 моль
mтеор. (Al2O3) = n M = 0,15 моль 102 г/моль = 15,3 г
m пр.(Al2O3) = 15,3 г× 0,92 = 14 г
Ответ: m пр.(Al2O3) = 14 г
Слайд 8При действии оксида углерода (II) на оксид железа (III) получено железо
Слайд 9Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
m(Fe2O3) -
M (Fe) = 56 г/моль
М (Fe2O3) =160 г/моль
Решение:
х 0,25 моль
Fe2O3 + 3CO = 2Fe + 3CO2
1 моль 2 моль
Найденную теоретическую массу железа переведем в количество вещества по формуле: ν = m/М
((Fe) = 14 г /56 г/моль = 0,25 моль
Напишем это количество железа над ним в уравнении, над оксидом напишем х.
Решим пропорцию:
х/1 = 0,25/2, х = 0,125 моль
Теперь переведем в массу по формуле:
m = ν×М
m(Fe2O3) = 0,125 моль × 160 г/моль = 20 г
Ответ: m(Fe2O3) = 20 г
Слайд 10Задачи для самостоятельного решения
Для получения осадка сульфата бария была взята серная
Вычислить выход нитрата аммония в % от теоретически возможного, если при пропускании 85 г аммиака через раствор азотной кислоты , было получено 380 г соли
В результате каталитического окисления оксида серы (IV) массой 16 кг избытком кислорода образуется оксид серы (VI). Вычислите массу продукта реакции, если доля его выхода 80% от теоретически возможного .
Вычислите массу азотной кислоты, которую можно получить из 17 г нитрата натрия при его взаимодействии с концентрированной серной кислотой, если массовая доля выхода кислоты составляет 0,96.
На гашёную известь, взятую в необходимом количестве, подействовали 3,15 кг чистой азотной кислотой. Какую массу нитрата кальция получили, если практический выход в массовых долях составляет 0,98 или 98% по сравнению с теоретическим?