- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Задачи на вычисление объёма газообразного вещества
Содержание
- 1. Презентация по химии на тему Задачи на вычисление объёма газообразного вещества
- 2. Содержание примеси обычно выражают в процентах. Эта
- 3. 1. Вычислите объем (в литрах) углекислого газа, полученного
- 4. Слайд 4
- 5. Чтобы определить объем углекислого газа, необходимо знать
- 6. Чтобы определить объем углекислого газа, необходимо знать
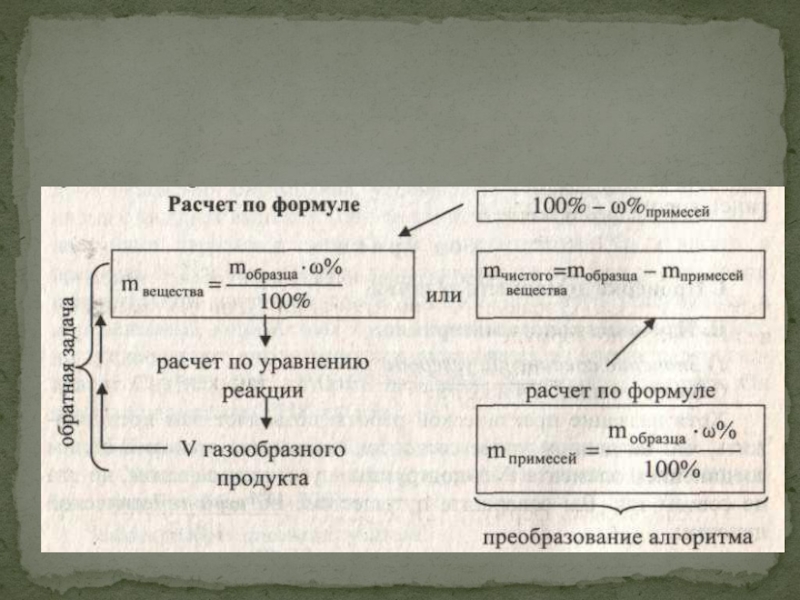
- 7. Следовательно, план решения таков:1. Найти m примесей или
- 8. Чтобы определить ω% (Na2СОз), необходимо использовать формулу
- 9. Слайд 9
- 10. Решите задачи:Вариант 1А) Вычислите, какой объём (н.у.)
Слайд 1«РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ НА ВЫЧИСЛЕНИЕ ОБЪЕМА ГАЗООБРАЗНОГО ПРОДУКТА РЕАКЦИИ, ПОЛУЧЕННОГО ИЗ
Слайд 2Содержание примеси обычно выражают в процентах. Эта величина показывает массовую или
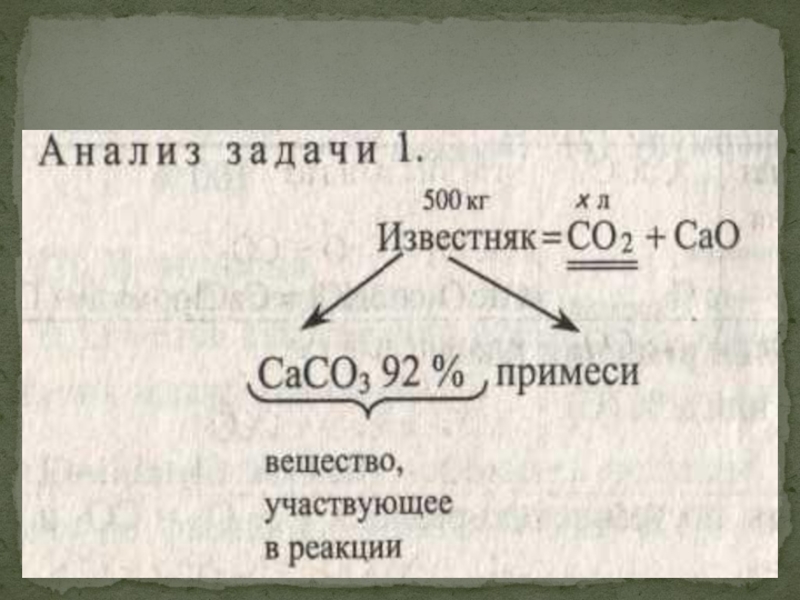
Слайд 31. Вычислите объем (в литрах) углекислого газа, полученного при обжиге 500 кг
2. Какой объем (в литрах) оксида углерода (IV) выделится при сжигании 20 г кокса, содержащего 2 % примесей.
3. При взаимодействии 10,8 г кальцинированной соды с избытком соляной кислоты получили 2,24 л (при н. у.) оксида углерода (IV). Вычислите содержание примеси в соде.
Решите задачи:
Слайд 5Чтобы определить объем углекислого газа, необходимо знать массу карбоната кальция, разлагающегося
Следовательно, план решения таков:
1. Найти m(СаСОз) по формуле.
2. Сделать расчеты по уравнению реакции СаСОз = СОг + СаО и определить объем СО2.
Слайд 6Чтобы определить объем углекислого газа, необходимо знать массу углерода, сгорающего при
Слайд 7Следовательно, план решения таков:
1. Найти m примесей или ωСО % (С).
2. Найти m
3. Сделать расчеты по уравнению реакции С + О2 = СО2 и определить объем СО2.
Слайд 8Чтобы определить ω% (Na2СОз), необходимо использовать формулу (1), но данную величину
Следовательно, план решения таков:
1) Сделать расчеты по уравнению реакции:
Na2CO3 + 2HC1 = Н2О + СО2 + 2NaCl и определить m(Na2CO3).
2) Найти со %(Na2CO3) по формуле.
Слайд 10Решите задачи:
Вариант 1
А) Вычислите, какой объём (н.у.) углекислого газа можно получить
Б) При обработке соляной кислотой природного известняка массой 30 кг получен оксид углерода (IV)? , его объём 5,6 м3 (н.у.). Вычислите массовую долю карбоната кальция в природном известняке.
В) При обжиге 1 кг известняка, содержащего 10 % примесей, получили 0,17 м3 углекислого газа. Вычислите объёмную долю выхода продукта реакции от теоретически возможного.
Вариант 2
А) Рассчитайте массу оксида магния, который образуется при обжиге карбоната магния массой 200 г, содержащего 10 % примесей.
Б) При обжиге известняка массой 500 кг получили 103 м3 углекислого газа. Вычислите массу примесей в этом известняке.
В) При обжиге 560 г известняка, содержащего 10 % примесей, получили оксид кальция, который затем поместили в 10 % раствор соляной кислоты массой 730 г. Вычислите массу полученной соли.