- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ядерная модель атома.Электроны (7 класс)
Содержание
- 1. Презентация по химии на тему Ядерная модель атома.Электроны (7 класс)
- 2. В результате изучения темы ,вы будете способны:Рассматривать
- 3. “Периодическому закону будущее не грозит разрушением,
- 4. ДемокритВ основе философии Демокрита лежит учение об
- 5. Модель ТомсонаВ 1904 году Томсон представил свою
- 6. Опыт Резерфорда Резерфорд исследовал особенности
- 7. Планетарная модель атома РезерфордаПланетарная модель атома калияВ
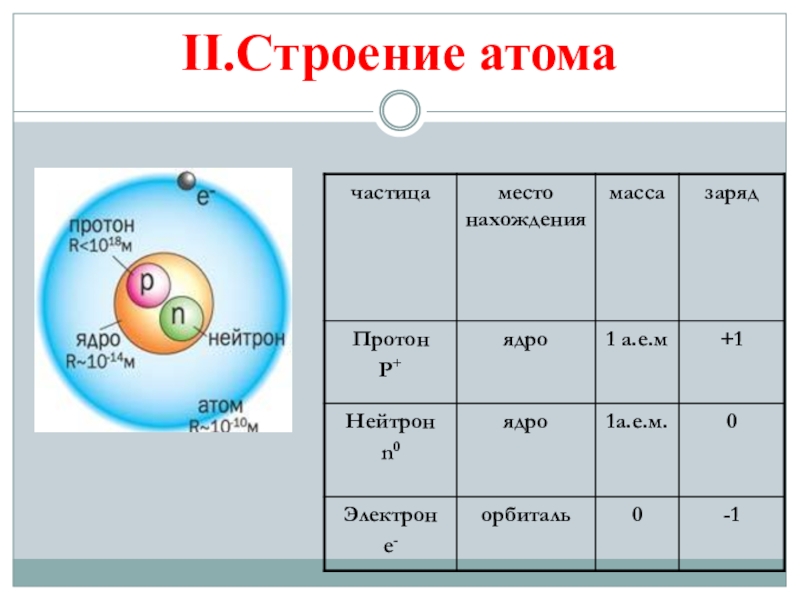
- 8. II.Строение атома
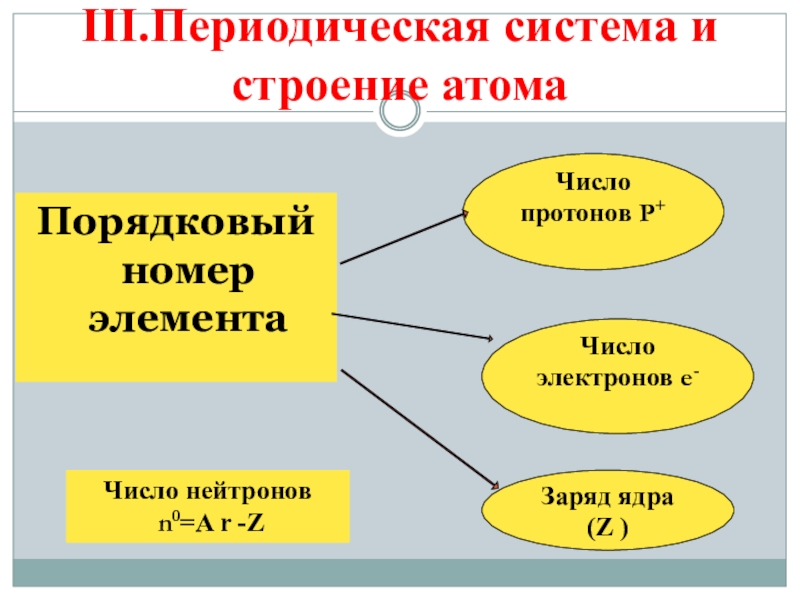
- 9. III.Периодическая система и строение атомаПорядковый
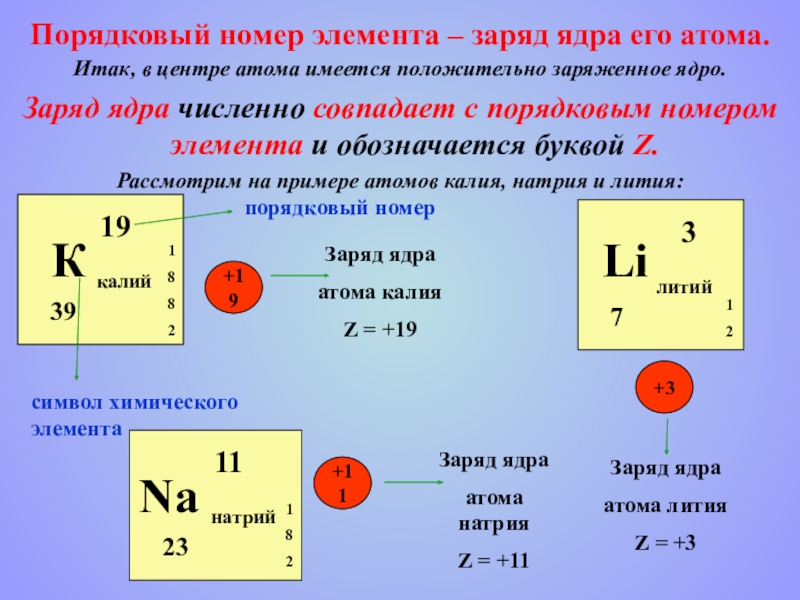
- 10. Итак, в центре атома имеется положительно заряженное
- 11. Задание 1.А) По периодической системе химических элементов
- 12. Вокруг положительно заряженного ядра атома движутся отрицательно
- 13. А) По периодической системе химических элементов найдите
- 14. Слайд 14
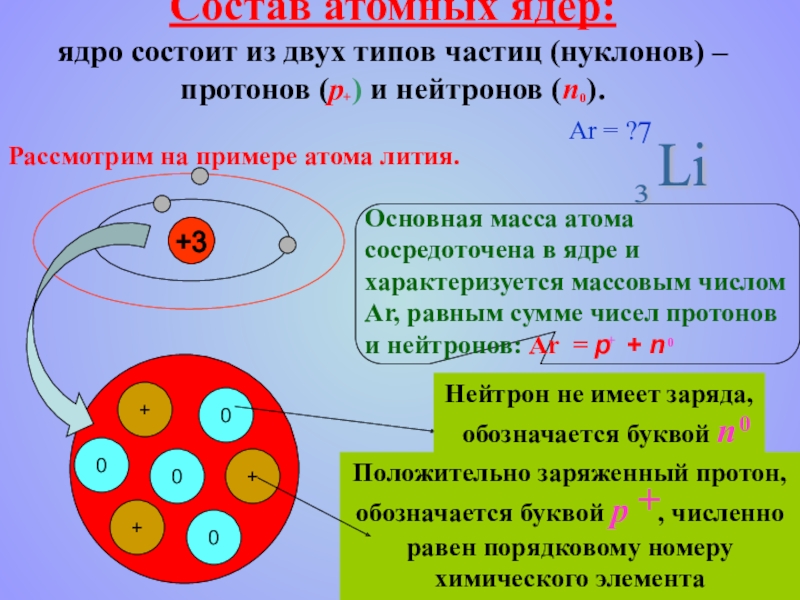
- 15. Состав атомных ядер: ядро состоит из
- 16. Атом натрия
- 17. Определите, ядра каких атомов представлены насхемах? (зеленые
- 18. Планетарная модель атома лития по Резерфорду:
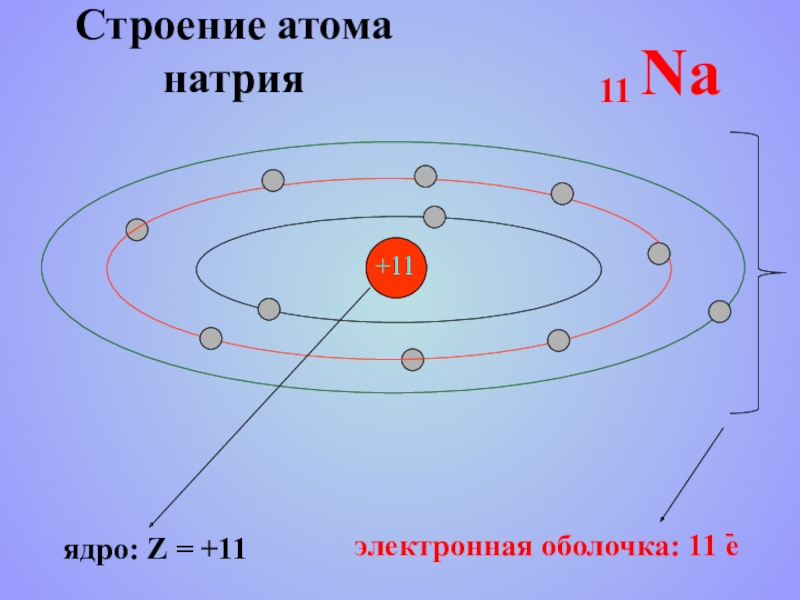
- 19. Строение атома натрия +11
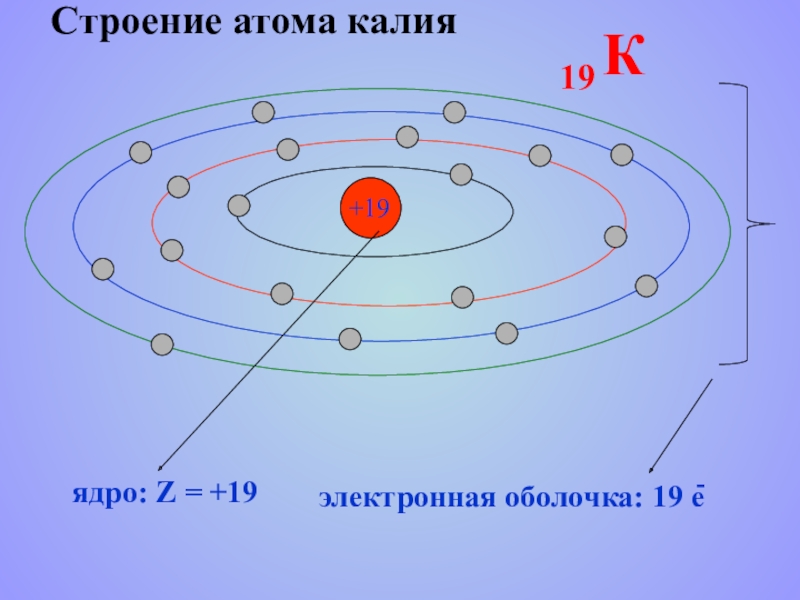
- 20. Строение атома калия +19
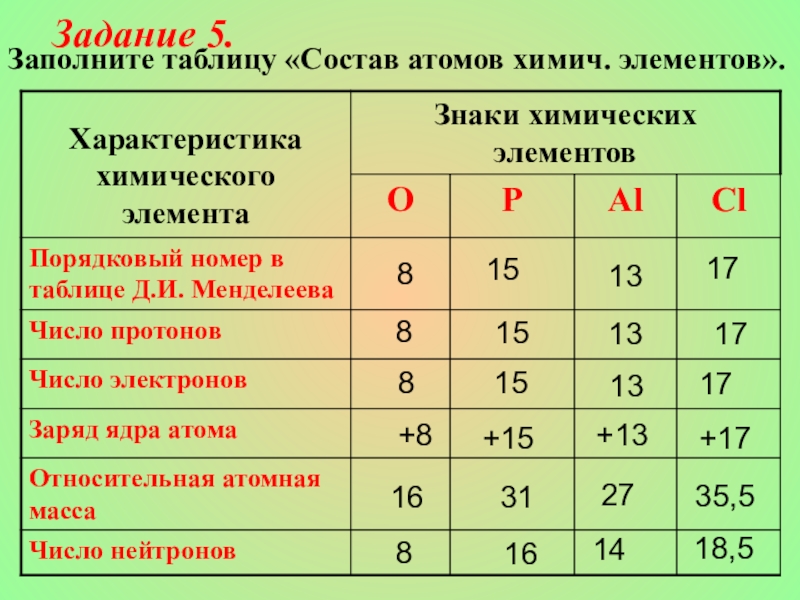
- 21. Заполните таблицу «Состав атомов химич. элементов».1717+1735,518,5Задание 5.888+8168151515+153116131313+13271417
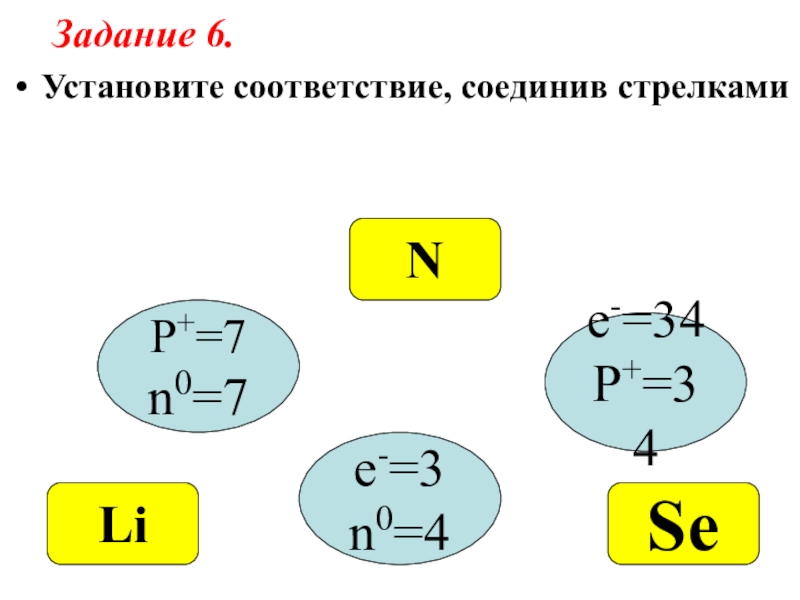
- 22. Установите соответствие, соединив стрелкамиP+=7n0=7e-=34P+=34e-=3n0=4NSeLiЗадание 6.
- 23. Тест:1.Заряд ядра атома азота равен :
- 24. «Острова»о. ГрустиО. Удовольствияо.Тревогио.Просветленияо. Воодушевленияо.Неопределенностио. Недоуменияо.Радостио.Бермудскийтреугольник
- 25. МОЛОДЦЫ !!!Вы справились. Желаю дальнейших успехов в изучении химии!
- 26. Домашнее заданиеРазобрать и выучить конспект.Выучить параграф: §
Слайд 2В результате изучения темы ,вы будете способны:
Рассматривать теории открытия атома.
Описывать сложную
Знакомиться со строением атома
Устанавливать связь между понятиями: порядковый номер элемента–заряд ядра–общее число электронов.
Определять химический элемент как вид атомов с одинаковым зарядом ядра.
Осуществлять рефлексию учебной деятельности на уроке
Слайд 3“Периодическому закону будущее не грозит разрушением, а только надстройки и развитие
Слайд 4Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте как
I.История открытия строения атома
Слайд 5Модель Томсона
В 1904 году Томсон представил свою новую модель атома. Она
« Пудинг с изюмом »
Слайд 6Опыт Резерфорда
Резерфорд исследовал особенности прохождения альфа-частиц через тонкие
На основании этих опытов ученый предложил планетарную модель атома: в центре атома - ядро, вокруг которого вращаются электроны.
Слайд 7Планетарная модель атома Резерфорда
Планетарная модель атома калия
В 1911 году в Кембридже,
Солнечная система
Слайд 9III.Периодическая система и строение атома
Порядковый номер элемента
Число протонов P+
Число электронов e-
Заряд ядра (Z )
Число нейтронов
n0=A r -Z
Слайд 10Итак, в центре атома имеется положительно заряженное ядро.
Заряд ядра численно
Рассмотрим на примере атомов калия, натрия и лития:
Порядковый номер элемента – заряд ядра его атома.
Слайд 11Задание 1.
А) По периодической системе химических элементов найдите заряды ядер атомов
Al, P, Cl, O
Б) Найдите неправильные ответы:
Al: Z = 13, P: Z = + 16, Br: Z = + 35,
Cl: Z = +18, N: Z = + 7, O: Z = + 9.
+13, +15, +35, +17
Слайд 12Вокруг положительно заряженного ядра атома движутся отрицательно заряженные электроны, образуя электронную
Слайд 13А) По периодической системе химических элементов найдите число электронов атомов Al,
Задание 2.
13, 15, 35, 17
Al, P, Br, N.
Слайд 15Состав атомных ядер: ядро состоит из двух типов частиц (нуклонов) –
Рассмотрим на примере атома лития.
+
0
Ar = ?
7
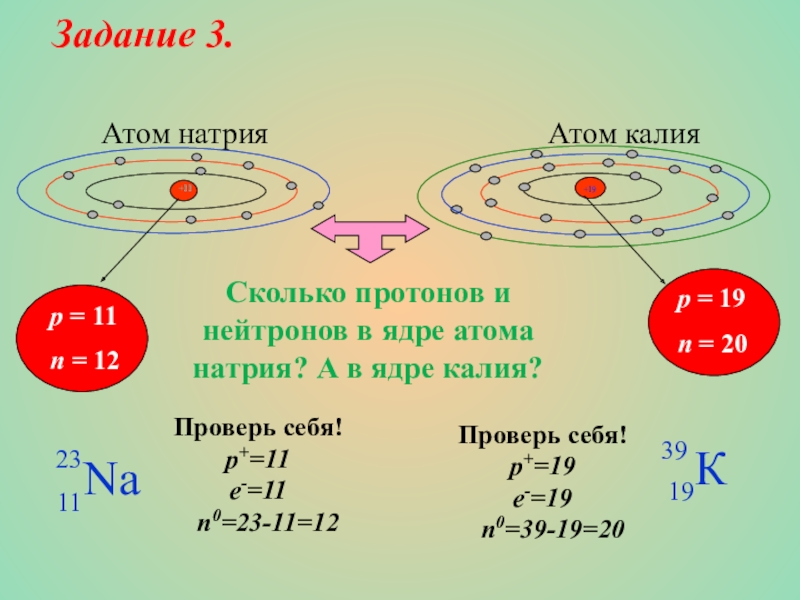
Слайд 16 Атом натрия
p = 11
n = 12
p = 19
n = 20
Проверь себя!
p+=19
e-=19
n0=39-19=20
Проверь себя!
p+=11
e-=11
n0=23-11=12
Задание 3.
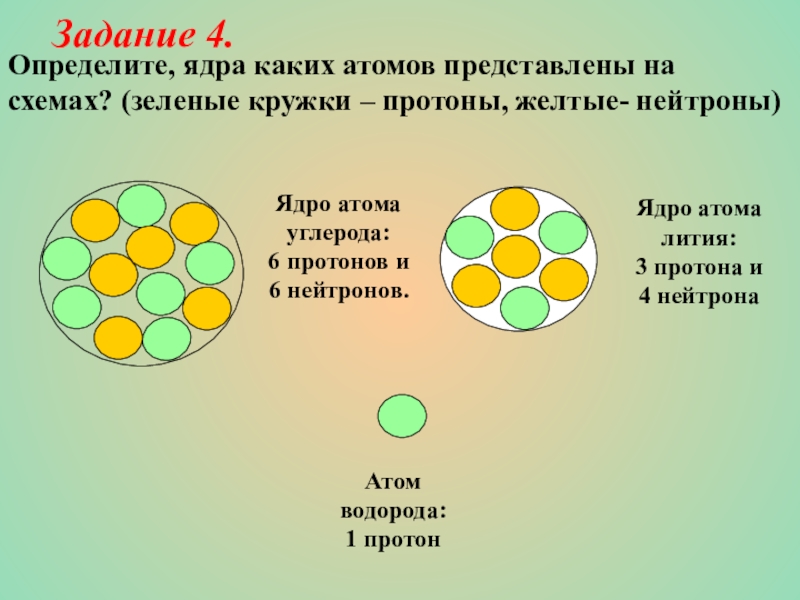
Слайд 17Определите, ядра каких атомов представлены на
схемах? (зеленые кружки – протоны, желтые-
Ядро атома углерода: 6 протонов и 6 нейтронов.
Ядро атома лития: 3 протона и 4 нейтрона
Атом водорода: 1 протон
Задание 4.
Слайд 18 Планетарная модель атома лития по Резерфорду:
Вокруг положительно заряженного ядра
+3
Строение атома лития
Слайд 21
Заполните таблицу «Состав атомов химич. элементов».
17
17
+17
35,5
18,5
Задание 5.
8
8
8
+8
16
8
15
15
15
+15
31
16
13
13
13
+13
27
14
17
Слайд 23Тест:
1.Заряд ядра атома азота равен :
2.Число протонов в ядре атома хлора :
а ) 36 в) 4 г) 31 д) 6
3.Число нейтронов в ядре атома цинка :
а) 8 в)11 г)30 д)4
4.Число электронов в атоме железа :
а) 11 б)8 г)26 д)30
Задание 7.
а)7
б)17
б)35
в)56
МОЛОДЦЫ !
ЭТО ВАМ УДАЛОСЬ !!