- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Вычисление массовой доли элемента
Содержание
- 1. Презентация по химии на тему Вычисление массовой доли элемента
- 2. Цель: Обобщить и систематизировать знания учащихся в
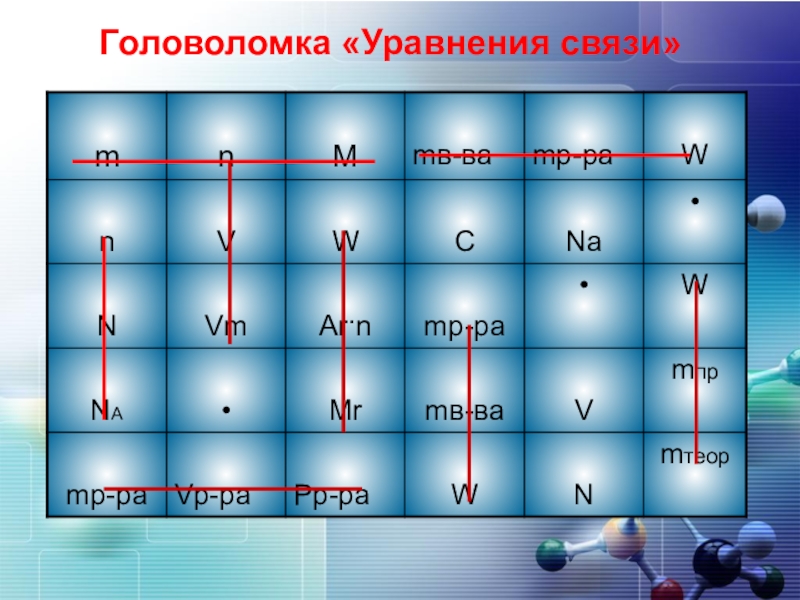
- 3. 0Головоломка «Уравнения связи»
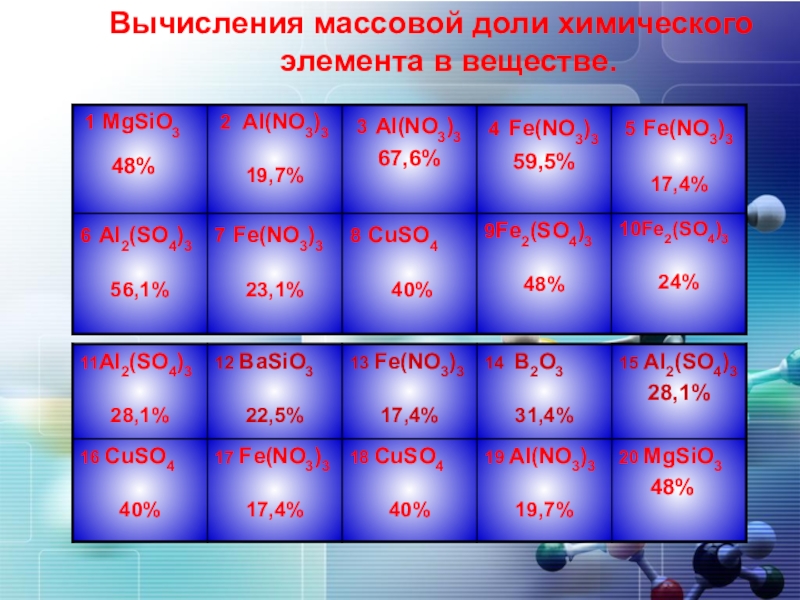
- 4. Вычисления массовой доли химического элемента в веществе.
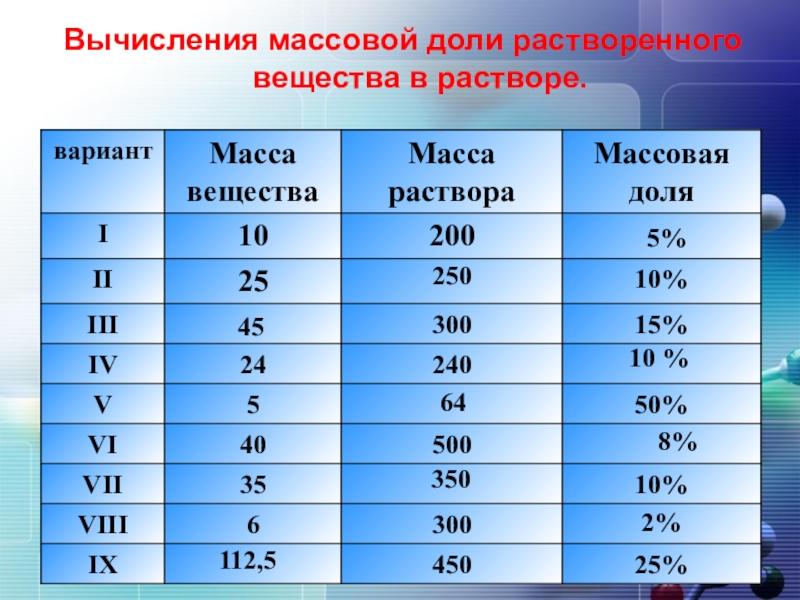
- 5. Вычисления массовой доли растворенного вещества в растворе.5%25045 10 %648%3502%112,5
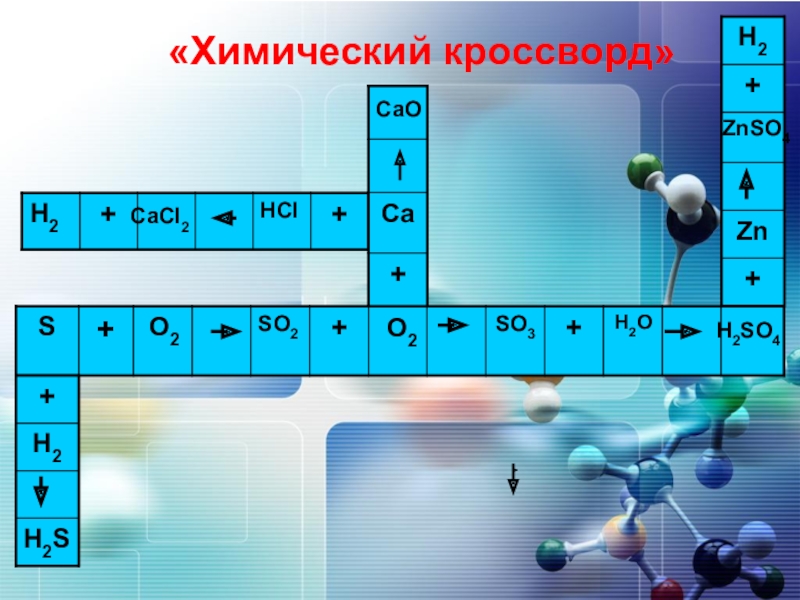
- 6. «Химический кроссворд»O2O2CaOH2SO4CaCI2ZnSO4
- 7. CaHNO3SNaH2H2SO4O2Fe2O3
- 8. Вычисления с помощью уравнений реакций.Составляем уравнение реакцииОпределяем
- 9. Задача: Вычислите объем водорода, выделившегося при взаимодействии
- 10. Избыток или недостаток?Запомните:Приступая к решению задачи, надо
- 11. Слайд 11
Цель: Обобщить и систематизировать знания учащихся в области решения задач. Закрепить умения и навыки по решению задач, с использованием понятий массовая доля. План урока:1. Вычисления массовой доли химического элемента в веществе.2. Вычисления массовой доли
Слайд 2
Цель: Обобщить и систематизировать знания
учащихся в области решения задач.
Закрепить
умения и навыки по решению задач, с
использованием понятий массовая доля.
План урока:
1. Вычисления массовой доли химического
элемента в веществе.
2. Вычисления массовой доли растворенного
вещества в растворе.
3. Вычисления с помощью уравнений реакций.
умения и навыки по решению задач, с
использованием понятий массовая доля.
План урока:
1. Вычисления массовой доли химического
элемента в веществе.
2. Вычисления массовой доли растворенного
вещества в растворе.
3. Вычисления с помощью уравнений реакций.
Слайд 8
Вычисления с помощью уравнений реакций.
Составляем уравнение реакции
Определяем молярные массы
(для газов- молярные
объемы) и записываем их,
3. Находим число молей вещества, массу или объем которого известны,
4. Определяем по уравнению реакции, в каких мольных соотношениях находятся взятые для расчета вещества,
5. Рассчитываем массу или объем искомого вещества
6. Формулируем ответ.
3. Находим число молей вещества, массу или объем которого известны,
4. Определяем по уравнению реакции, в каких мольных соотношениях находятся взятые для расчета вещества,
5. Рассчитываем массу или объем искомого вещества
6. Формулируем ответ.
Слайд 9
Задача:
Вычислите объем водорода, выделившегося при
взаимодействии цинка массой 13 г,
с разбавленной серной кислотой.
Zn+H2SO4→ZnSO4+H2↑
M(Zn)=65 г/моль
Vm(H2)=22,4 л/моль
3) n(Zn)=m/M
n(Zn)=13г : 65 г/моль=0,2 моль
4) n(Zn)=n(H2)
5) V(H2)= n•Vm
6) V(H2)=0,2моль•22,4л/моль=4,48л
Ответ: 4,48 л.
Zn+H2SO4→ZnSO4+H2↑
M(Zn)=65 г/моль
Vm(H2)=22,4 л/моль
3) n(Zn)=m/M
n(Zn)=13г : 65 г/моль=0,2 моль
4) n(Zn)=n(H2)
5) V(H2)= n•Vm
6) V(H2)=0,2моль•22,4л/моль=4,48л
Ответ: 4,48 л.
Слайд 10
Избыток или недостаток?
Запомните:
Приступая к решению задачи, надо обратить внимание на наличие
«лишних» данных в ее условии: они указывают на то, что одно из реагирующих веществ взято в избытке.
если это имеет место, надо провести расчет по уравнению реакции и обнаружить это вещество,
решать задачу, используя в расчетах тот
реагент, который израсходуется полностью
если это имеет место, надо провести расчет по уравнению реакции и обнаружить это вещество,
решать задачу, используя в расчетах тот
реагент, который израсходуется полностью