- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Восьмая группа побочная подгруппа
Содержание
- 1. Презентация по химии на тему Восьмая группа побочная подгруппа
- 2. К восьмой группе побочной подгруппе относятся три
- 3. Относятся к редким элементам. В природе находятся,
- 4. Платиновых металлов связано с их каталитическими свойствами.Платиноиридиевые
- 5. Fe8 группа побочная подгруппа, 4 периодпорядковый номер
- 6. Нахождение в природегематит (красный железняк)– Fe2O3 содержит
- 7. Железо относится к металлам со средней восстановительной
- 8. При взаимодействии с сильными окислителями железо
- 9. Концентрированные азотная и серная кислоты пассивируют
- 10. Восстановление железа из оксидов разными восстановителями:Водородом Fe2O3
- 11. Железо – один из самых
- 12. Железо также входит в состав
- 13. Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтеров
- 14. Ерохин Ю.М. Химия для профессий и специальностей
Слайд 1Побочная подгруппа
VIII группы периодической системы
Афанасьева Людмила Владимировна преподаватель ФГБОУ ВО
Слайд 2К восьмой группе побочной подгруппе относятся три триады d-элементов.
Первая триада -
вторая триада – рутений, родий и палладий;
третья триада – осмий, иридий и платина.
Железо, кобальт и никель очень сходны по физическим и химическим свойствам и сильно отличаются от элементов двух других триад. Поэтому их выделяют в семейство железа. Остальные шесть элементов объединяют под общим названием платиновых металлов.
Слайд 3Относятся к редким элементам. В природе находятся, в основном, в самородном
Светло-серые ,тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие.
Красивый внешний вид платиновых металлов обусловлен их инертностью.
Хорошо сплавляются со щелочами в присутствии окислителей.
Платиновые металлы
Слайд 4Платиновых металлов связано с их каталитическими свойствами.
Платиноиридиевые сплавы используются в ювелирном
Термопары из платинородиевой проволоки позволяют измерять температуру до 1800C.
Применение
Слайд 5
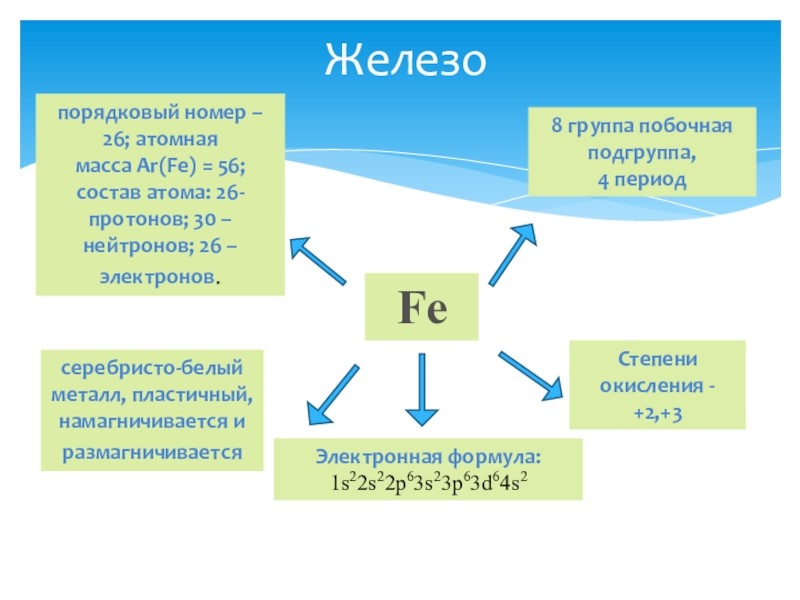
Fe
8 группа побочная подгруппа,
4 период
порядковый номер – 26; атомная масса Ar(Fe)
Степени окисления - +2,+3
серебристо-белый металл, пластичный, намагничивается и размагничивается
Электронная формула: 1s22s22p63s23p63d64s2
Железо
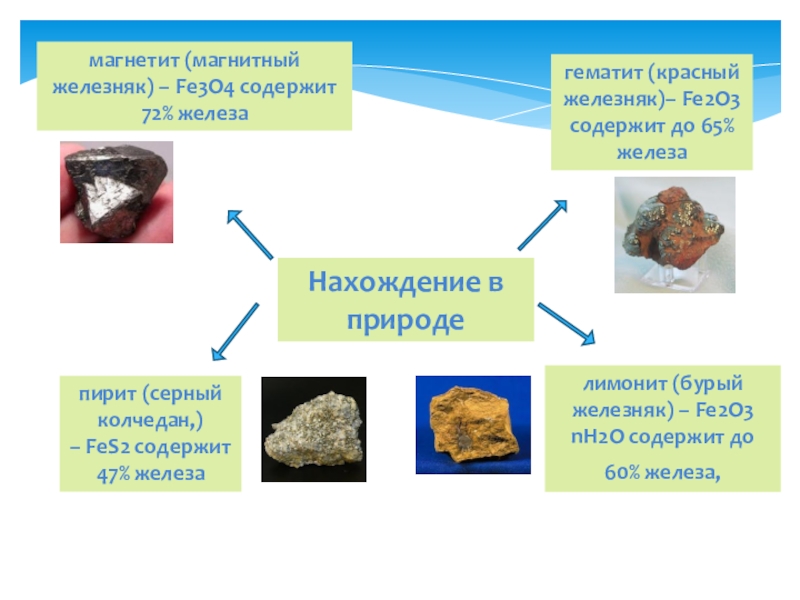
Слайд 6Нахождение в природе
гематит (красный железняк)– Fe2O3 содержит до 65% железа
магнетит (магнитный железняк)
лимонит (бурый железняк) – Fe2O3 nH2O содержит до 60% железа,
пирит (серный колчедан,) – FeS2 содержит 47% железа
Слайд 7Железо относится к металлам со средней восстановительной способностью.
При обычной температуре оно
3Fe + 2O2 = Fe3O4
В присутствии влаги железо на воздухе окисляется быстрее и ржавеет:
4Fe + 3O2 + nH2O = 2Fe2O3 • nH2O
Химические свойства железа
Слайд 8 При взаимодействии с сильными окислителями железо образует соединения в степени
2Fe + 3Cl2 = 2FeCl3
При взаимодействии железа с более слабым окислителем образуется соединение железа (II)
Fe + S = FeS
Железо взаимодействует с разбавленными соляной и серной кислотами с выделением водорода
Fe + 2HCL = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
Слайд 9 Концентрированные азотная и серная кислоты пассивируют железо. При нагревании эти
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Железо вытесняет металлы из водных растворов солей, которые в электрохимическом ряду напряжения металлов стоят правее его
CuSO4 +Fe = FeSO4 + Cu.
Слайд 10Восстановление железа из оксидов разными восстановителями:
Водородом
Fe2O3 + 3H2 = 2Fe
Оксидом углерода (II) CO Fe2O3 + 3СО =2Fe + 3СО2 Коксом С Fe2O3 + 3С = 2Fe + 3СО
*Алюминотермия
3 Fe3O4 + 8Аl = 9Fe + 4Al2O3
* Электролиз водных растворов солей
Получение железа
Слайд 11 Железо – один из самых используемых металлов, на него
Чистое железо быстро намагничивается и размагничивается, поэтому его применяют для изготовления сердечников, трансформаторов, мембраноматоров, электромагнитов и мембран микрофонов, электродвигателей.
Чаще всего используют сплавы железа - чугун и сталь, основной конструкционный материал.
Применение
Слайд 12 Железо также входит в состав сплавов на основе других
Магнитная окись железа (магнетит) — применяется в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Слайд 14Ерохин Ю.М. Химия для профессий и специальностей технического и естественно-научного профилей:
Неорганическая химия: Учебное пособие / Богомолова И.В. - М.: Альфа-М, ИНФРА-М, 2016. - 336 с.: 60x90 1/16. - (ПРОФИль) (Переплёт) ISBN 978-5-98281-187-5 - Режим доступа: http://znanium.com/catalog/product/538925
Стась, Н. Ф. Общая и неорганическая химия [Электронный ресурс] : справочник для СПО / Н. Ф. Стась ; под ред. А. П. Ильин. — Электрон.текстовые данные. — Саратов : Профобразование, 2017. — 92 c. — 978-5-4488-0022-1. — Режим доступа: http://www.iprbookshop.ru/66393.html
Оганесян Э.Т. Руководство по химии поступающим в ВУЗЫ: Справ. пособие.- 2-еизд., перераб. и доп. – М.: Высш. шк., 1992 – 464с.: ил.
Литература