- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Серная кислота (9 класс)
Содержание
- 1. Презентация по химии Серная кислота (9 класс)
- 2. ТЕМА: «СЕРНАЯ КИСЛОТА-
- 3. Проверка домашнего задания.
- 4. ТЕСТА) усиливаютсяБ) не изменяютсяВ) ослабеваютГ) изменяются периодически2.
- 5. 3. Найдите формулу, соответствующую электронной конфигурации внешнего
- 6. 5. Взаимодействие серы с каким металлом происходит
- 7. Химические свойства серной кислоты.
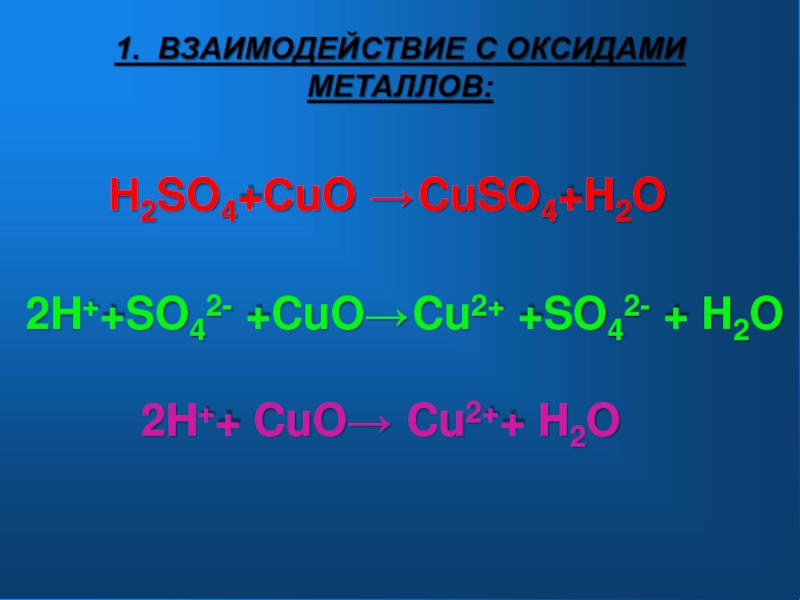
- 8. H2SO4+СuO →2H++SO42- +CuO→ 2H++ CuO→ CuSO4+H2OCu2+ +SO42- + H2OCu2++ H2O1. ВЗАИМОДЕЙСТВИЕ С ОКСИДАМИ МЕТАЛЛОВ:
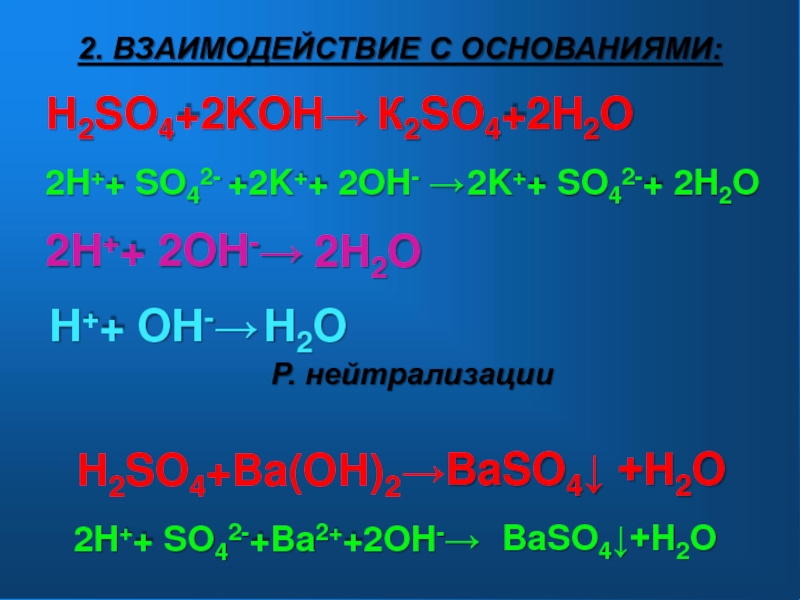
- 9. H2SO4+2KOH→2H++ SO42- +2K++ 2OH- →2H++ 2OH-→К2SO4+2H2O 2K++
- 10. Слайд 10
- 11. H2SO4 (разб.)+Zn→2H++1e∙2→Zn0-2e→ ZnSO4 +H2↑H20Zn2+3. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:2H2SO4
- 12. Слайд 12
- 13. 4. Взаимодействие конц. серной кислоты с органическими
- 14. 5. Взаимодействие серной кислоты с солями:ЗАДАНИЕ: В
- 15. Серная кислота обладает всеми свойствами
- 16. ДОМАШНЕЕ ЗАДАНИЕ:1. Группе № 4 подготовить мини-доклады
Слайд 4ТЕСТ
А) усиливаются
Б) не изменяются
В) ослабевают
Г) изменяются периодически
2. Определите формулы высшего оксида
А) RO3, H2R
Б) RO2, H2RO3
В) RO3, H2RO4
Г) RO3, H6RO6
1. В ряду химических элементов O-S-Se-Te неметаллические свойства:
Слайд 53. Найдите формулу, соответствующую электронной конфигурации внешнего электронного слоя атома серы:
А)
Б) …4s24p4
В) …6s26p4
Г) …4s24p5
4. Выберите правильные суждения:
А) сера- твердое кристаллическое вещество жёлтого цвета, кристаллическая решётка состоит из кольцевых молекул S 8
Б) сера хорошо растворяется в воде
В) сера – хороший проводник тепла и электричества
Г) сера встречается в природе как в свободном состоянии, так и в связанном (сульфиды, сульфаты)
Слайд 65. Взаимодействие серы с каким металлом происходит уже при комнатной температуре?
А) железа
Б) ртути
В) цинка
Г) меди
6. Определите вещество, с которым оксид серы (VI) не будет взаимодействовать:
А) гидроксид кальция
Б) оксид бария
В) вода
Г) оксид углерода (IV)
7. Как называются соединения серы с металлами:
А) сульфаты
Б) сульфиды
В) сульфиты
Г) серные ангидриды
Слайд 8H2SO4+СuO →
2H++SO42- +CuO→
2H++ CuO→
CuSO4+H2O
Cu2+ +SO42- + H2O
Cu2++ H2O
1. ВЗАИМОДЕЙСТВИЕ
Слайд 9H2SO4+2KOH→
2H++ SO42- +2K++ 2OH- →
2H++ 2OH-→
К2SO4+2H2O
2K++ SO42-+ 2H2O
2H2O
2. ВЗАИМОДЕЙСТВИЕ С
H++ OH-→
H2O
Р. нейтрализации
H2SO4+Ba(OH)2→
BaSO4↓ +H2O
2H++ SO42-+Ba2++2OH-→
BaSO4↓+H2O
Слайд 11H2SO4 (разб.)+Zn→
2H++1e∙2→
Zn0-2e→
ZnSO4 +H2↑
H20
Zn2+
3. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:
2H2SO4 (конц.)+Zn→
ZnSO4+ SO2↑+2H2O
2H2SO4 (конц.)+Сu→
CuSO4+ SO2↑
S+6+ 2e→
восстановление, окислитель
восстановление, окислитель
окисление, восстановитель
H2SO4 (разб.)+Cu→
не идет
Zn0-2e→
Zn2+
окисление, восстановитель
S+6+ 2e→
S4+
восстановление, окислитель
Сu-2e→
Cu2+
окисление, восстановитель
S4+
Слайд 134. Взаимодействие конц. серной кислоты с органическими соединениями:
Концентрированная серная кислота -это
Слайд 145. Взаимодействие серной кислоты с солями:
ЗАДАНИЕ: В 3-х пронумерованных пробирках налиты
HCl+BaCl2→не идёт
2HNO3+BaCl2↔Ba(NO3)2+2HCl
H2SO4+BaCl2→BaSO4↓+2HCl
HCl+Ag(NO3)→AgCl↓+HNO3
HNO3+ Ag(NO3)→ не идёт
Слайд 15 Серная кислота обладает всеми свойствами кислот: вступает в реакции с
Обобщение и выводы.
Слайд 16ДОМАШНЕЕ ЗАДАНИЕ:
1. Группе № 4 подготовить мини-доклады о применении солей серной
2. Расставьте коэффициенты методом электронного баланса в следующих окислительно-восстановительных реакциях:
H2SO4 (конц.)+Zn→ZnSO4+S +H2O
H2SO4 (конц.)+Zn→ZnSO4+H2S↑ +H2O