- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Водородные соединения неметаллов (10 кл.)
Содержание
- 1. Презентация по химии на тему Водородные соединения неметаллов (10 кл.)
- 2. 1. Определять изменения кислотных св-в НеМе2.Делать выводы
- 3. Экспресс- опрос1.Какое место в ПС занимают НеМе?2.Как
- 4. Соединения неметалловИзменение свойств в периодахИзменение свойств в группахОбщие формулы RHxХимические свойстваВодородные соединения НеМеПолучениеПрименение
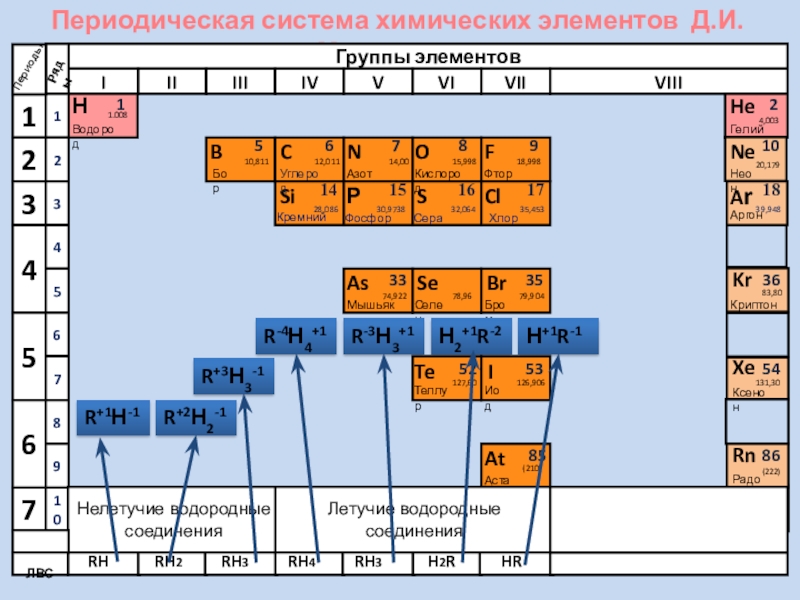
- 5. Периодическая система химических элементов Д.И. МенделееваНВодород11.008ПериодыBCNAsHeSeTeFBrIAtNeKrXeRnБорУглеродАзотМышьякСеленТеллурФторБромИодАстатКриптонКсенонРадон5679210Нелетучие водородные соединенияЛетучие водородные соединенияЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)ГелийНеонRH4RH3H2RHRRHRH2RH3R+1Н-1R+2Н2-1R+3Н3-1R-4Н4+1R-3Н3+1Н2+1R-2Н+1R-1
- 6. Периодическая система химических элементов Д.И. МенделееваНВодород11.008ПериодыBCNAsHeSeTeFBrIAtNeKrXeRnБорУглеродАзотМышьякСеленТеллурФторБромИодАстатКриптонКсенонРадон5679210ВОЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)ГелийНеонR2OROR2O3RO2R2O5RO3R2O7RO4RH4RH3H2RHRВ периодах
- 7. Периодическая система химических элементов Д.И. МенделееваНВодород11.008ПериодыBCNAsHeSeTeFBrIAtNeKrXeRnБорУглеродАзотМышьякСеленТеллурФторБромИодАстатКриптонКсенонРадон5679210ВОЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)ГелийНеонR2OROR2O3RO2R2O5RO3R2O7RO4RH4RH3H2RHRВ группах
- 8. Периодическая система химических элементов Д.И. МенделееваНВодород11.008ПериодыBCNAsHeSeTeFBrIAtNeKrXeRnБорУглеродАзотМышьякСеленТеллурФторБромИодАстатКриптонКсенонРадон5679210ВОЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)ГелийНеонR2OROR2O3RO2R2O5RO3R2O7RO4RH4RH3H2RHRВодородные соединения
- 9. Периодическая система химических элементов Д.И. МенделееваНВодород11.008ПериодыBCNAsHeSeTeFBrIAtNeKrXeRnБорУглеродАзотМышьякСеленТеллурФторБромИодАстатКриптонКсенонРадон5679210ВОЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)ГелийНеонR2OROR2O3RO2R2O5RO3R2O7RO4RH4RH3H2RHRОкислительная активность
- 10. Периодическая система химических элементов Д.И. МенделееваНВодород11.008ПериодыBCNAsHeSeTeFBrIAtNeKrXeRnБорУглеродАзотМышьякСеленТеллурФторБромИодАстатКриптонКсенонРадон5679210ВОЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)ГелийНеонR2OROR2O3RO2R2O5RO3R2O7RO4RH4RH3H2RHRС возрастанием
- 11. Слайд 11
- 12. I.Общие физические свойства водородных соединений неметаллов1.Бесцветность2.Неприятный запах(кроме
- 13. а) В промышленности (синтез) H2
- 14. б) Лабораторный способ.
- 15. III.Химические свойства водородных соединений неметалловNB!!! НеМе в
- 16. Химические свойства водородных соединений неметалловБ.Отношение к воде :Стр.191NH3 + H2O=CH4 + H2O=HCl + H2O=H2S + H2O=NH4OHCO2+H2O
- 17. Химические свойства водородных соединений неметалловВ.Свойства водных растворов
- 18. Химические свойства водородных соединений неметалловВ.Свойства водных р-ров
- 19. «Острова»о. ГрустиО. Удовольствияо.Тревогио.Просветленияо. Воодушевленияо.Неопределенностио. Недоуменияо.Радостио.Бермудскийтреугольник
- 20. Разобрать и выучить конспект.Выучить параграф:
Слайд 1Получение, физические и химические свойства водородных соединений неметаллов
10 класс
Бозаджи Н.М.
учитель химии
высшей категории
Слайд 2
1. Определять изменения кислотных св-в НеМе
2.Делать выводы по химической активности водородных
3.Рассматривать физические св-ва водородных соединений НеМе
4. Рассматривать способы получения водородных соединений НеМе
5.Писать уравнения реакций характеризующих хим. св-ва водородных соединений НеМе
6.Осуществлять рефлексию учебной деятельности
В результате изучения темы ,вы будете способны:
Слайд 3Экспресс- опрос
1.Какое место в ПС занимают НеМе?
2.Как изменяются свойства НеМе в
3.Как изменяется электроотрицательность НеМе в группе и в периоде?
4.Какое строение имеют молекулы НеМе?
5.Какие соединения образуют НеМе?
Слайд 4Соединения неметаллов
Изменение свойств в периодах
Изменение свойств в группах
Общие формулы RHx
Химические свойства
Водородные
Получение
Применение
Слайд 5
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
Нелетучие водородные соединения
Летучие водородные соединения
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
RH4
RH3
H2R
HR
RH
RH2
RH3
R+1Н-1
R+2Н2-1
R+3Н3-1
R-4Н4+1
R-3Н3+1
Н2+1R-2
Н+1R-1
Слайд 6
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
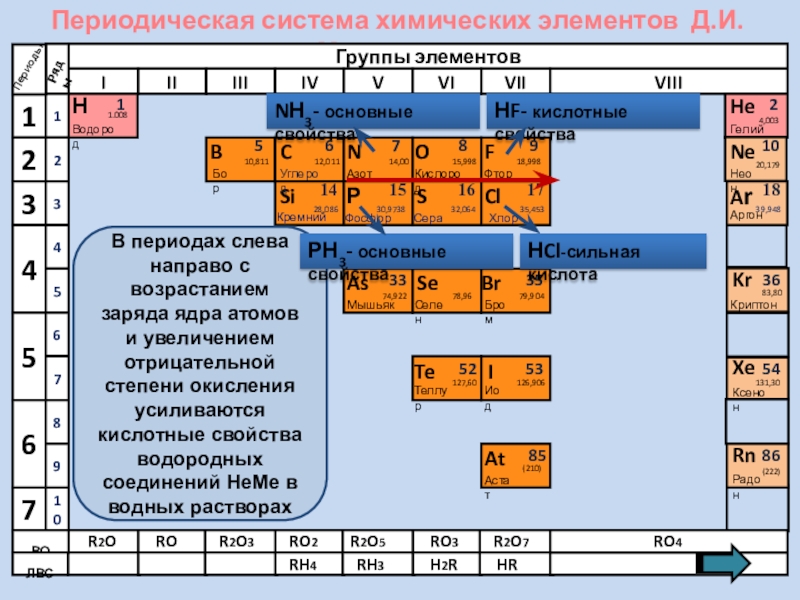
В периодах слева направо с возрастанием
NН3- основные свойства
НF- кислотные свойства
НCl-сильная кислота
РН3- основные свойства
Слайд 7
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
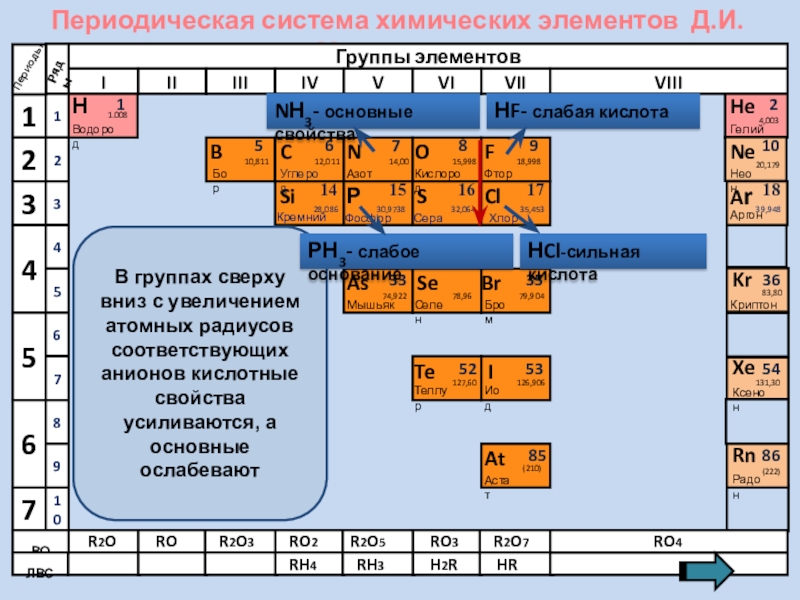
В группах сверху вниз с увеличением
NН3- основные свойства
НF- слабая кислота
НCl-сильная кислота
РН3- слабое основание
Слайд 8
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
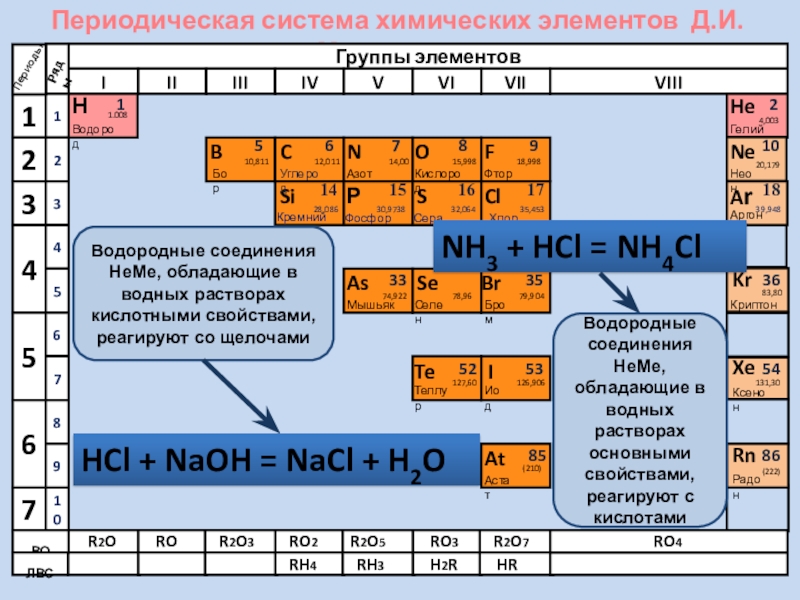
Водородные соединения НеМе, обладающие в водных
Водородные соединения НеМе, обладающие в водных растворах основными свойствами, реагируют с кислотами
HCl + NaOH = NaCl + H2O
NH3 + HCl = NH4Cl
Слайд 9
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
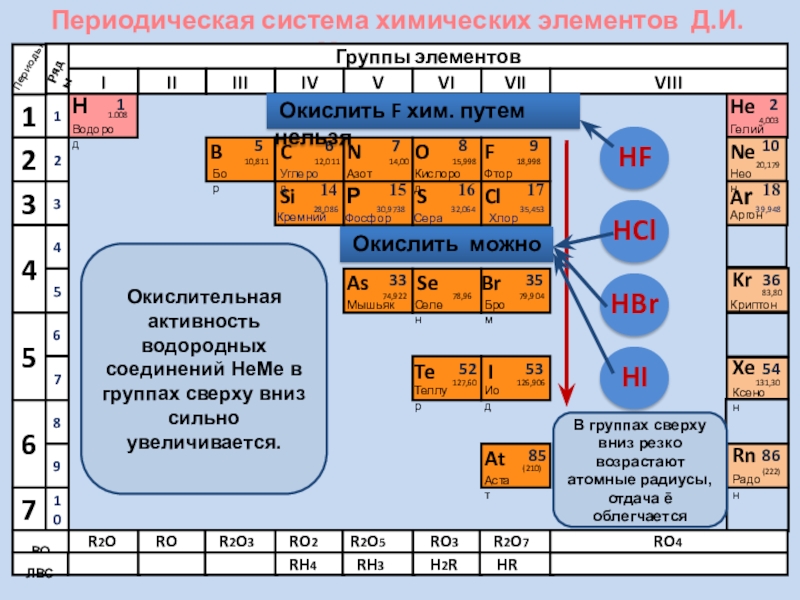
Окислительная активность водородных соединений НеМе в
В группах сверху вниз резко возрастают атомные радиусы, отдача ē облегчается
Окислить F хим. путем нельзя
Окислить можно
Слайд 10
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
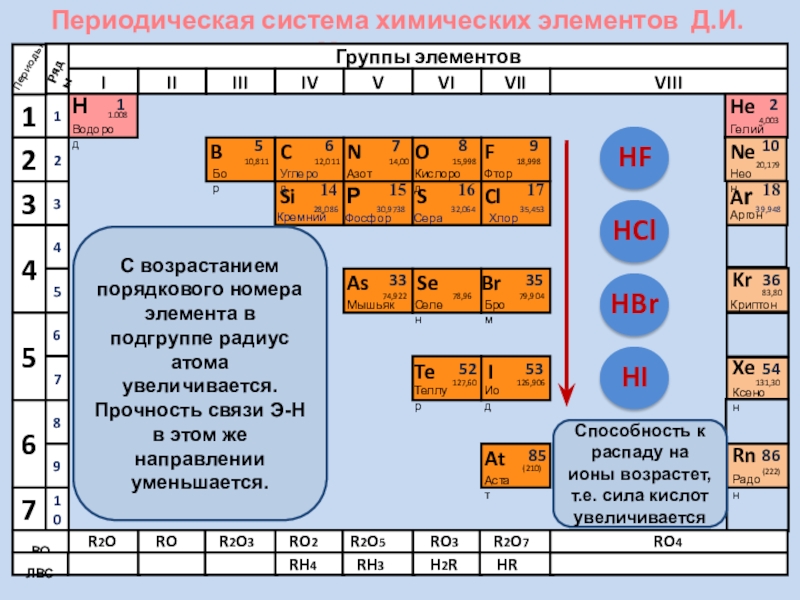
С возрастанием порядкового номера элемента в
Способность к распаду на ионы возрастет, т.е. сила кислот увеличивается
Слайд 12I.Общие физические свойства водородных соединений неметаллов
1.Бесцветность
2.Неприятный запах(кроме H2O)
3.Ядовитость(кроме H2O и СН4)
NB!!!
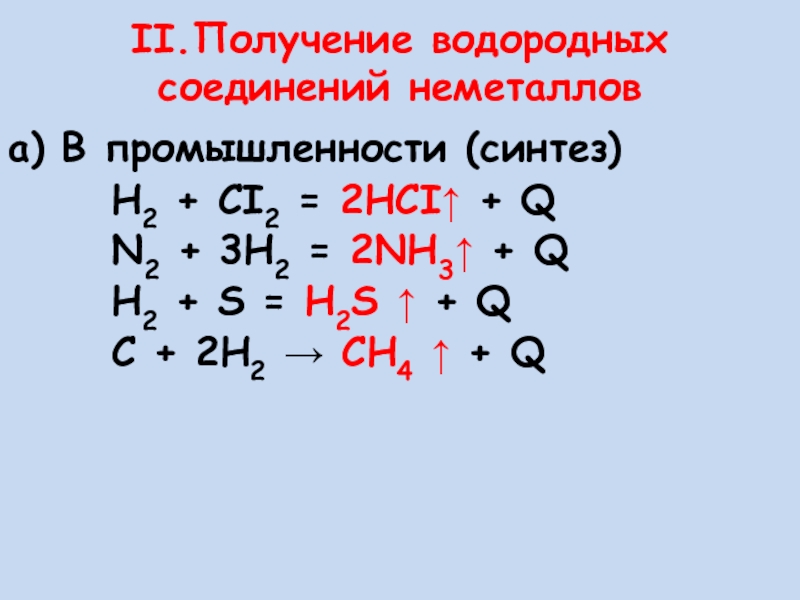
Слайд 13а) В промышленности (синтез)
H2 + CI2 = 2HCI↑
N2 + 3H2 = 2NH3↑ + Q
H2 + S = H2S ↑ + Q
C + 2H2 → CH4 ↑ + Q
II.Получение водородных соединений неметаллов
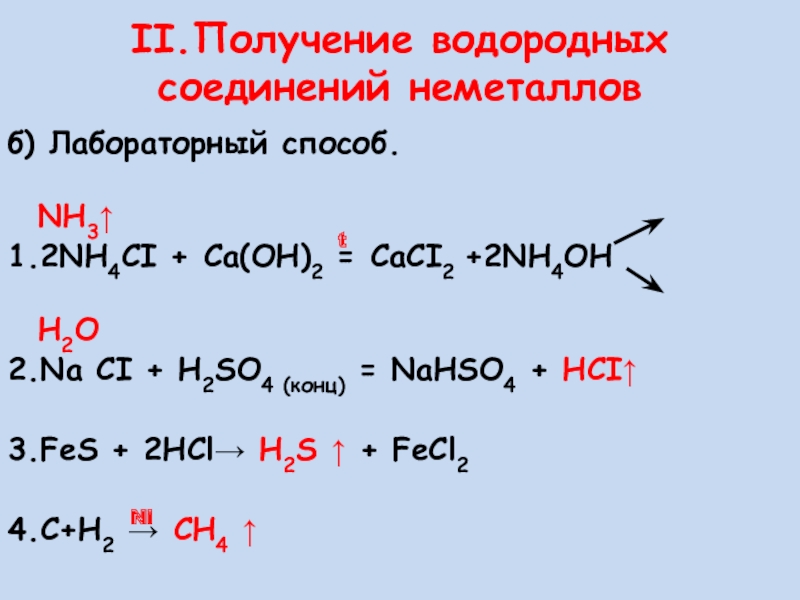
Слайд 14б) Лабораторный способ.
1.2NH4CI + Ca(OH)2 = CaCI2 +2NH4OH
H2O
2.Na CI + H2SO4 (конц) = NaHSO4 + HCI↑
3.FeS + 2HCl→ H2S ↑ + FeCl2
4.С+Н2 → СH4 ↑
t
Ni
II.Получение водородных соединений неметаллов
Слайд 15III.Химические свойства водородных соединений неметаллов
NB!!! НеМе в водородных соединениях проявляют низшую
А.Взаимодействие с кислородом:
4NH3 + 3O2 = 2N2 + 6H2O (ОВР)
4NH3 + 5O2 = 4NO + 6H2O
2H2S + 3O2(изб) = 2SO2 + 2H2O (ОВР)
2H2S + O2(нед) = 2S + 2H2O
CH4 + 2O2 =CO2+ 2H2O
4HCl+ O2↔ 2H2O+2Cl2 (ОВР)
t
Pt
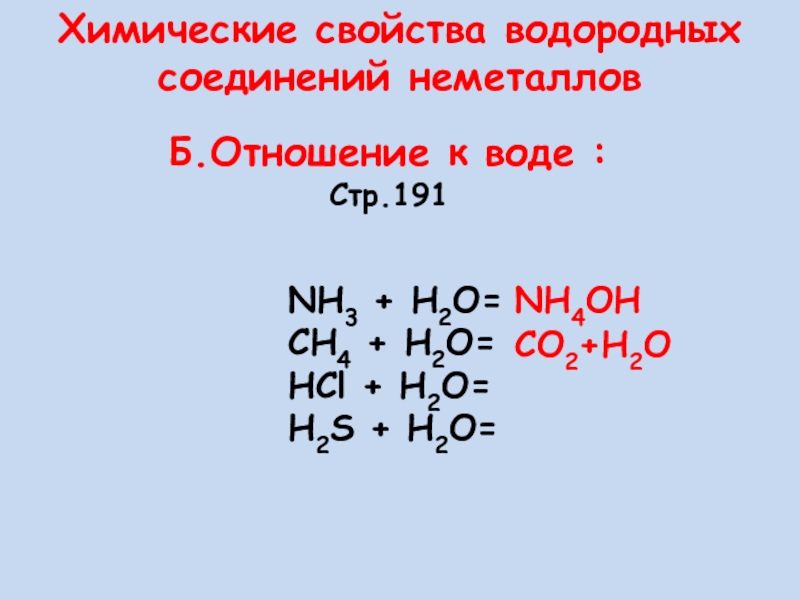
Слайд 16Химические свойства водородных соединений неметаллов
Б.Отношение к воде :
Стр.191
NH3 + H2O=
CH4 +
HCl + H2O=
H2S + H2O=
NH4OH
CO2+H2O
Слайд 17Химические свойства водородных соединений неметаллов
В.Свойства водных растворов соединений неметаллов:
Аммиак = свойства
1.NH3 водный раствор NH4OH
→ диссоциация
+ HCI →
+NaOH →
Слайд 18Химические свойства водородных соединений неметаллов
В.Свойства водных р-ров соединений НеМе:
Бескислородные кислоты проявляют
общие свойства кислот
2.HCI водный раствор
→диссоциация
+ Ме (до Н)
+ Ме (ОН)n
+ соль →…+…↓
Слайд 19
«Острова»
о. Грусти
О. Удовольствия
о.Тревоги
о.Просветления
о. Воодушевления
о.Неопределенности
о. Недоумения
о.Радости
о.Бермудский
треугольник
Слайд 20
Разобрать и выучить конспект.
Выучить параграф:
Выполнить упражнения:
1,3(б-г),4(б),10* стр. 195.
Домашнее задание