- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Водород (9 класс)
Содержание
- 1. Презентация по химии на тему Водород (9 класс)
- 2. Цель проекта: Знакомство с водородом какэлементом и
- 3. Рабочие группы:1 группа – «Теоретики»2 группа – «Исследователи»3 группа – «Практики»
- 4. История открытияВпервые этот газ в чистом виде
- 5. Другой великий химик, француз Антуан-Лоран Лавуазье, уже
- 6. Водород в природе:Водород широко распространен в природе
- 7. Водород самый распространенный элемент во вселенной
- 8. Общая характеристика:Порядковый номер 11 малый периодI группа
- 9. Молекула водорода Молекула водорода состоит из двух атомов - H2 Ковалентная неполярная связь Н:Н
- 10. Получение водорода в лабораторииZn + 2HCl →
- 11. Физические свойства водорода Бесцветный газ Без запаха Почти нерастворим в воде В 14,5 раз легче воздуха
- 12. Промышленные способы получения водородаВодород получают конверсией водяных
- 13. Восстановительные свойства водорода Горит в кислороде
- 14. Взаимодействие водорода с оксидом меди (II)
- 15. Окислительные свойства водородаРеагируют со щелочными и щелочноземельными
- 16. Применение водорода
- 17. Применение водородаПрименениеСвойства водородаГорит с выделением большого количества
- 18. ПрименениеНаработав в достаточном количестве этот легкий газ,
- 19. Водородная энергетика: миф или реальность?В недалёком будущем
- 20. Контрольные вопросы:Какой элемент характеризуется наибольшей распространенностью во
- 21. Что мы узнали о водороде?Положение в ПС
- 22. Домашнее задание§17 выучитьПисьменно упражнения № 3-5Используя дополнительную
Слайд 1
Урок-проект
«Водород: знакомый и незнакомый»
«И если вчера человечество благоговело
перед
а позавчера перед паровым котлом, то сегодня
Мы управляем реакцией распада атомного ядра,
а завтра будем управлять реакцией синтезы ядер
– создадим земные солнца»
Д.И. Щербаков
Слайд 2Цель проекта:
Знакомство с водородом как
элементом и веществом
Рассматриваемые вопросы:
История открытия элемента
Строение
Получение
Физические и химические свойства
Применение
Слайд 4История открытия
Впервые этот газ в чистом виде выделил 240 лет назад
Слайд 5
Другой великий химик, француз Антуан-Лоран Лавуазье, уже в 1787 году доказал,
История открытия
Слайд 6Водород в природе:
Водород широко распространен в природе — содержится в воде,
Слайд 8Общая характеристика:
Порядковый номер 1
1 малый период
I группа главная подгруппа
Ar=1
Электронная конфигурация
В одних условиях водород проявляет металлические свойства - отдает электрон, как щелочные металлы
В других — неметаллические свойства - принимает электрон, как галогены.
Слайд 9Молекула водорода
Молекула водорода состоит из двух атомов - H2
Ковалентная
Н:Н
Слайд 10Получение водорода в лаборатории
Zn + 2HCl → ZnCl2 + H2↑
смесь водорода с кислородом в объемном отношении 2:1 называют «гремучим газом»
Слайд 11Физические свойства водорода
Бесцветный газ
Без запаха
Почти нерастворим в воде
Слайд 12Промышленные способы получения водорода
Водород получают конверсией водяных паров с углем или
H2O + C ⇄ H2 + CO
CH4 + H2O ⇄ CO + 3H2
Слайд 13Восстановительные свойства водорода
Горит в кислороде
2H2 + O2 =
Реагирует с другими неметаллами
N2 +3H2 ↔2NH3
Реагирует с оксидами металлов СuO + H2 = Cu + H2O
Слайд 15Окислительные свойства водорода
Реагируют со щелочными и щелочноземельными металлами с образованием гидридов
2Na + H2 = 2NaH
Са + H2 = СаH2
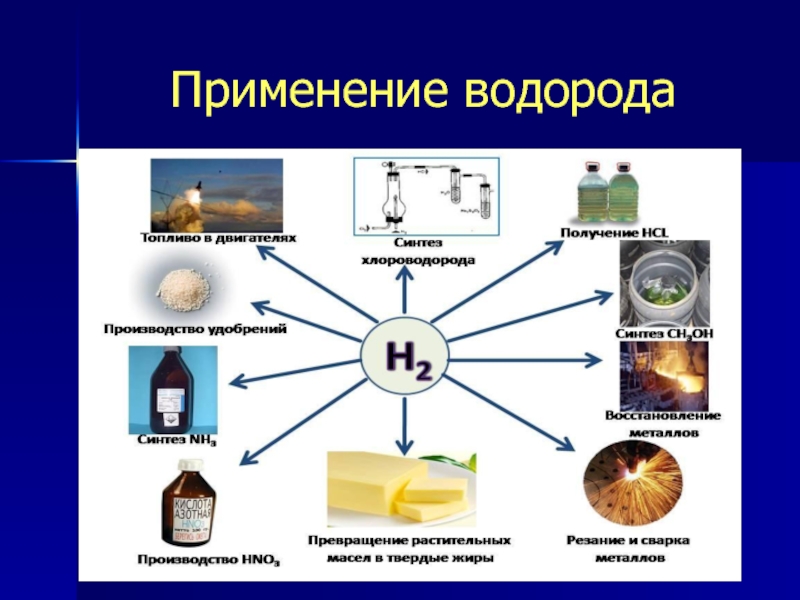
Слайд 17Применение водорода
Применение
Свойства водорода
Горит с выделением большого количества теплоты
Реагирует с неметаллами
Реагирует с
Легкий газ (из истории)
В качестве топлива
Производство важных веществ: аммиака, хлороводорода и др.
Применение в металлургии
?
Слайд 18Применение
Наработав в достаточном количестве этот легкий газ, люди сначала приспособили его
Слайд 19Водородная энергетика:
миф или реальность?
В недалёком будущем основным источником получения энергии станет
В 1979 году компания BMW выпустила первый автомобиль, вполне успешно ездивший на водороде, при этом не взрывавшийся и выпускавший из выхлопной трубы водяной пар. В эпоху усиливающейся борьбы с вредными выхлопами машина была воспринята как вызов автомобильному рынку.
Слайд 20Контрольные вопросы:
Какой элемент характеризуется наибольшей распространенностью во Вселенной?
Кто впервые выделил водород
Охарактеризуйте химические свойства водорода.
Что называют гремучим газом?
Какие соединения водород образует с активными металлами?
Оксиды каких элементов восстанавливаются водородом?
Каковы способы получения водорода в промышленности?
Как получают водород в лаборатории?
Перечислите основные области применения водорода.
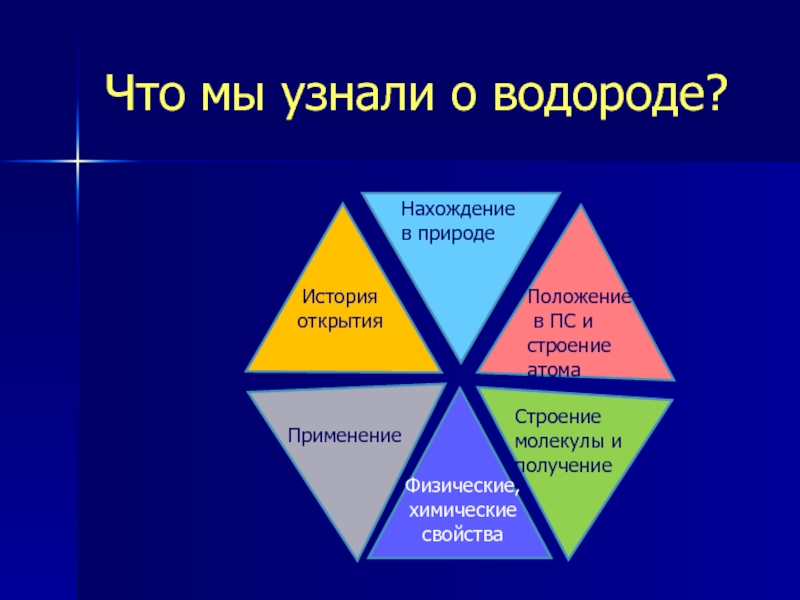
Слайд 21Что мы узнали о водороде?
Положение
в ПС и строение атома
История открытия
Нахождение
Физические, химические свойства
Применение
Строение молекулы и получение
Слайд 22Домашнее задание
§17 выучить
Письменно упражнения № 3-5
Используя дополнительную литературу, найти как можно
Повторить тему «Изотопы»