- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Водород (9 класс)
Содержание
- 1. Презентация по химии на тему Водород (9 класс)
- 2. Отгадайте о чём идёт речь?Я, газ, легчайший
- 3. Начало всех начал – водород!Взгляни на звезды:
- 4. Водород в космосе.
- 5. Ближайшая к нам звезда Галактики, которую мы
- 6. Водород на Земле.Вода Нефть Природныйгаз
- 7. Открытие водорода.Водород был открыт в первой половине
- 8. Всё те же открытия.В 1766 году известный
- 9. Лишь в 1787 году Антуан Лавуазье доказал,
- 10. Происхождение названия.Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году
- 11. Характеристика водорода .
- 12. Химический элемент.Порядковый номер 1Группа – IПериод – 1Электронная формула 1s1Степени окисления: -1, 0, +1
- 13. Физические свойства водорода.Лёгкий горючий газ без цвета,
- 14. Водород, водород – элемент наоборот!От щелочных металлов не отстал иИ к галогенам не пристал!
- 15. Общее с галогенамиВодород записывают в 2 резко
- 16. Химические свойства.
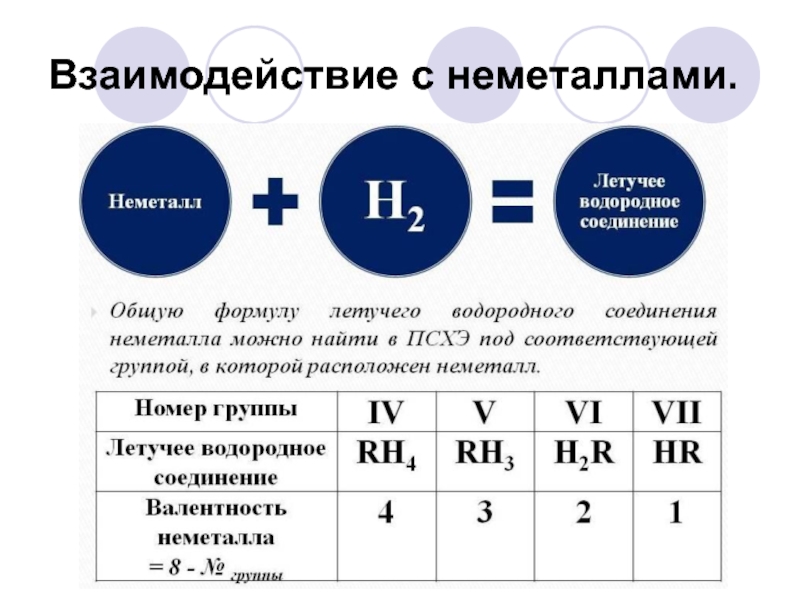
- 17. Взаимодействие с неметаллами.
- 18. Восстановительные свойства.1. При поджигании реагирует с кислородом
- 19. Расставьте коэффициенты методом электронного баланса.Со сложными веществами:CuO
- 20. Окислительные свойства.С простыми веществами (металлами):Mg + H2 → MgH2MgH2 + H2O → Mg(OH)2 + H2
- 21. Ответьте на вопрос.Если бы перед вами стояла
- 22. Испарившаяся отметка. На экзамене академик Иван Алексеевич
- 23. Получение водорода.В промышленности : 1. Конверсией метана
- 24. В лаборатории. 1. Действием на металлы (обычно
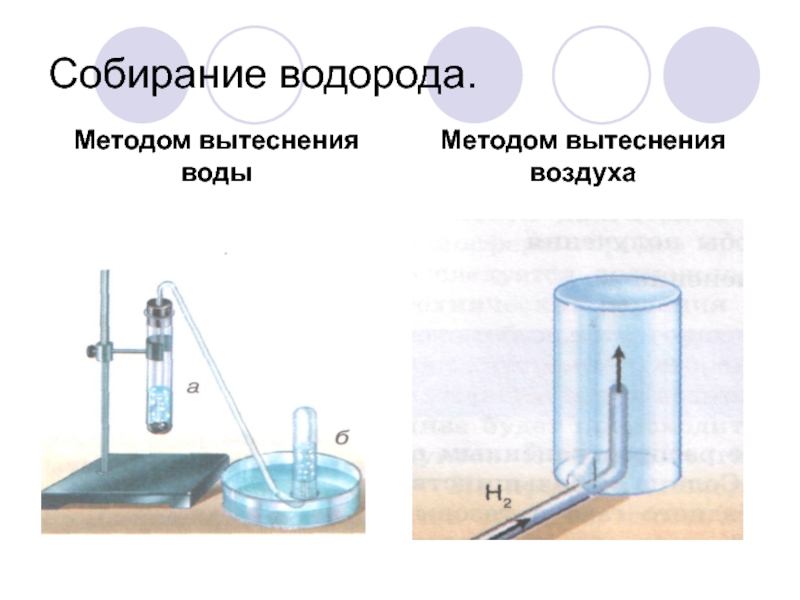
- 25. Собирание водорода.Методом вытеснения водыМетодом вытеснения воздуха
- 26. Образование гремучей смеси.Обычно лёгок и летуч,Он вдруг
- 27. 2. Взаимодействие металлов с водой:2Na+2H2O=2NaOH+H23. Взаимодействие металлов
- 28. ВЫВОД: с металлами водород является окислителем (
- 29. Применение водорода.
- 30. Выбери правильное суждение.1. Водород – самый распространённый
- 31. Если вы согласны с утверждениями, поставьте плюс.1.
- 32. Спасибо за урок!Запишите домашнее задание. § 17,
Отгадайте о чём идёт речь?Я, газ, легчайший и бесцветный,Неядовитый и безвредный,Соединяясь с кислородом,Я для питья даю вам воду!
Слайд 2Отгадайте о чём идёт речь?
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь
с кислородом,
Я для питья даю вам воду!
Я для питья даю вам воду!
Слайд 3Начало всех начал –
водород!
Взгляни на звезды: много звезд
В безмолвии ночном
Горит,
блестит вокруг луны
На небе голубом.
Слайд 5Ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце»,
на 70 % своей массы состоит из водорода.
Слайд 7Открытие водорода.
Водород был открыт в первой
половине XVI века немецким
врачом и
естествоиспытателем
Парацельсом
Парацельсом
Первым ученым, описавшим свойства
этого газа, был английский ученый
Генри Кавендиш
Слайд 8Всё те же открытия.
В 1766 году известный английский учёный Генри Кавендиш
получил «искусственный воздух» действием цинка на разведённую соляную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название «горючего воздуха».
Слайд 9
Лишь в 1787 году Антуан Лавуазье доказал, что «горючий воздух»,открытый в
1766 году входит в состав воды и дал ему название «гидрогениум», т.е. «рождающий воду», «водород».
Слайд 10Происхождение названия.
Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824
году
Слайд 12Химический элемент.
Порядковый номер 1
Группа – I
Период – 1
Электронная формула 1s1
Степени окисления:
-1, 0, +1
Слайд 13Физические свойства водорода.
Лёгкий горючий газ без цвета, запаха и вкуса.
Температура плавления
-259,15
Температура кипения -252,7
Плохо растворим в воде.
Температура кипения -252,7
Плохо растворим в воде.
Слайд 14Водород, водород – элемент
наоборот!
От щелочных металлов не отстал и
И к
галогенам не пристал!
Слайд 15Общее с галогенами
Водород записывают в 2 резко противоположные группы химических элементов:
-
в главной подгруппе 1 группы – подгруппе Щелочные металлы
- в главной подгруппе 7 группы- подгруппе галогены.
Почему?
- в главной подгруппе 7 группы- подгруппе галогены.
Почему?
Слайд 18Восстановительные свойства.
1. При поджигании реагирует с кислородом (горит в кислороде с
выделением большого количества тепла, 3000ºС )
O2 + 2H2 = 2H2О
2. С галогенами образует галогеноводороды:
F2 + H2 = 2HF,
реакция протекает со взрывом при любой температуре,
Cl2 + H2 ↔ 2HCl,
реакция протекает только на свету.
3. При нагревании :
S + H2 ↔ H2S
4.С азотом — при нагревании, повышенном давлении и в присутствии катализатора (железо):
N2 + 3H2 ↔ 2NH3
O2 + 2H2 = 2H2О
2. С галогенами образует галогеноводороды:
F2 + H2 = 2HF,
реакция протекает со взрывом при любой температуре,
Cl2 + H2 ↔ 2HCl,
реакция протекает только на свету.
3. При нагревании :
S + H2 ↔ H2S
4.С азотом — при нагревании, повышенном давлении и в присутствии катализатора (железо):
N2 + 3H2 ↔ 2NH3
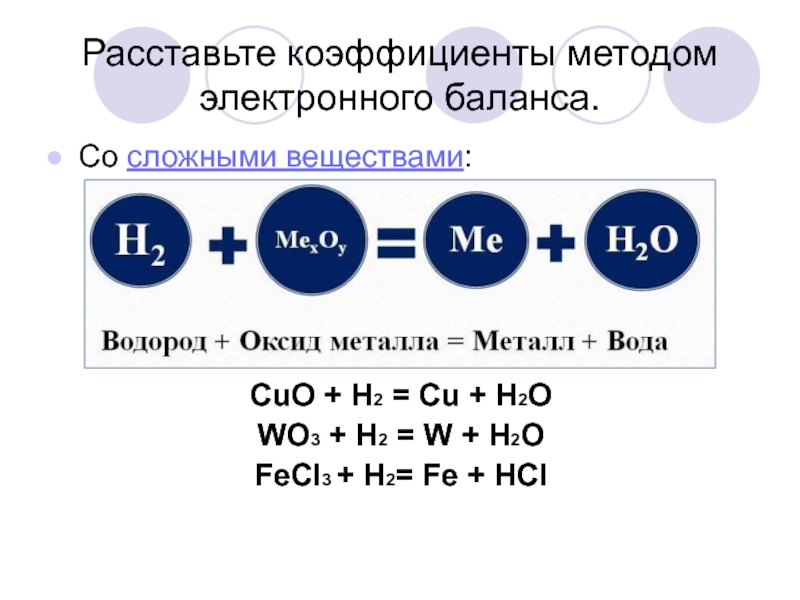
Слайд 19Расставьте коэффициенты методом электронного баланса.
Со сложными веществами:
CuO + H2 = Cu
+ H2O
WO3 + H2 = W + H2O
FeCl3 + H2= Fe + HCl
WO3 + H2 = W + H2O
FeCl3 + H2= Fe + HCl
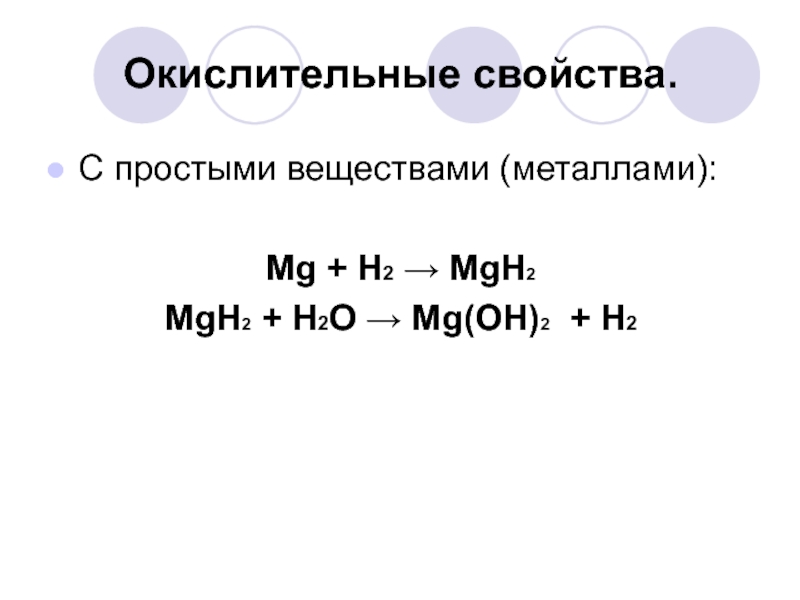
Слайд 20Окислительные свойства.
С простыми веществами (металлами):
Mg + H2 → MgH2
MgH2 + H2O
→ Mg(OH)2 + H2
Слайд 21Ответьте на вопрос.
Если бы перед вами стояла задача получить большое количество
водорода, какое сырьё вы бы выбрали и почему?
Слайд 22Испарившаяся отметка.
На экзамене академик Иван Алексеевич Каблуков просит студента рассказать, как
в лаборатории получают водород.
«Из ртути», - отвечает тот.
«Как это из ртути?! Обычно говорят «из цинка», а вот из ртути – это что – то оригинальное. Напишите –ка реакцию». Студент пишет:
Hg = H + g
и говорит: «Ртуть нагревают, она разлагается на H и g. H – водород, он легкий и поэтому улетает, а g – ускорение силы тяжести, тяжелое остается».
«За такой ответ надо ставить пятерку, - говорит Каблуков. – Давайте зачетку. Только пятерку я сначала тоже подогрею. «Три» улетает, а «два» остается».
«Из ртути», - отвечает тот.
«Как это из ртути?! Обычно говорят «из цинка», а вот из ртути – это что – то оригинальное. Напишите –ка реакцию». Студент пишет:
Hg = H + g
и говорит: «Ртуть нагревают, она разлагается на H и g. H – водород, он легкий и поэтому улетает, а g – ускорение силы тяжести, тяжелое остается».
«За такой ответ надо ставить пятерку, - говорит Каблуков. – Давайте зачетку. Только пятерку я сначала тоже подогрею. «Три» улетает, а «два» остается».
Слайд 23Получение водорода.
В промышленности :
1. Конверсией метана парами воды:
CH4 + 2H2O
= 4H2 + CO2
2. Конверсией оксида углерода:
СО + H2O = CO2 + H2
3. Термическим разложением метана:
СН4 = С + 2Н2
4. Электролизом воды. Получаемый водород
чистый, но очень дорогой.
2H2O = 2H2 ↑ + O2 ↑
2. Конверсией оксида углерода:
СО + H2O = CO2 + H2
3. Термическим разложением метана:
СН4 = С + 2Н2
4. Электролизом воды. Получаемый водород
чистый, но очень дорогой.
2H2O = 2H2 ↑ + O2 ↑
Слайд 24
В лаборатории.
1. Действием на металлы (обычно цинк) соляной или разбавленной
серной кислотой:
Zn + H2SO4 = ZnSO4 + H2
Zn + H2SO4 = ZnSO4 + H2
Слайд 26Образование гремучей смеси.
Обычно лёгок и летуч,
Он вдруг становится могуч:
Его нагрев
неосторожно
Взорвать в округе всё возможно.
Взорвать в округе всё возможно.
Слайд 27
2. Взаимодействие металлов с водой:
2Na+2H2O=2NaOH+H2
3. Взаимодействие металлов со щелочами:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
4. Взаимодействием паров
воды с раскаленными железными стружками:
4H2O + 3Fe = Fe3O4 + 4H2↑
4H2O + 3Fe = Fe3O4 + 4H2↑
Слайд 28ВЫВОД: с металлами водород является окислителем ( как галогены), а с
неметаллами и со сл. веществами– восстановителем ( как ЩМ).
Слайд 30Выбери правильное суждение.
1. Водород – самый распространённый элемент во Вселенной.
2. Водород
- самый распространённый газ на Земле.
3. Основным соединением водорода на нашей планете является вода.
4. Большое количество атомов водорода входит в состав веществ, образующих живые организмы.
5. Водород – самый легкий газ.
6. Степень окисления водорода в соединениях с металлами равна - 2.
7. Формула простого вещества водорода равна Н2.
8. Газ водород обладает наименьшей среди всех веществ молекулярной массой.
9. Газообразный водород хорошо растворим в воде.
10. Водород в смеси с кислородом взрывоопасен.
11. Чтобы собрать водород, пробирку надо держать отверстием вверх.
12. Водород можно собрать методом вытеснения воды.
13. Соединения водорода с металлами называются гидридами.
14. Водород во всех химических реакциях является восстановителем.
15. Водород при взаимодействии с металлами является окислителем.
3. Основным соединением водорода на нашей планете является вода.
4. Большое количество атомов водорода входит в состав веществ, образующих живые организмы.
5. Водород – самый легкий газ.
6. Степень окисления водорода в соединениях с металлами равна - 2.
7. Формула простого вещества водорода равна Н2.
8. Газ водород обладает наименьшей среди всех веществ молекулярной массой.
9. Газообразный водород хорошо растворим в воде.
10. Водород в смеси с кислородом взрывоопасен.
11. Чтобы собрать водород, пробирку надо держать отверстием вверх.
12. Водород можно собрать методом вытеснения воды.
13. Соединения водорода с металлами называются гидридами.
14. Водород во всех химических реакциях является восстановителем.
15. Водород при взаимодействии с металлами является окислителем.
Слайд 31Если вы согласны с утверждениями, поставьте плюс.
1. Я узнал много нового
и интересного.
2. На все возникшие в ходе урока вопросы я получил ответы.
3. Мне это пригодится в будущей профессиональной деятельности и в повседневной жизни.
4. Считаю, что работал добросовестно и достиг цели урока.
2. На все возникшие в ходе урока вопросы я получил ответы.
3. Мне это пригодится в будущей профессиональной деятельности и в повседневной жизни.
4. Считаю, что работал добросовестно и достиг цели урока.
Слайд 32Спасибо за урок!
Запишите домашнее задание.
§ 17, упр. 3,4 (§ 19,
упр.3, 4).
Подготовить сообщения по темам:
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».
Подготовить сообщения по темам:
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».


















![Презентация по химии на тему Водород (9 класс) 2. Взаимодействие металлов с водой:2Na+2H2O=2NaOH+H23. Взаимодействие металлов со щелочами:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H24. Взаимодействием паров 2. Взаимодействие металлов с водой:2Na+2H2O=2NaOH+H23. Взаимодействие металлов со щелочами:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H24. Взаимодействием паров воды с раскаленными железными стружками: 4H2O](/img/thumbs/23f64e63bdaabbed402af9c3c53dfd6a-800x.jpg)










