состояние неметаллов может быть:
А)газообразное
Б) жидкое
В) твердое
Г) аморфное
3.Разнообразие физических свойств неметаллов объясняется
а) они могут иметь атомную кристаллическую решетку
Б) молекулярную кристаллическую решетку
В) различие в количественном составе молекул
4.Многообразие простых веществ объясняется
А) аморфностью
Б) аллотропией
5.По химическим свойствам неметаллы могут быть
А) окислителями
Б) восстановителями
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Водород (9 класс)
Содержание
- 1. Презентация по химии на тему Водород (9 класс)
- 2. Газ этот легок и летуч, Он очень
- 3. Водород, его физические и химические свойства
- 4. План 1.Положение в ПСХЭ2.Физические свойства3.Химические свойства4.Получение5. Применение
- 5. XVIII век. Из истории открытия водорода…Генри КавендишПолучил
- 6. Характеристика положения водорода в ПСХЭ, строение
- 7. Физические свойства водорода Бесцветный газ. Без запаха
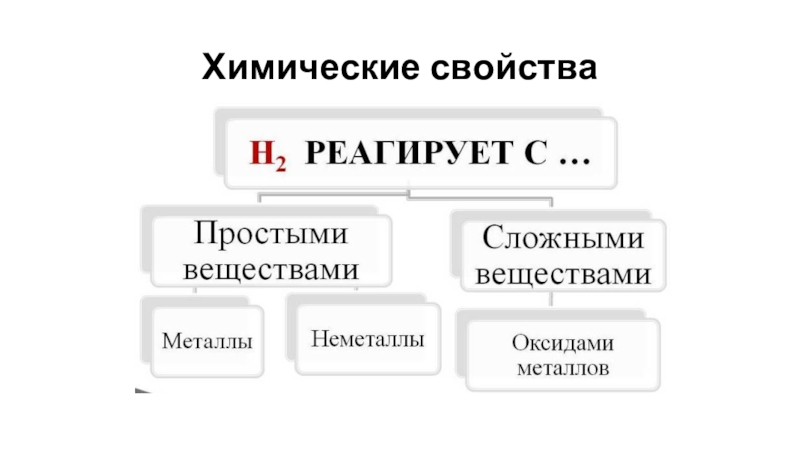
- 8. Химические свойства
- 9. Химические свойства водорода. Водород – восстановитель.Горит в кислороде: 2H2 + O2 = 2H2O
- 10. С азотом Водород взаимодействует с образованием аммиака:3Н2
- 11. Взаимодействие водорода с оксидом меди(II)СuO + H2 = Cu + H2O
- 12. Реагирует со щелочными и щелочно-земельными металлами
- 13. ПолучениеСН4 + H2О = СО + 3Н2,и
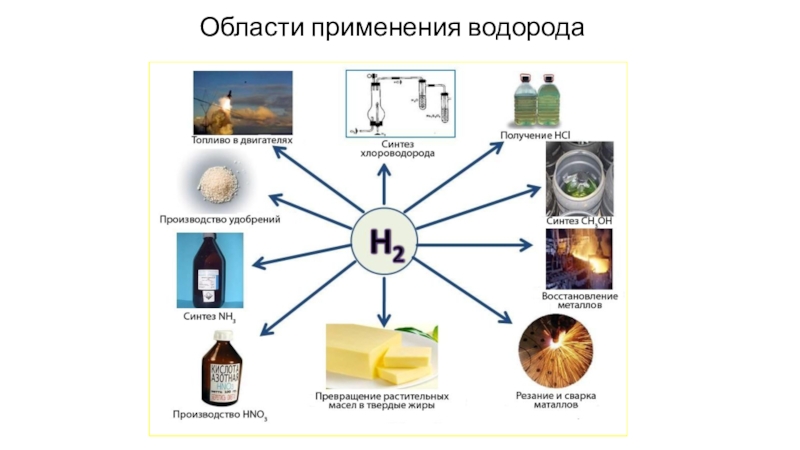
- 14. Области применения водородаПросмотр видео
- 15. Составьте уравнения реакций взаимодействия водорода со следующими
Газ этот легок и летуч, Он очень может быть могуч: Его нагрев неосторожно, Взорвать в округе все возможно, А если с «О» соединить, То можно воду получить. Я много вам о нем сказала, Его подробно
Слайд 2Газ этот легок и летуч, Он очень может быть могуч: Его нагрев неосторожно, Взорвать
в округе все возможно,
А если с «О» соединить,
То можно воду получить.
Я много вам о нем сказала,
Его подробно описала.
Итак, подумав, пять минут,
Скажите, как его зовут?
Слайд 5XVIII век. Из истории открытия водорода…
Генри Кавендиш
Получил водород
взаимодействием
металлов и
кислот
и изучил его свойства.
и изучил его свойства.
Антуан Лавуазье
Установил,
что водород
входит в состав воды.
А. Гитон де Морво
Предложил латинское
название «гидрогениум»,
означающее
«рождающий воду».
Слайд 6Характеристика положения водорода
в ПСХЭ, строение атома и молекулы
а) Химический знак
– Н;
б) Относительная атомная масса – Ar (H) = 1;
в) Химическая формула – H2;
г) Относительная молекулярная масса – Mr (H2) = 2;
д) Валентность и степени окисления – одновалентен, +1; –1;
е) Строение атома и молекулы (показаны на рисунке);
ж) Положение в ПСХЭ: порядковый номер – 1, период – 1-й, ряд – 1-й,
группа – Iа, VIIа, подгруппа главная, характер – неметалл
б) Относительная атомная масса – Ar (H) = 1;
в) Химическая формула – H2;
г) Относительная молекулярная масса – Mr (H2) = 2;
д) Валентность и степени окисления – одновалентен, +1; –1;
е) Строение атома и молекулы (показаны на рисунке);
ж) Положение в ПСХЭ: порядковый номер – 1, период – 1-й, ряд – 1-й,
группа – Iа, VIIа, подгруппа главная, характер – неметалл
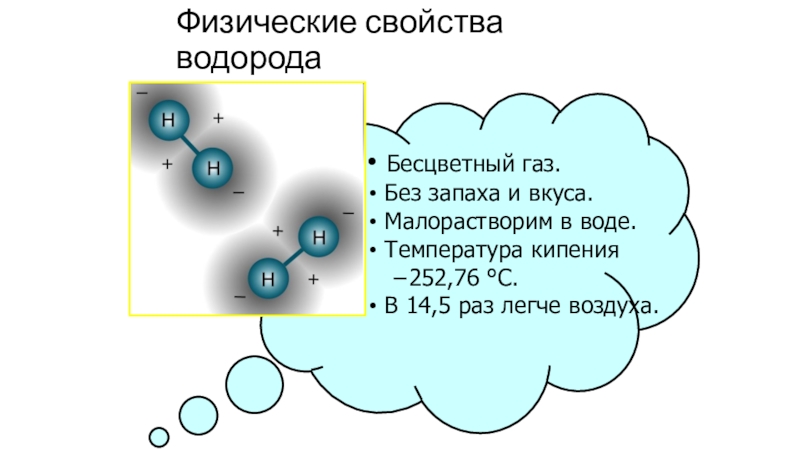
Слайд 7Физические свойства водорода
Бесцветный газ.
Без запаха и вкуса.
Малорастворим в
воде.
Температура кипения −252,76 °C.
В 14,5 раз легче воздуха.
Температура кипения −252,76 °C.
В 14,5 раз легче воздуха.
Слайд 10С азотом Водород взаимодействует с образованием аммиака:
3Н2 + N2 = 2NН3
С
галогенами Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl хлороводород
Н2 + Cl2 = 2НСl хлороводород
Слайд 12Реагирует со щелочными
и щелочно-земельными металлами с образованием гидридов:
2K + H2 = 2KH
(гидрид калия);
Са + H2 = СаH2
(гидрид кальция).
(гидрид калия);
Са + H2 = СаH2
(гидрид кальция).
Гидрид кальция
Химические свойства водорода. Водород – окислитель.
Слайд 13Получение
СН4 + H2О = СО + 3Н2,
и неполное окисление углеводородов кислородом:
СН4
+ 1/2О2 = СО + 2Н2
Образующийся оксид углерода (II) также подвергается конверсии:
СО + Н2О = СО2 + Н2
В лаборатории водород получают при взаимодействии металлов с растворами кислот, например соляной:
Zn + 2HCl = ZnCl2 + Н2
Образующийся оксид углерода (II) также подвергается конверсии:
СО + Н2О = СО2 + Н2
В лаборатории водород получают при взаимодействии металлов с растворами кислот, например соляной:
Zn + 2HCl = ZnCl2 + Н2
Слайд 15Составьте уравнения реакций взаимодействия водорода со следующими веществами:
F2
Ca
Al2O3
оксидом
ртути (II)
оксидом вольфрама (VI)
оксидом вольфрама (VI)