- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Водород
Содержание
- 1. Презентация по химии на тему: Водород
- 2. Водород
- 3. Слайд 3
- 4. История открытия Водород(в переводе- «рождающий воду») открыл
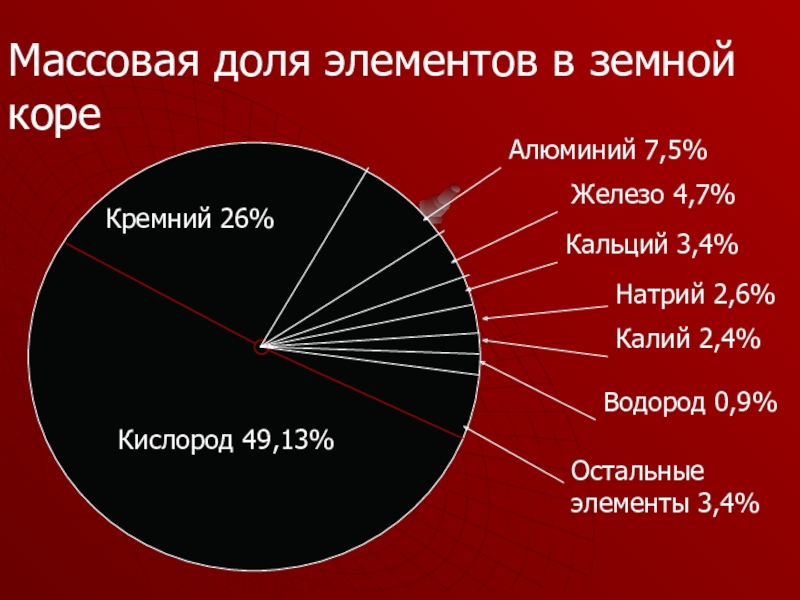
- 5. Алюминий 7,5%Железо 4,7%Кальций 3,4%Натрий 2,6%Калий 2,4%Водород 0,9%Остальные
- 6. Общая характеристика
- 7. Слайд 7
- 8. Физические свойства1. Бесцветный
- 9. Получение.1.Пропусканием электрического тока через воду.Взаимодействием металлов с кислотами.Реакцией щелочных и щелочноземельных металлов с водой.
- 10. Лабораторные способыВзаимодействие активных металлов с растворами
- 11. Промышленные способыЭлектролитическое разложение воды2H2O = 2H2 + O2Газификация твердого топливаС + Н2О = СО + Н2
- 12. Внимание ! Соблюдайте меры предосторожности при работе с водородом.
- 13. Химические свойстваВодород - восстановительГорениеН2 + О2= 2Н2ОРЕАКЦИИ
- 14. Водород - окислительС расплавленными металлами под давлением
- 15. Применение В химической промышленности- получение аммиака,
- 16. Слайд 16
- 17. Слайд 17
- 18. Совместите название с классом веществОксид калия
- 19. Проверим!Оксид калия
- 20. Задание. С какими из перечисленных ниже
- 21. Задача Какая масса и какой объем
- 22. Задание на дом. Выучить стр. 35-39, упр.5-7(стр.39-40).
- 23. Спасибо за урок!
Слайд 3
Изучить положение водорода в периодической системе, строение атома
Физические и химические свойства
Получение в лаборатории и промышленности.
Применение
Слайд 4История открытия
Водород(в переводе- «рождающий воду») открыл в первой половине 16
В 1776г. Английский ученый Г.Кавендиш исследовал его свойства.
Слайд 5
Алюминий 7,5%
Железо 4,7%
Кальций 3,4%
Натрий 2,6%
Калий 2,4%
Водород 0,9%
Остальные элементы 3,4%
Кислород 49,13%
Кремний 26%
Массовая
Слайд 6Общая характеристика
Протий 1Н 99,985%
Дейтерий 1Н 0,015%
Тритий 1Н радиоактивный
ЭО 2,1
1
3
2
Слайд 8 Физические свойства
1. Бесцветный газ.
2. Не имеет запаха.
3.
4. Температура кипения жидкого водорода-252,8 градусов.
5. Малорастворим в воде.
Слайд 9Получение.
1.Пропусканием электрического тока
через воду.
Взаимодействием металлов с
Реакцией щелочных и щелочноземельных металлов с водой.
Слайд 10 Лабораторные способы
Взаимодействие активных металлов с растворами кислот
Zn + 2HCl =
Взаимодействие щелочных и щелочно-земельных металлов с водой
Ca + 2H2O = Ca(OH)2 + H2
2K + 2H2O = 2KOH + H2
Слайд 11Промышленные способы
Электролитическое разложение воды
2H2O = 2H2 + O2
Газификация твердого топлива
С +
Слайд 13Химические свойства
Водород - восстановитель
Горение
Н2 + О2= 2Н2О
РЕАКЦИИ С ДРУГИМИ НЕМЕТАЛЛАМИ
H2 +
H2 + S = H2S
3H2 + N2 = 2 NH3
С ОКСИДАМИ МЕТАЛЛОВ
H2 + CuO = Cu + H2O
Слайд 14Водород - окислитель
С расплавленными металлами под давлением образуются гидриды
H2 + 2Na
H2 + Ca = CaH2
Слайд 15Применение
В химической промышленности- получение аммиака, хлороводорода, метилового спирта
В пищевой промышленности -получение
твердых жиров из масел.
В металлургии -для восстановления некоторых металлов, для сварки и резки металлов.
Жидкий водород является одним из самых эффективных видов топлива.
Слайд 18Совместите название с классом веществ
Оксид калия
Гидроксид меди(2) Оксид
Хлорид бария Кислота
Серная кислота Соль
Оксид цинка Соль
Сульфат магния Оксид
Соляная кислота Кислота
Слайд 19Проверим!
Оксид калия
Гидроксид меди(2) Основание
Хлорид бария Соль
Серная кислота Кислота
Оксид цинка Оксид
Сульфат магния Соль
Соляная кислота Кислота
Слайд 20Задание.
С какими из перечисленных ниже веществ реагирует водород: калий,
Слайд 21Задача
Какая масса и какой объем водорода потребуется для восстановления
Какой объем водорода(у. н.) выделится при пропускании электрического тока через воду массой 180 г ?