- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Виды связей (11класс)
Содержание
- 1. Презентация по химии на тему Виды связей (11класс)
- 2. Химическая связь
- 3. Ковалентная связь (атомная) – взаимодействие между атомами
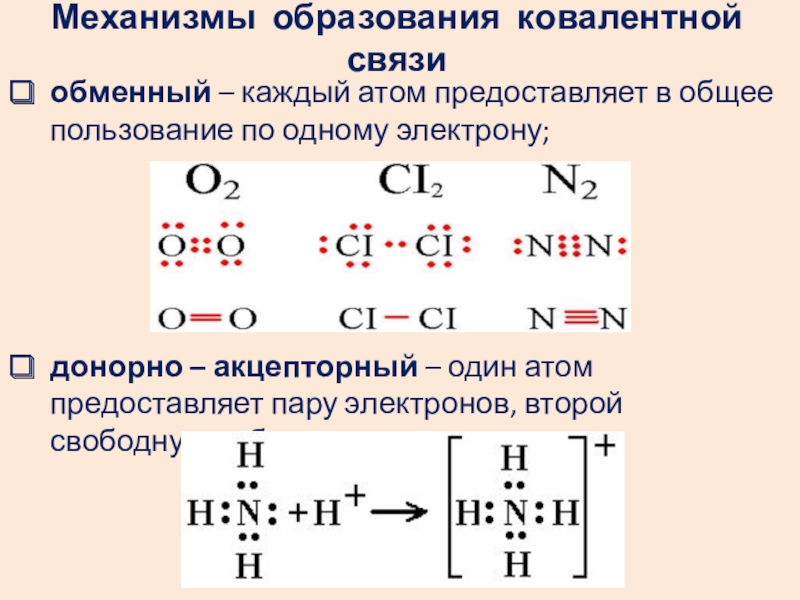
- 4. Механизмы образования ковалентной связиобменный – каждый атом
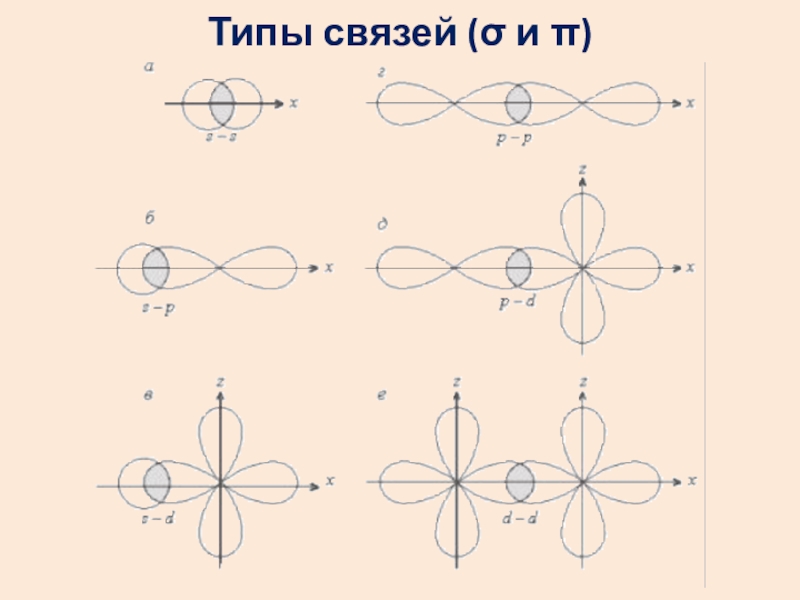
- 5. Типы связей (σ и π)
- 6. Слайд 6
- 7. Характеристики связиEСВ - количество энергии, выделяющейся при
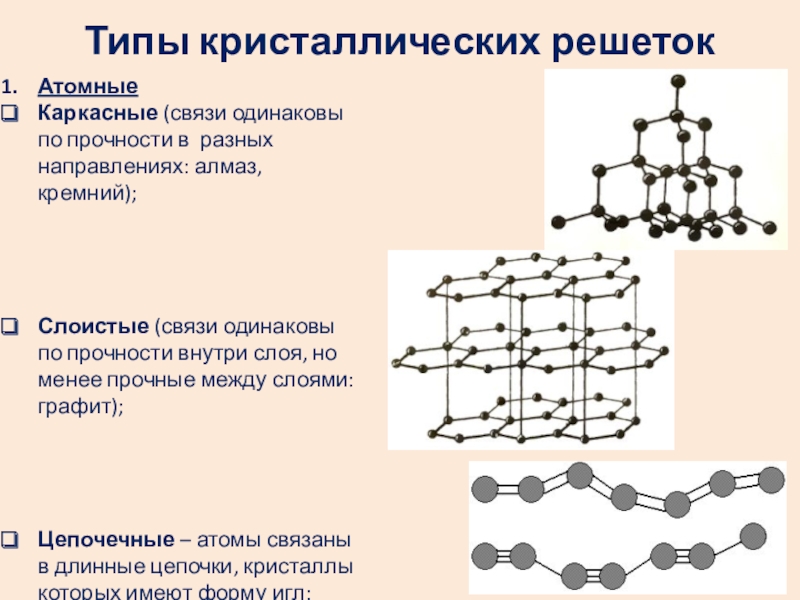
- 8. Типы кристаллических решетокАтомныеКаркасные (связи одинаковы по прочности
- 9. Типы кристаллических решеток2. Молекулярные (газы, вода, большинство
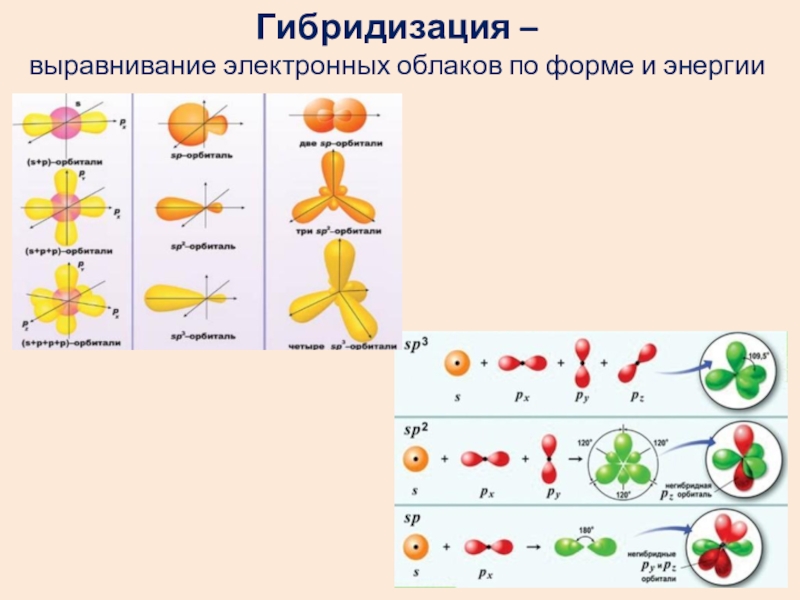
- 10. Гибридизация – выравнивание электронных облаков по форме и энергии
- 11. Гибридизации подвергаются электронные орбитали с близкими значениями
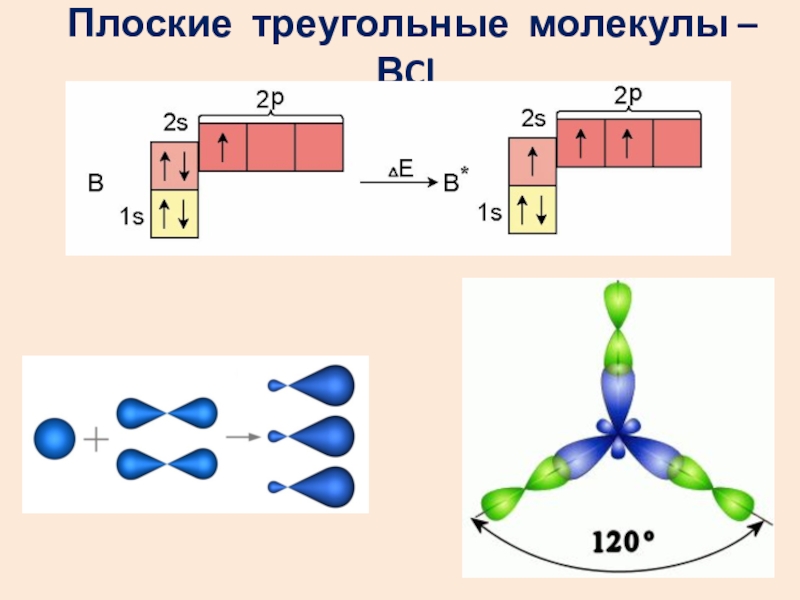
- 12. Плоские треугольные молекулы – ВCl3
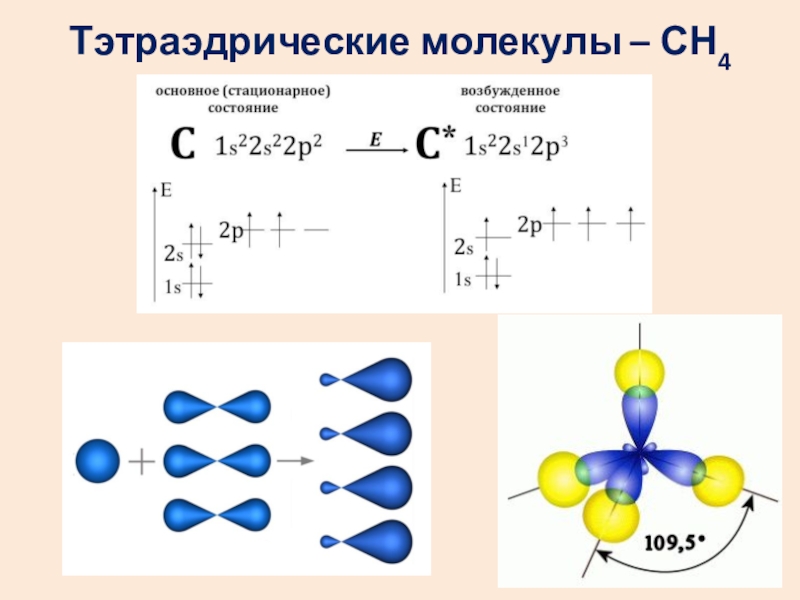
- 13. Тэтраэдрические молекулы – СН4
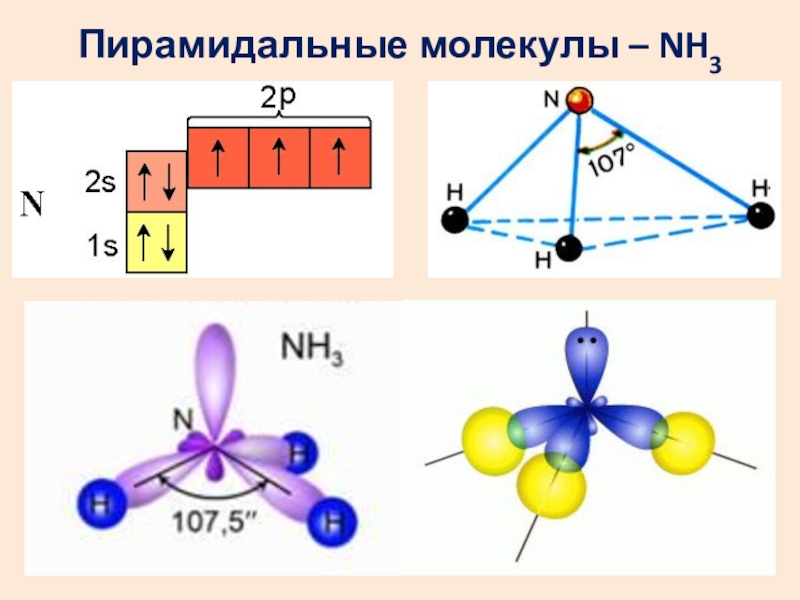
- 14. Пирамидальные молекулы – NH3
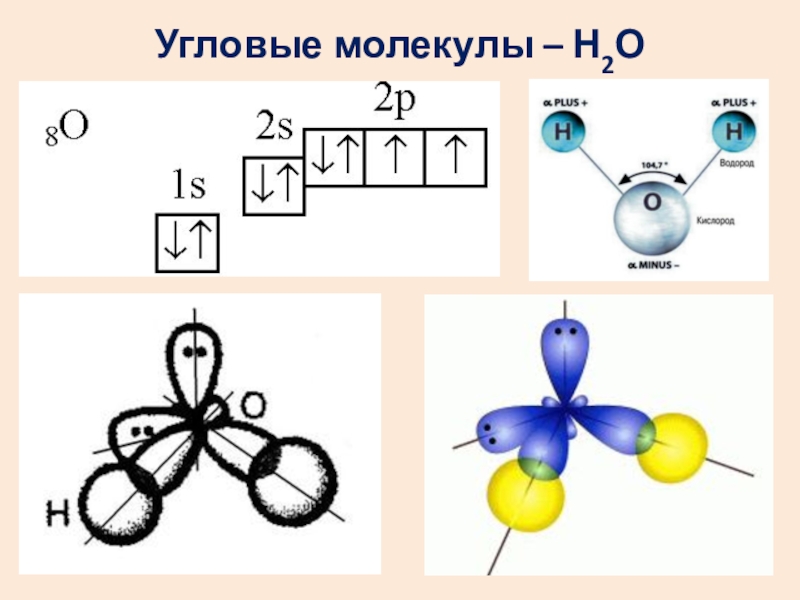
- 15. Угловые молекулы – Н2О
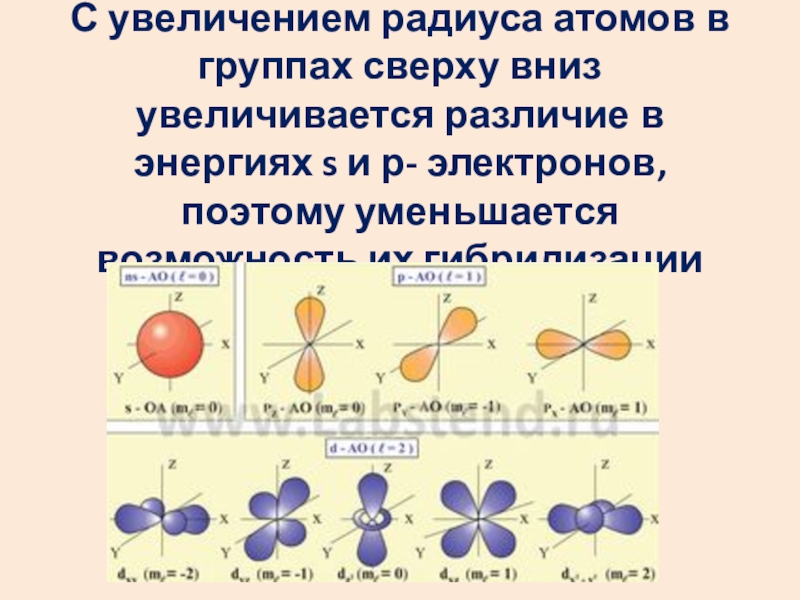
- 16. С увеличением радиуса атомов в группах сверху
- 17. Ионная связь – электростатическое взаимодействие между
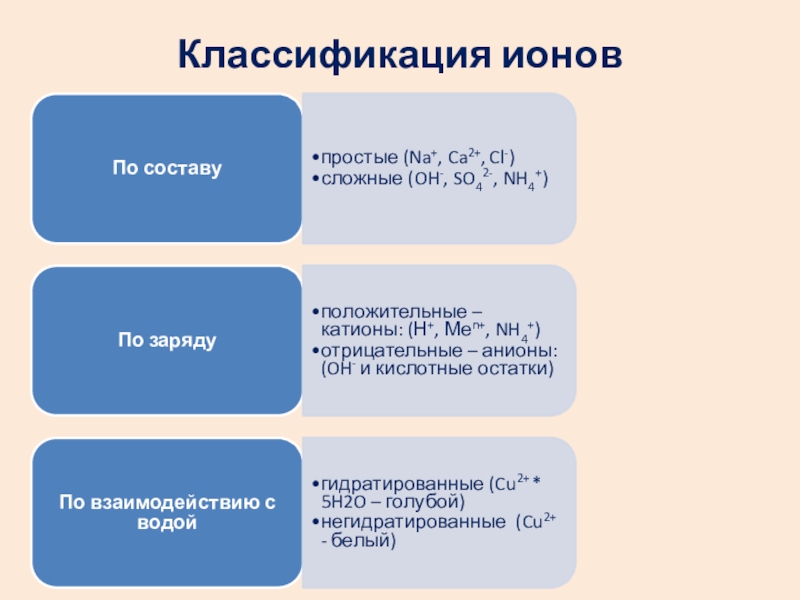
- 18. Классификация ионов
- 19. Вещества с ионной связью – это вещества,
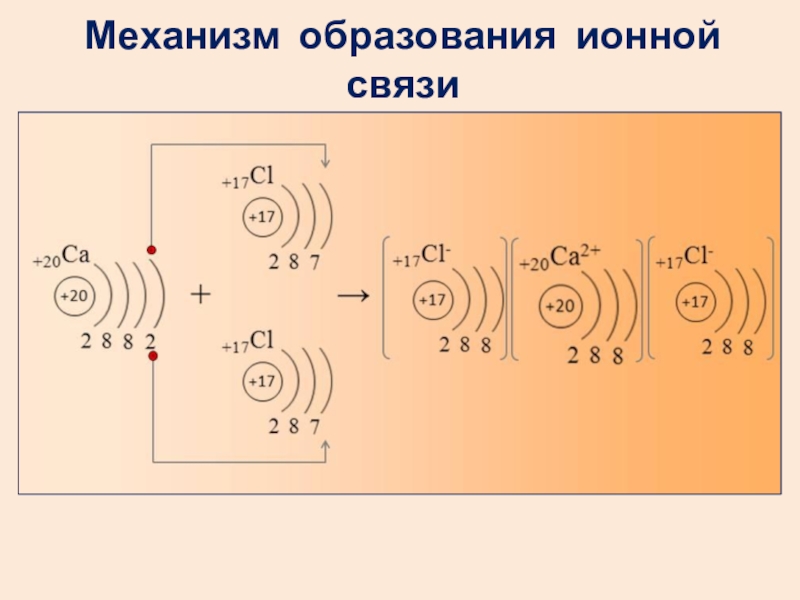
- 20. Механизм образования ионной связи
- 21. Характеристики ионной связиЕ св - … (чем
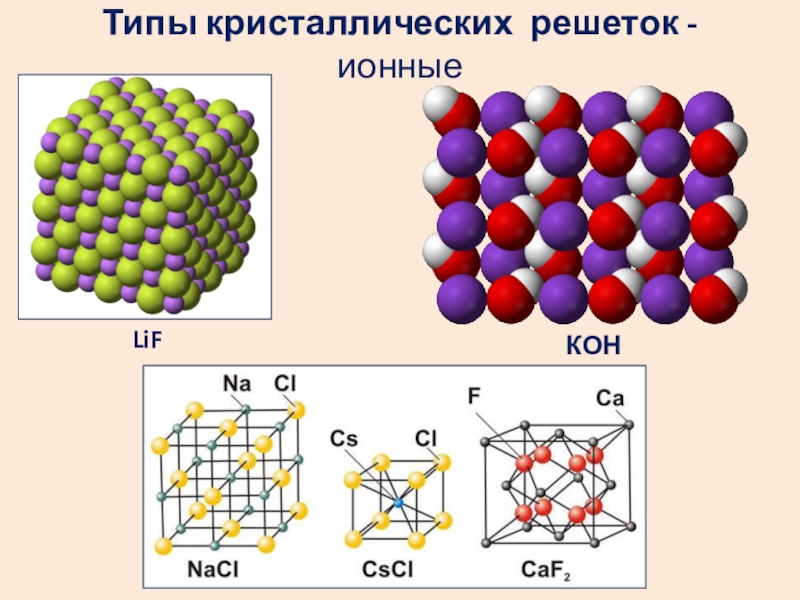
- 22. Типы кристаллических решеток - ионныеLiFКОН
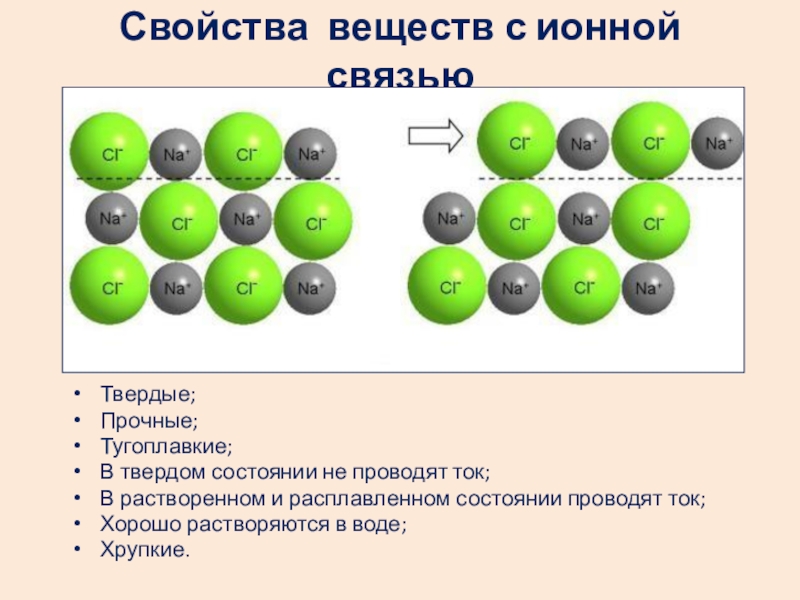
- 23. Свойства веществ с ионной связьюТвердые;Прочные;Тугоплавкие;В твердом состоянии
- 24. Металлическая связь – электростатическое взаимодействие между свободными электронами и катионами металлов ( металлы и сплавы)
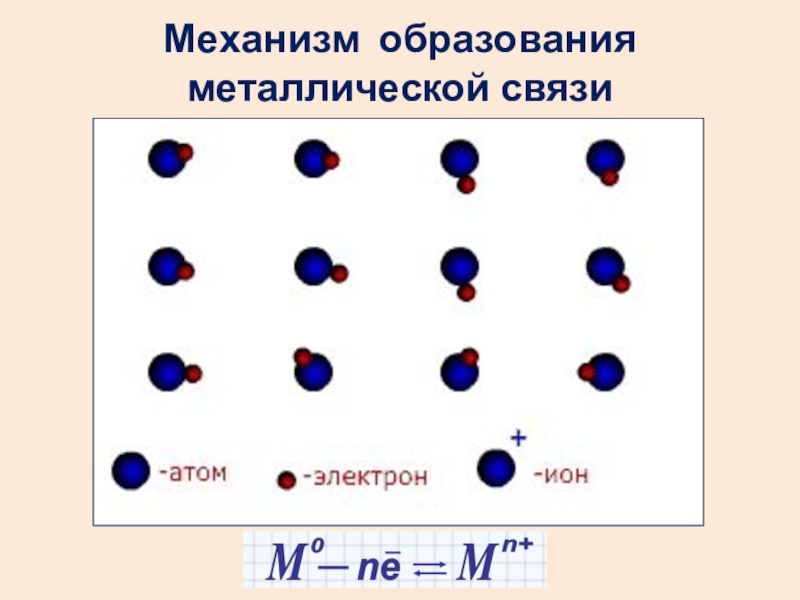
- 25. Механизм образования металлической связи
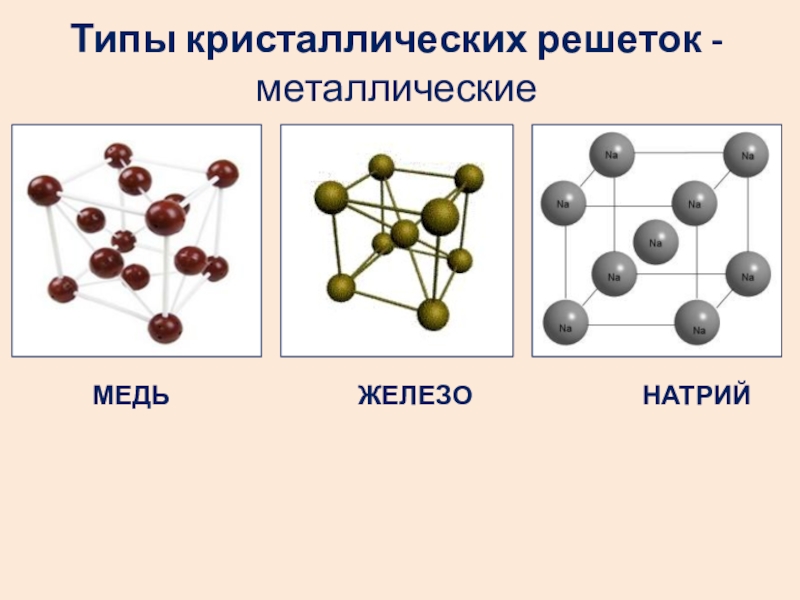
- 26. Типы кристаллических решеток - металлические
- 27. Свойства веществ с металлической связьюТвердые;Прочные;Блестят – отражают
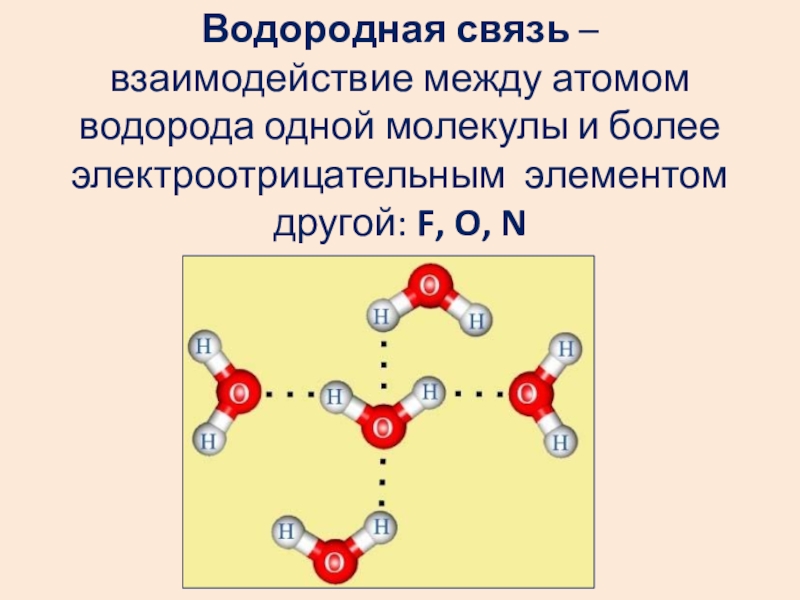
- 28. Водородная связь – взаимодействие между атомом
- 29. Водородная связьМежмолекулярная – возникает между молекулами: аммиак,
- 30. Характеристики водородной связиЕ св;Длина связи;Полярность связи;Насыщаемость;Направленность.
- 31. Деление на разные виды связей условно, т.к.В
- 32. Спасибо за внимание
Слайд 2 Химическая связь – взаимодействие между атомами, приводящее к образованию устойчивых многоатомных
2 причины:
стремление системы к минимуму энергии;
стремление атомов к завершению своих внешних слоев до октета
Слайд 3Ковалентная связь (атомная) – взаимодействие между атомами за счет образования общих
неполярная – возникает между атомами неметаллов с одинаковыми значениями электроотрицательности: Н2, О2, N2, Br2, Cl2, I2 , С60, S8 и т.д.
полярная – возникает между атомами неметаллов и металлов эо которых отличаются , но не сильно ( до 2): HCl, NH3, H2O, HI, HF, HBr, SiO2, Al2O3, Fe2O3, Cr2O3, SiC и т.д.
Слайд 4Механизмы образования ковалентной связи
обменный – каждый атом предоставляет в общее пользование
донорно – акцепторный – один атом предоставляет пару электронов, второй свободную орбиталь
Слайд 7Характеристики связи
EСВ - количество энергии, выделяющейся при образовании химической связи (кДж/моль).
(Чем
L СВ - расстояние между центрами химически связанных атомов (А0 или нм).
(С уменьшением длины связи растет энергия связи и устойчивость молекул).
Валентный угол – угол, образуемый лучами, выходящими из центра одного атома к центру двух других.
Кратность связи – число общих электронных пар.
(Чем выше кратность, тем выше энергия связи, но меньше длина связи)
Полярность связи – неравномерное распределение электронной плотности между атомами.
Насыщаемость – способность атомов присоединять определенное число других атомов.
Направленность – электронные облака перекрываются в пространстве в разных направлениях, поэтому геометрия молекул разная.
Поляризуемость – способность неполярных связей становится полярными под действием внешнего электрического поля.
Слайд 8Типы кристаллических решеток
Атомные
Каркасные (связи одинаковы по прочности в разных направлениях: алмаз,
Слоистые (связи одинаковы по прочности внутри слоя, но менее прочные между слоями: графит);
Цепочечные – атомы связаны в длинные цепочки, кристаллы которых имеют форму игл: карбин, асбест.
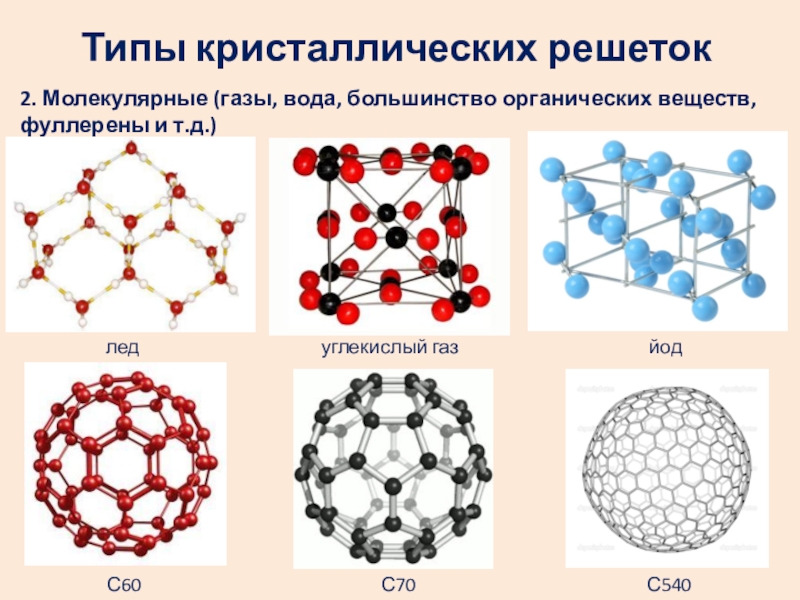
Слайд 9Типы кристаллических решеток
2. Молекулярные (газы, вода, большинство органических веществ, фуллерены и
лед углекислый газ йод
С60 С70 С540
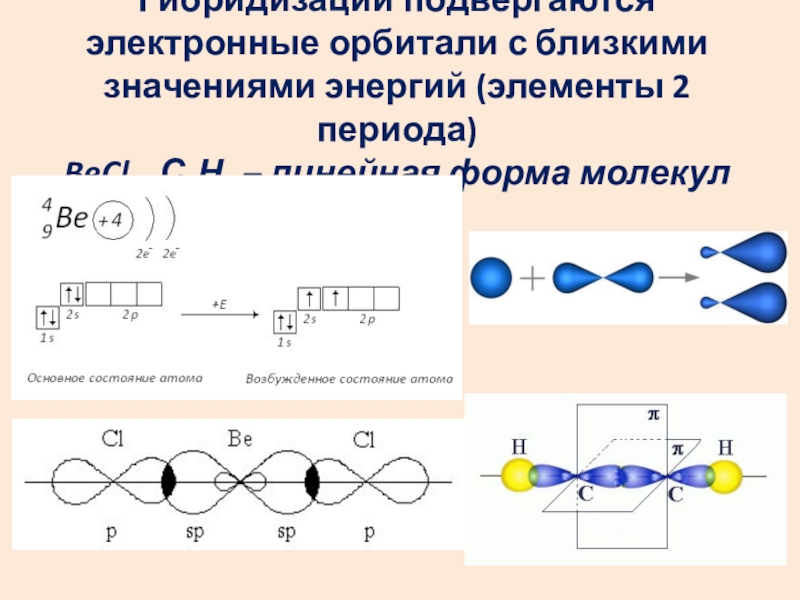
Слайд 11Гибридизации подвергаются электронные орбитали с близкими значениями энергий (элементы 2 периода)
Слайд 16С увеличением радиуса атомов в группах сверху вниз увеличивается различие в
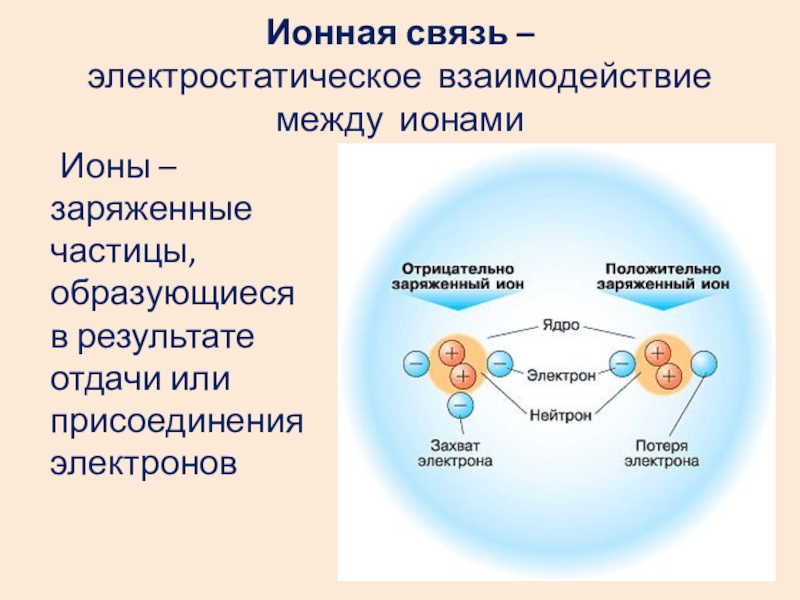
Слайд 17Ионная связь –
электростатическое взаимодействие между ионами
Ионы –
Слайд 19Вещества с ионной связью – это вещества, состоящие из атомов элементов
КОН
KCl
NH4Cl
Слайд 21Характеристики ионной связи
Е св - … (чем больше Е, тем больше
Ненаправленность – ионы притягиваются к противоионам в любом направлении;
Ненасыщенность – один ион может притягивать неограниченное количество противоионов.
Слайд 23Свойства веществ с ионной связью
Твердые;
Прочные;
Тугоплавкие;
В твердом состоянии не проводят ток;
В растворенном
Хорошо растворяются в воде;
Хрупкие.
Слайд 24Металлическая связь – электростатическое взаимодействие между свободными электронами и катионами металлов
Слайд 27Свойства веществ с металлической связью
Твердые;
Прочные;
Блестят – отражают световые лучи Al, Ag,
Пластичны – изменяют форму по внешним воздействием и сохраняют ее после прекращения этого воздействия Au;
Проводят тепло – и электрический ток Ag, Cu;
Не растворяются в воде.
Слайд 28Водородная связь – взаимодействие между атомом водорода одной молекулы и более
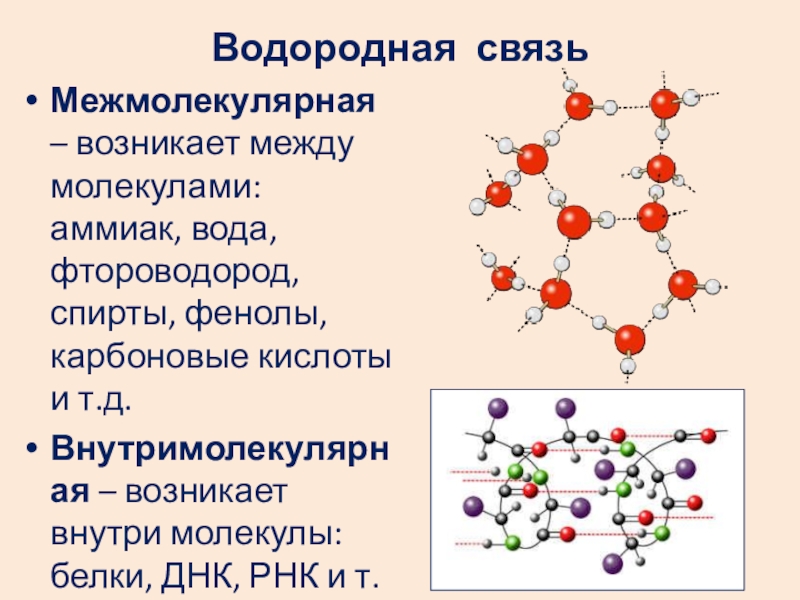
Слайд 29Водородная связь
Межмолекулярная – возникает между молекулами: аммиак, вода, фтороводород, спирты, фенолы,
Внутримолекулярная – возникает внутри молекулы: белки, ДНК, РНК и т.д.
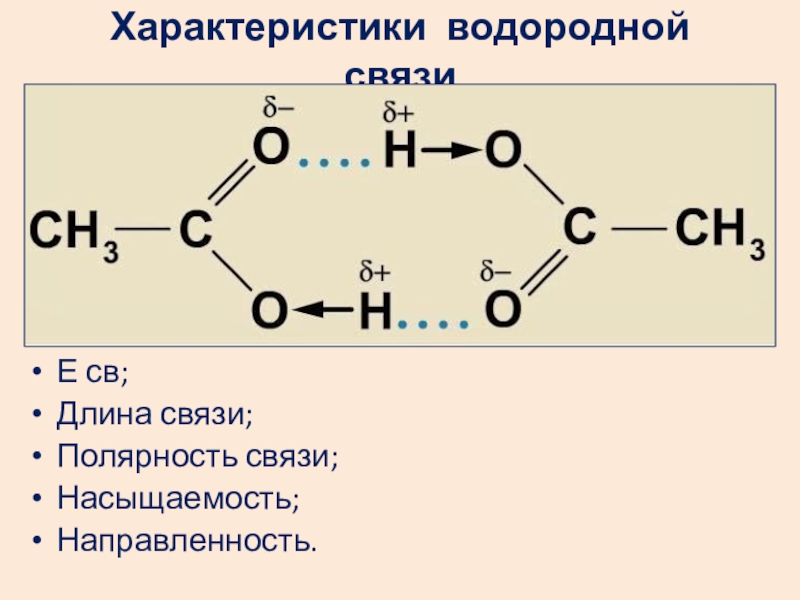
Слайд 30Характеристики водородной связи
Е св;
Длина связи;
Полярность связи;
Насыщаемость;
Направленность.
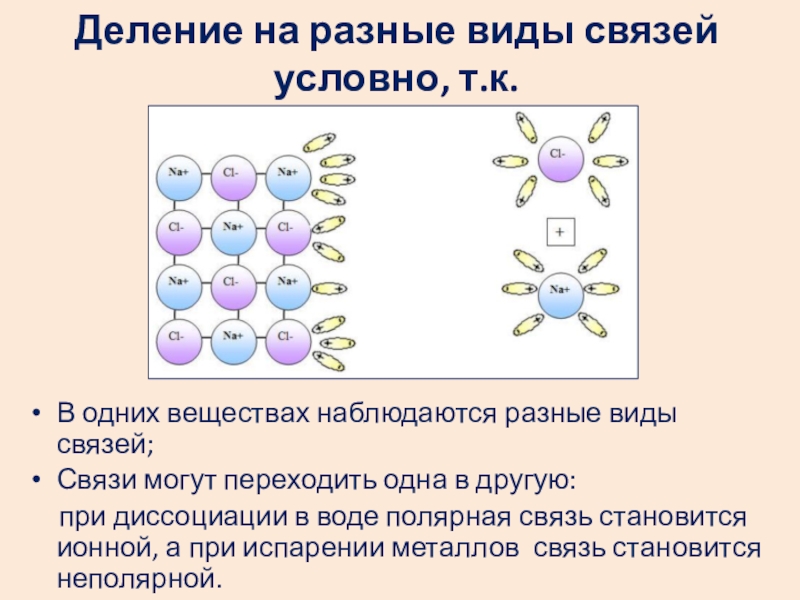
Слайд 31Деление на разные виды связей условно, т.к.
В одних веществах наблюдаются разные
Связи могут переходить одна в другую:
при диссоциации в воде полярная связь становится ионной, а при испарении металлов связь становится неполярной.