- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Устранение жесткости воды с помощью ионообменников
Содержание
- 1. Презентация по химии на тему Устранение жесткости воды с помощью ионообменников
- 2. Вода-источник всего живого.
- 3. Цель : Выявить эффективность использования
- 4. Методы исследования: Теоретический:анализ литературы.Практический:химический эксперимент;наблюдение.
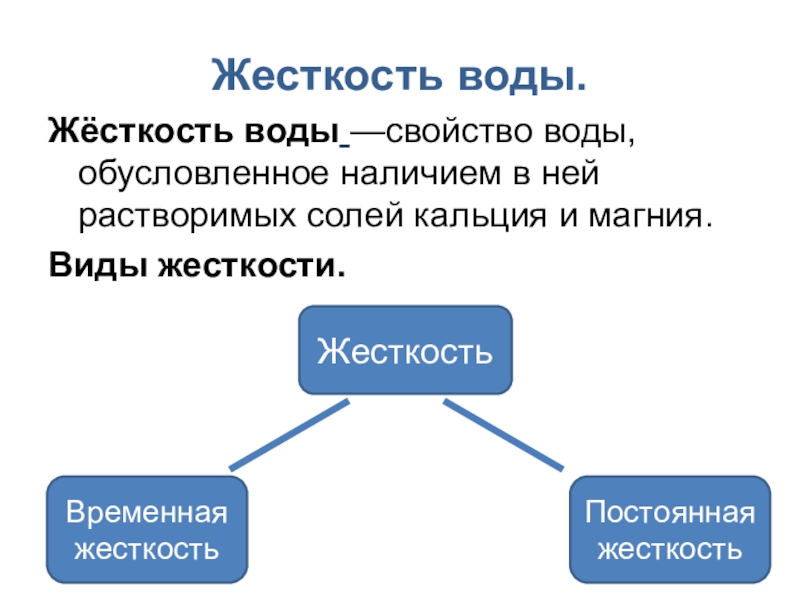
- 5. Жесткость воды.Жёсткость воды —свойство воды, обусловленное наличием в ней растворимых солей кальция и магния.Виды жесткости.ЖесткостьВременная жесткостьПостоянная жесткость
- 6. Временная жесткость. Временная жесткость вызвана
- 7. Постоянная жесткость. Постоянная жесткость обусловлена другими
- 8. Природа происхождения солей жесткости в воде
- 9. Опыт №1. Образование мыльной пены при перемешивании раствора мыла и дистиллированной воды.
- 10. Опыт №2
- 11. Вред жесткой воды для коммуникацийНакипь истончает стенки коммуникаций, впоследствии полностью разрушая их.
- 12. Обилие выпадающих в осадок
- 13. Вред, наносимый жесткой водой технике и предметам
- 14. Способы устранения жесткости.Бытовые:Кипячение и вымораживание.Фильтрование. Добавление умягчителей.Промышленные:
- 15. Ход экспериментаКатионитАнионит
- 16. 1.3. Зарядка катионита на ион водорода 2.
- 17. 1. 2. 3. 1. Зарядка анионита на
- 18. 1. Определение реакции среды полученного раствора после
- 19. Исследование приобретенного материала - катионообменной смолы (натриевой) на способность очистки жесткой воды. Катионообменная смола (натриевая)Схема процесса
- 20. Проведение качественной реакции на ионы кальция
- 21. Раствор хлорида кальция.Прохождение раствора хлорида кальция через
- 22. Результаты исследования 1) Ионообменный способ, показал себя
- 23. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 1
Устранение жесткости воды с помощью ионообменников
Подготовили: уч-ся 9А класса
Палихова Лада,
Костомарова Елена
Руководитель: учитель химии
Шипилова Н.В.
Слайд 3 Цель : Выявить эффективность использования ионообменного метода, как одного из способов
Задачи:
углубить теоретические знания о предмете исследования-жесткости воды;
исследовать экспериментальным путем эффективность использования ионообменников для устранения жесткости воды;
Объект исследования – жесткая вода.
Предмет исследования - жесткость воды.
Слайд 4Методы исследования:
Теоретический:
анализ литературы.
Практический:
химический эксперимент;
наблюдение.
Слайд 5Жесткость воды.
Жёсткость воды —свойство воды, обусловленное наличием в ней растворимых солей кальция
Виды жесткости.
Жесткость
Временная жесткость
Постоянная жесткость
Слайд 6Временная жесткость.
Временная жесткость вызвана присутствием в воде гидрокарбонатов
Слайд 7Постоянная жесткость.
Постоянная жесткость обусловлена другими солями кальция и магния.
Слайд 8Природа происхождения солей жесткости в воде
Природная вода, проходя через
Слайд 10 Опыт №2 Отсутствие пены при перемешивании раствора мыла и воды с
Слайд 11Вред жесткой воды для коммуникаций
Накипь истончает стенки коммуникаций, впоследствии полностью разрушая
Слайд 12 Обилие выпадающих в осадок или накипь солей жесткости,
Слайд 13Вред, наносимый жесткой водой технике и предметам быта
1.
3.
Разводы и твердый налет на:
1. поверхности посуды;
2. тене электрического чайника;
3. сантехнике.
Слайд 14Способы устранения жесткости.
Бытовые:
Кипячение и вымораживание.
Фильтрование.
Добавление умягчителей.
Промышленные:
Добавление кальцинированной соды Na2CO3
Слайд 161.3. Зарядка катионита на ион водорода 2. Использование раствора серной кислоты. 3. Определение
1.
2.
3.
4.
Слайд 171.
2.
3.
1. Зарядка анионита на гидроксид ион.
2. Использование раствора
Слайд 181. Определение реакции среды полученного раствора после прохождения раствора хлорида кальция
2. Определение реакции среды полученного раствора после прохождения раствора хлорида кальция через анионит, заряженный на гидроксид ион.
1.
2.
Слайд 19Исследование приобретенного материала - катионообменной смолы (натриевой) на способность очистки жесткой
Катионообменная смола (натриевая)
Схема процесса
Слайд 21Раствор хлорида кальция.
Прохождение раствора хлорида кальция через катионообменную смолу (натриевую).
Проведение
1.
2.
3.
Слайд 22Результаты исследования
1) Ионообменный способ, показал себя в экспериментах как эффективный
2) Катионообменная смола (натриевая), которую мы использовали, действительно справилась с поставленной задачей-очисткой жесткой воды, так как способна к обмену ионов Са2+ , содержащихся в жесткой воде, на ионы Na+ .