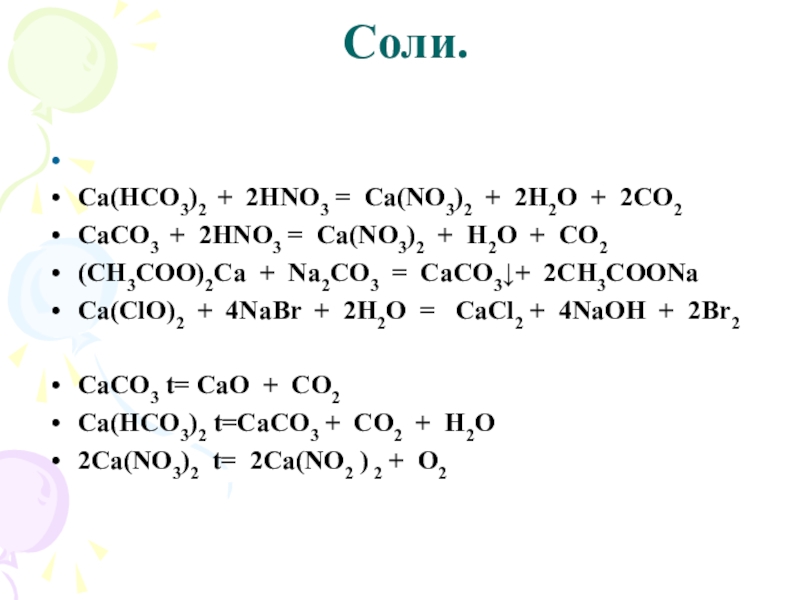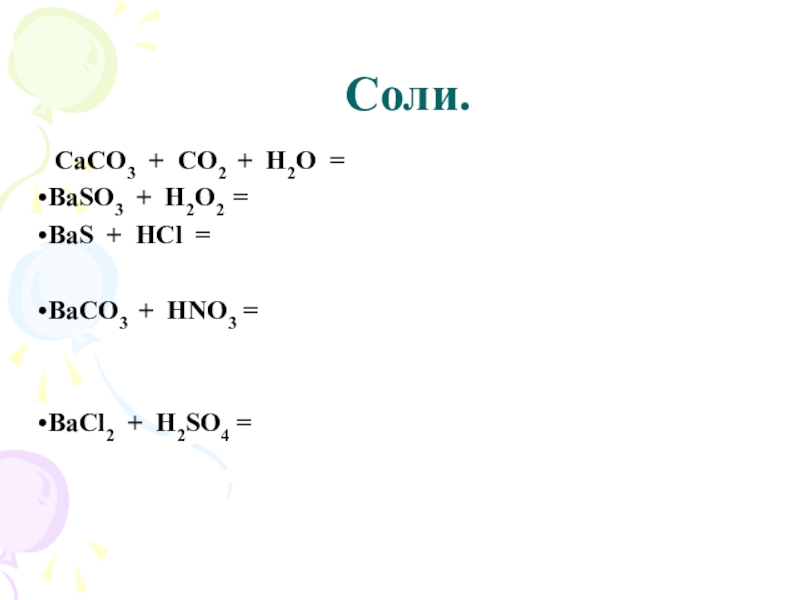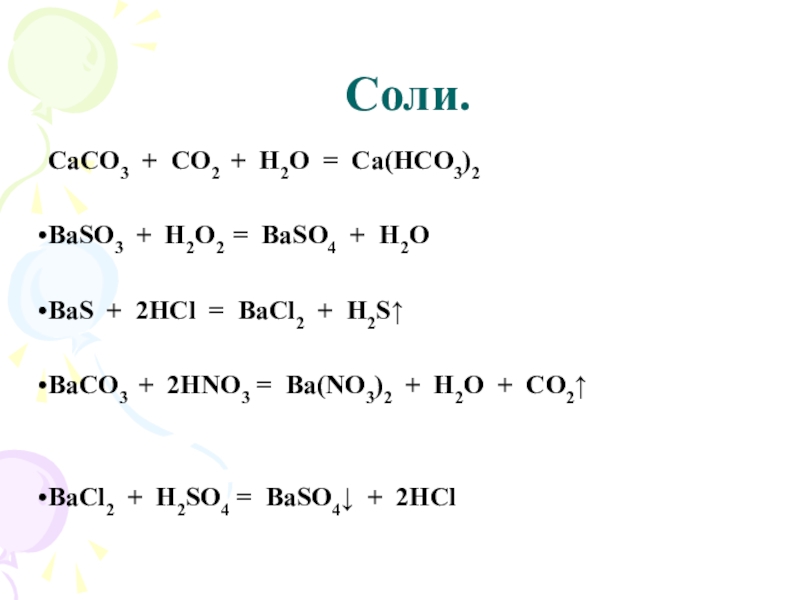- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Упражнения заданий егэ № 32 (11 класс)
Содержание
- 1. Презентация по химии на тему Упражнения заданий егэ № 32 (11 класс)
- 2. Важные соединения и минералы: CaCO3- мел, мрамор,
- 3. Важные соединения и минералы: BaSO4 -рентгенодиагностика;Ca3(PO4)2 -
- 4. Металлы IIA группы. Химические свойства щелочноземельных металлов
- 5. Реакции с неметаллами:Са + S = Mg
- 6. Реакции с неметаллами:Са + S = СаS
- 7. Реакции с водой: При комнатной температуре с
- 8. Реакции с водой:Ca + 2H2O = Ca(OH)2 + H2↑ Mg + 2H2O = Mg(OH)2 + H2↑
- 9. Взаимодействие с кислотами:Металлы IIА группы активно реагируют
- 10. Реакции со щелочами:Бериллий не только образует амфотерные
- 11. Реакции со щелочами: Be + 2NaOH + 2H2O
- 12. Взаимодействие с кислотами окислителями (азотной, концентрированной серной)
- 13. Взаимодействие с кислотами окислителями (азотной, концентрированной серной)
- 14. взаимодействие с аммиаком: 3Mg + 2NH3 = Mg3N2 + 3H2
- 15. Магний и кальций используют в качестве восстановителей. MoO
- 16. Магний восстанавливает из оксидов не только металлы,
- 17. Cоединения металлов IIА группы Оксиды. Оксид
- 18. Оксиды. CaO + H2O = (реакция
- 19. Оксиды. MgO + H2O + CO2 =
- 20. Гидроксиды.Гидроксид магния, гидроксиды щелочноземельных металлов – характер основный, гидроксид бериллия – характер амфотерный.
- 21. Гидроксиды. Сa(OH)2 (избыток) + CO2 = Ca(OH)2 +
- 22. Соли. Са(НСО3)2 + HNO3 = СаСО3
- 23. Соли. Са(НСО3)2 + 2HNO3 = Ca(NO3)2
- 24. Соли. CaCO3 + CO2 + H2O =BaSO3
- 25. Соли.CaCO3 + CO2 + H2O =
- 26. Соли. BaSO4 + 4C = BaS
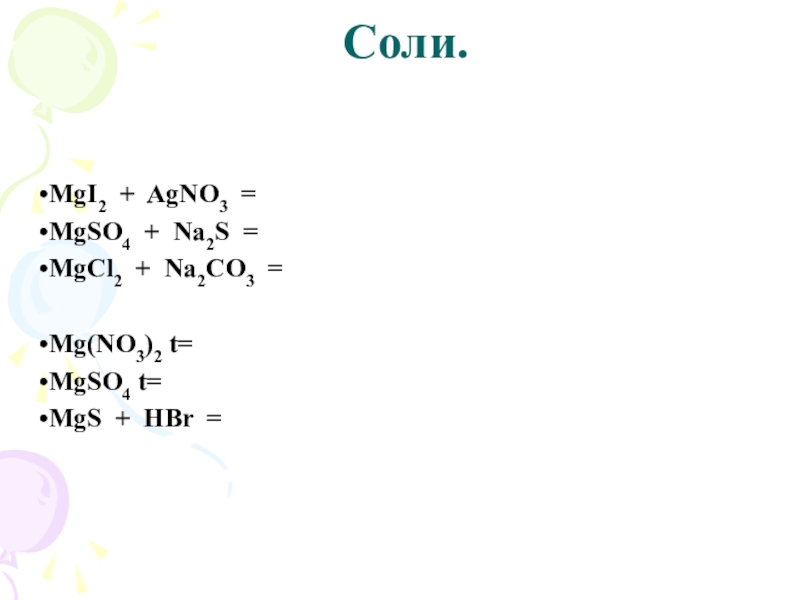
- 27. Соли. MgI2 + AgNO3 =MgSO4 +
- 28. Соли. MgI2 + 2AgNO3 = ↓2AgI
- 29. Задания № 32
- 30. Магниевую стружку нагрели в атмосфере азота и
- 31. Фосфат кальция прокалили с углём в присутствии
- 32. Сульфат бария сплавили с коксом. Твердый остаток
- 33. Вещество, образующееся при сплавлении магния с кремнием,
- 34. Смесь порошков нитрита калия и хлорида аммония
- 35. Нитрат натрия сплавили с оксидом хрома (III)
- 36. Оксид кремния прокалили с большим избытком магния.
Важные соединения и минералы: CaCO3- мел, мрамор, известняк;MgCO3- производство стекла, цемента, кирпича;CaSO4*2H2O -гипс;2CaSO4*H2O - алебастр;MgSO4*7H2O - английская соль;
Слайд 2Важные соединения и минералы:
CaCO3- мел, мрамор, известняк;
MgCO3- производство стекла, цемента, кирпича;
CaSO4*2H2O
-гипс;
2CaSO4*H2O - алебастр;
MgSO4*7H2O - английская соль;
2CaSO4*H2O - алебастр;
MgSO4*7H2O - английская соль;
Слайд 3Важные соединения и минералы:
BaSO4 -рентгенодиагностика;
Ca3(PO4)2 - минералы фосфорит, апатит;
Ca(OH)2 - известковая
вода, молоко, гашённая известь;
CaO - негашёная известь;
MgO - жжёная известь.
CaO - негашёная известь;
MgO - жжёная известь.
Слайд 4
Металлы IIA группы.
Химические свойства щелочноземельных металлов во многом напоминают свойства щелочных
металлов, а магний и бериллий имеют некоторые характерные особенности.
Бериллий, магний и щелочноземельные металлы горят на воздухе.
2Мe + O2 = 2МeO
Бериллий, магний и щелочноземельные металлы горят на воздухе.
2Мe + O2 = 2МeO
Слайд 5Реакции с неметаллами:
Са + S =
Mg + S =
Mg +
Si=
Mg + N2 =
Ba + N2 =
Са + H2 =
Be + S =
Be + Cl2 =
Mg + N2 =
Ba + N2 =
Са + H2 =
Be + S =
Be + Cl2 =
Слайд 6Реакции с неметаллами:
Са + S = СаS
Mg + S =
MgS
2Mg + Si = Mg2Si
3Mg + N2 = Mg3N2
3Ba + N2 = Ba3N2
Са + H2 = CaH2
Be + S = BeS
Be + Cl2 = BeCl2
2Mg + Si = Mg2Si
3Mg + N2 = Mg3N2
3Ba + N2 = Ba3N2
Са + H2 = CaH2
Be + S = BeS
Be + Cl2 = BeCl2
Слайд 7Реакции с водой:
При комнатной температуре с водой реагируют только щелочноземельные металлы.
Магний при нагревании.
Ca + H2O =
Mg + H2O =
Ca + H2O =
Mg + H2O =
Слайд 9Взаимодействие с кислотами:
Металлы IIА группы активно реагируют с разбавленными кислотами:
Mе +
HCl = MеCl2 + Н2
Mе + H2SO4(разб.) = MеSO4 + H2
Mе + H2SO4(разб.) = MеSO4 + H2
Слайд 10Реакции со щелочами:
Бериллий не только образует амфотерные оксид и гидроксид, но
и сам реагирует с щелочами в концентрированных растворах или при сплавлении:
Be + NaOH + H2O =
Be + NaOH(тв) =
Be + NaOH + H2O =
Be + NaOH(тв) =
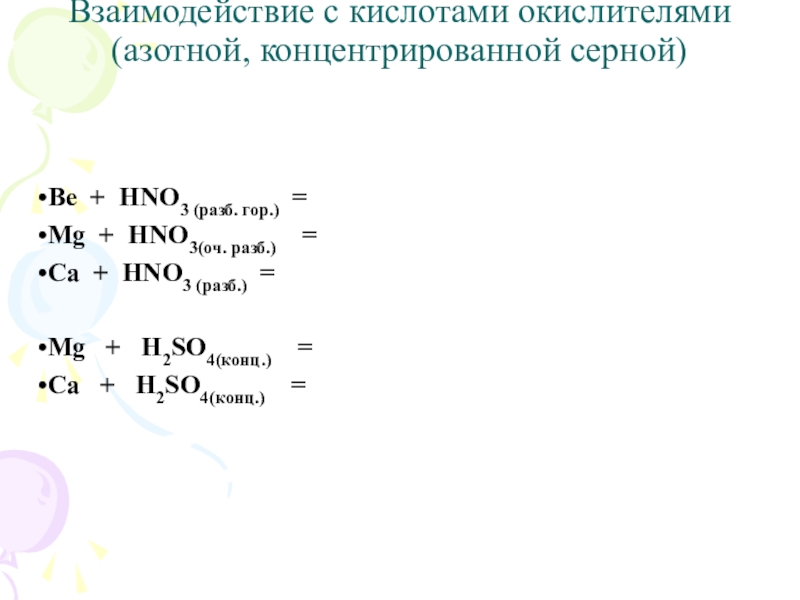
Слайд 12Взаимодействие с кислотами окислителями (азотной, концентрированной серной)
Ве + HNO3 (разб. гор.)
=
Mg + HNO3(оч. разб.) =
Ca + HNO3 (разб.) =
Mg + H2SO4(конц.) =
Са + H2SO4(конц.) =
Mg + HNO3(оч. разб.) =
Ca + HNO3 (разб.) =
Mg + H2SO4(конц.) =
Са + H2SO4(конц.) =
Слайд 13Взаимодействие с кислотами окислителями (азотной, концентрированной серной)
3Ве + 8HNO3 (разб. гор.)
= 3Ве(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
4Ca + 10HNO3 (разб.) = 4Ca(NO3)2 + N2O + 5H2O
4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
4Са + 5H2SO4(конц.) = 4СаSO4 + H2S + 4H2O
4Mg + 10HNO3(оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
4Ca + 10HNO3 (разб.) = 4Ca(NO3)2 + N2O + 5H2O
4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
4Са + 5H2SO4(конц.) = 4СаSO4 + H2S + 4H2O
Слайд 16
Магний восстанавливает из оксидов не только металлы, но и неметаллы.
2Mg +
CO2 = 2MgO + C
2Mg + SiO2 = Si + 2MgO (ниже 800°С)
4Mg + SiO2 = Mg2Si + 2MgO ( 1000°С)
2Mg + SiO2 = Si + 2MgO (ниже 800°С)
4Mg + SiO2 = Mg2Si + 2MgO ( 1000°С)
Слайд 17
Cоединения металлов IIА группы
Оксиды.
Оксид магния, оксиды щелочноземельных металлов – основные.
Вступают в реакции с водой, кислотными оксидами, кислотами. Оксид бериллия – амфотерный. Амфотерность оксида бериллия выражается в его способности реагировать как с кислотами, так и с щелочами при сплавлении или в растворе.
Слайд 18Оксиды.
CaO + H2O = (реакция идет при комнатной температуре)
MgO
+ H2O(пар) = Mg(OH)2 (100° – 150°С)
CaO + CO2 =
MgO + H2SO4 =
BeO + HCl =
BeO + NaOH(тв)=
BeO + NaOH + H2O =
CaO + CO2 =
MgO + H2SO4 =
BeO + HCl =
BeO + NaOH(тв)=
BeO + NaOH + H2O =
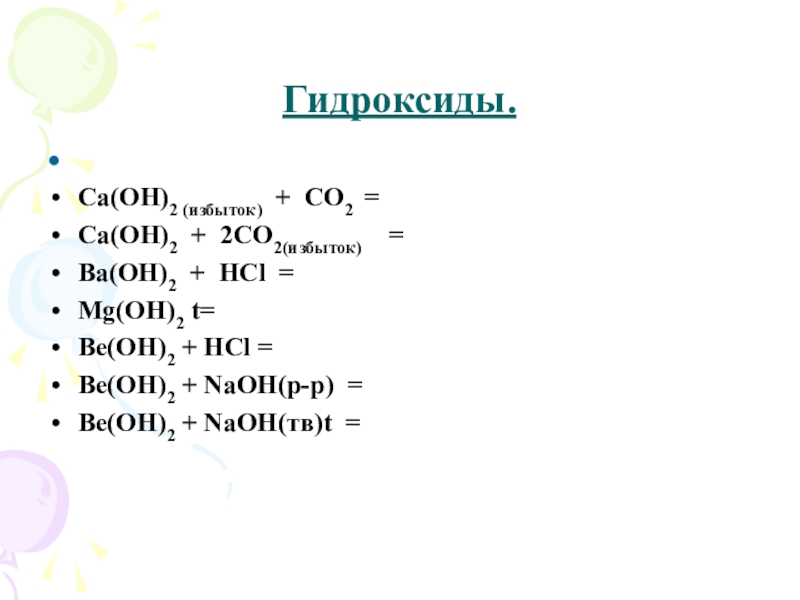
Слайд 20Гидроксиды.
Гидроксид магния, гидроксиды щелочноземельных металлов – характер основный, гидроксид бериллия –
характер амфотерный.
Слайд 21Гидроксиды.
Сa(OH)2 (избыток) + CO2 =
Ca(OH)2 + 2CO2(избыток) =
Ba(OH)2 +
HCl =
Mg(OH)2 t=
Be(OH)2 + HCl =
Be(OH)2 + NaOH(р-р) =
Be(OH)2 + NaOH(тв)t =
Mg(OH)2 t=
Be(OH)2 + HCl =
Be(OH)2 + NaOH(р-р) =
Be(OH)2 + NaOH(тв)t =
Слайд 22 Соли.
Са(НСО3)2 + HNO3 =
СаСО3 + HNO3 =
(CH3COO)2Ca +
Na2CO3 =
Ca(ClO)2 + NaBr + H2O =
CaCO3 t=
Са(НСО3)2 t=
Ca(NO3)2 t=
Ca(ClO)2 + NaBr + H2O =
CaCO3 t=
Са(НСО3)2 t=
Ca(NO3)2 t=
Слайд 23 Соли.
Са(НСО3)2 + 2HNO3 = Ca(NO3)2 + 2H2O + 2CO2
СаСО3 +
2HNO3 = Ca(NO3)2 + H2O + CO2
(CH3COO)2Ca + Na2CO3 = CaCO3↓+ 2CH3COONa
Ca(ClO)2 + 4NaBr + 2H2O = CaCl2 + 4NaOH + 2Br2
CaCO3 t= CaO + CO2
Са(НСО3)2 t=CaCO3 + CO2 + H2O
2Ca(NO3)2 t= 2Ca(NO2 ) 2 + O2
(CH3COO)2Ca + Na2CO3 = CaCO3↓+ 2CH3COONa
Ca(ClO)2 + 4NaBr + 2H2O = CaCl2 + 4NaOH + 2Br2
CaCO3 t= CaO + CO2
Са(НСО3)2 t=CaCO3 + CO2 + H2O
2Ca(NO3)2 t= 2Ca(NO2 ) 2 + O2
Слайд 25 Соли.
CaCO3 + CO2 + H2O = Ca(HCO3)2
BaSO3 + H2O2 =
BaSO4 + H2O
BaS + 2HCl = BaCl2 + H2S↑
BаСО3 + 2HNO3 = Ba(NO3)2 + H2O + CO2↑
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
BaS + 2HCl = BaCl2 + H2S↑
BаСО3 + 2HNO3 = Ba(NO3)2 + H2O + CO2↑
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Слайд 26 Соли.
BaSO4 + 4C = BaS + 4CO
BaSO4 + 4H2 = BaS + 4H2O
Ba(H2PO4)2 + Ba(OH)2 =
Ba(NO3)2 + Na3PO4 =
Слайд 28 Соли.
MgI2 + 2AgNO3 = ↓2AgI + Mg(NO3)2
MgSO4 + Na2S =
MgS↓ + Na2SO4
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2Mg(NO3)2 t= 2MgO + 4NO2↑ + O2↑
2MgSO4 t= 2MgO + 2SO2 + O2
MgS + 2HBr = MgBr2 + H2S↑
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2Mg(NO3)2 t= 2MgO + 4NO2↑ + O2↑
2MgSO4 t= 2MgO + 2SO2 + O2
MgS + 2HBr = MgBr2 + H2S↑
Слайд 30Магниевую стружку нагрели в атмосфере азота и продукт реакции последовательно обработали
кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций.
Слайд 31Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое
вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
Слайд 32Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте,
выделившийся газ вступил в реакцию оксидом серы (IV), а раствор – с сульфитом натрия. Напишите уравнения описанных реакций.
Слайд 33Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате
образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
Слайд 34Смесь порошков нитрита калия и хлорида аммония растворили в воде и
раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.
Слайд 35Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия.
выделившийся при этом газ прореагировал с избытком гидроксида кальция с выпадением осадка белого цвета. Осадок растворили в избытке раствора бромоводородной кислоты и в полученный раствор добавили раствор нитрата серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
Слайд 36Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали
водой. При этом выделился газ, который сожгли в кислороде. Твердый продукт сжигания растворили в концентрированном растворе гидроксида цезия. Напишите уравнения описанных реакций.










![Презентация по химии на тему Упражнения заданий егэ № 32 (11 класс) Реакции со щелочами: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2Be Реакции со щелочами: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2Be + 2NaOH = Na2BeO2 + H2](/img/thumbs/e8d7e02bda52c936b0f5b1b63fe3b517-800x.jpg)