- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод
Содержание
- 1. Презентация по химии на тему Углерод
- 2. Притча Жил мудрец,
- 3. - Когда и кем был открыт элемент
- 4. (в 1669 г. Хеннигом Брандом)(Белый и красный)(Пентаоксид
- 5. Критерии оценивания: Правильный ответ на 9 -10
- 6. Составьте уравнения реакций, с помощью которых можно
- 7. Критерии оценивания: Правильно составлены 4 реакции –
- 8. Цели урока:1. Изучить строение атома углерода, опираясь
- 9. Какой химический знак углерода?Какой атомный номер и
- 10. 1 - группаС6, +6Ar(C) = 12612 – 6 = 62 - группа64IIIVКарбогениум
- 11. Критерии оценивания: Правильный ответ на 5 вопросов
- 12. В Периодической системе химических элементов Д.И. Менделеева
- 13. Расположение электронов атома углерода: +6С )2 ē)4ē
- 14. Нахождение в природе. Соединения углерода составляют
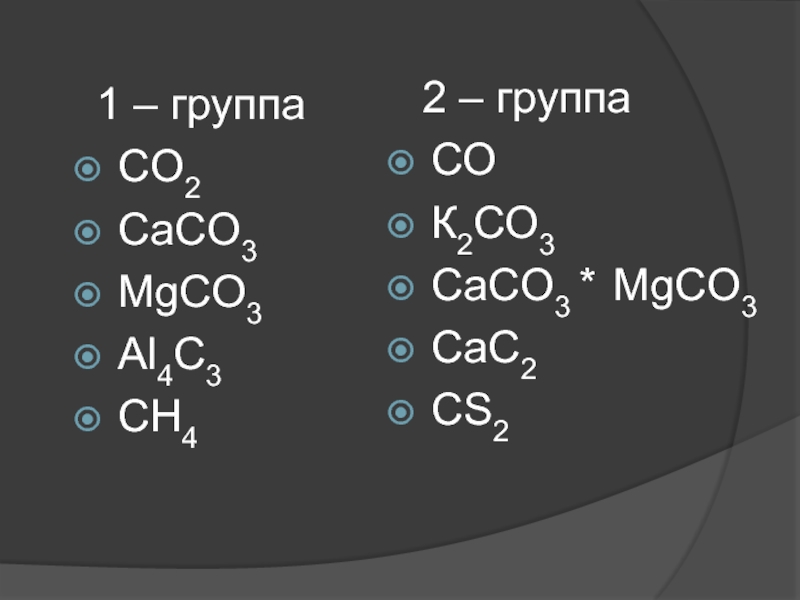
- 15. Напишите химические формулы веществ: 1 -
- 16. 1 – группаCO2CaCO3MgCO3Al4C3CH4 2 – группаСОК2СО3CaCO3 * MgCO3СаС2CS2
- 17. Критерии оценивания: Правильный ответ на 5 вопросов
- 18. Аллотропные модификации углерода Составить по учебнику
- 19. Алмаз
- 20. АдсорбцияВещества, содержащие практически чистый углерод, получают сухой
- 21. Древесный уголь – продукт перегонки древесины, костяной
- 22. Если в раствор лакмуса поместить активированный уголь происходит обесцвечивание раствора Сделайте выводы
- 23. Химические свойства углерода.Углерод может проявлять свойства и
- 24. Восстановительные свойства1. При нагревании с водяным паром
- 25. Закончите уравнения реакций1 – группаC + O2
- 26. 1 – группаC + O2
- 27. Критерии оценивания: Правильный ответ на 5 вопросов
- 28. Выполнение тестов1 - группа. 1. Электронная формула внешнего
- 29. Выполнение тестов2 – группа.1. Углерод в химических реакциях
- 30. Тест 1. 1) 1, 2) 2, 3)
- 31. Творческое задание«Применение углерода»Защита работы. Оценивание (2 звезды и 1 пожелание).
- 32. Рефлексия1. Как ты оцениваешь полученные сегодня знания?2.
- 33. Домашнее задание:§21 упр. 10,11. Доклад на тему «Круговорот углерода в природе»
Слайд 2Притча
Жил мудрец, который знал все. Один
Слайд 3- Когда и кем был открыт элемент фосфор?
- Назови аллотропные видоизменения
- Что образуется, когда фосфор горит в кислороде?
- Что образует фосфор когда реагирует с металлами?
- Какие степени окисления проявляет фосфор? - Назови относительную атомную массу фосфора?
- Летучее водородное соединение фосфора
- Назови порядковый номер фосфора?
- Где применяется фосфор?
- Назовите крупные залежи фосфорного сырья в Казахстане
Слайд 4(в 1669 г. Хеннигом Брандом)
(Белый и красный)
(Пентаоксид фосфора P2O5)
(Фосфиды)
(-3,
(31)
(Фосфин PH3)
(15)
(Производство спичек, фосфорной кислоты, фосфорные удобрения, пиротехнике, металлургической промышленности)
(Жамбылская область (Каратау), Актюбинская область (Чилисай))
Слайд 5Критерии оценивания:
Правильный ответ на 9 -10 вопросов – 5
Правильный
Правильный ответ на 4 – 6 вопросов– 3
Слайд 6Составьте уравнения реакций, с помощью которых можно осуществить превращения:
P→P2O5→H3PO4→Ca3(PO4)2→Ca(H2PO4)2
4P + 5O2
P2O5 + 3H2O → 2H3PO4
2H3PO4 +3CaO → Ca3(PO4)2 + 3H2O
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Слайд 7Критерии оценивания:
Правильно составлены 4 реакции – 5
Правильно составлены 3
Правильно составлены 1 – 2 реакции – 3
Слайд 8Цели урока:
1. Изучить строение атома углерода, опираясь на положение в периодической
2. Изучить аллотропные модификации углерода;
3. Изучить химические свойства и применение углерода;
Слайд 9Какой химический знак углерода?
Какой атомный номер и заряд ядра?
Какова атомная масса
Сколько протонов в ядре атома?
Сколько нейтронов в ядре атома?
Сколько электронов в атоме углерода?
Сколько валентных электронов?
Чему равна низшая степень окисления?
Чему равна высшая степень окисления?
Назовите латинское название углерода
Слайд 11Критерии оценивания:
Правильный ответ на 5 вопросов – 5
Правильный ответ
Правильный ответ на 2 – 3 вопроса – 3
Слайд 12В Периодической системе химических элементов Д.И. Менделеева углерод находится во 2
На внешнем энергетическом уровне атом углерода содержит 4 электрона.
Слайд 13Расположение электронов атома углерода: +6С )2 ē)4ē
Электронная формула углерода:
В соединениях углерод может проявлять степени окисления
-4, +2, +4
Строение атома углерода:
612С(6p 6n) 6ē
Слайд 14Нахождение в природе.
Соединения углерода составляют основу живой природы,
Слайд 15Напишите химические формулы веществ:
1 - группа
Диоксид углерода
Карбонат кальция
Магнезит
Карбид
Метан
2 группа
Монооксид углерода
Карбонат
калия
Доломит
Карбид кальция
Сероуглерод
Слайд 17Критерии оценивания:
Правильный ответ на 5 вопросов – 5
Правильный ответ
Правильный ответ на 2 – 3 вопроса – 3
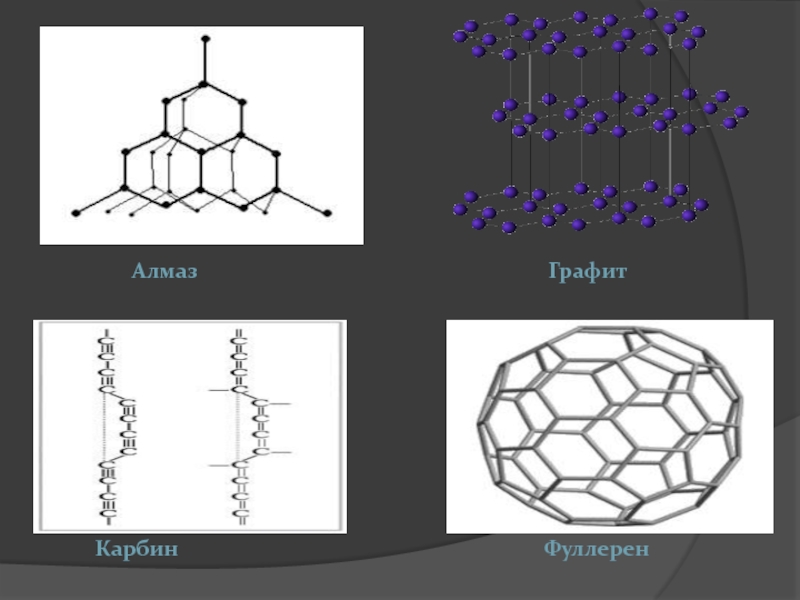
Слайд 18Аллотропные модификации углерода
Составить по учебнику характеристику о строении, составе
1 группа: алмаз, карбин
2 группа: графит, фуллерен
Слайд 20Адсорбция
Вещества, содержащие практически чистый углерод, получают сухой перегонкой – нагреванием веществ
Если подвергать каменный уголь, древесину, кости животных сухой перегонке, то образуются разные летучие газообразные вещества и твердый осадок, богатый углеродом кокс, который является нелетучим продуктом сухой перегонки каменного угля. Из газообразных продуктов можно получить около 700 новых веществ.
Слайд 21Древесный уголь – продукт перегонки древесины, костяной уголь – костей. Уголь,
Свойство угля и других твердых веществ поглощать и удерживать на своей поверхности газы и растворенные вещества называется адсорбцией.
Слайд 22Если в раствор лакмуса поместить активированный уголь происходит обесцвечивание раствора
Слайд 23Химические свойства углерода.
Углерод может проявлять свойства и окислителя, и восстановителя. При
Окислительные свойства
1.При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ:
С + O2 = CO2
При недостатке кислорода образуется оксид углерода (II), или угарный газ:
2С + О2 = 2СО
2. С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов.
С + 2H2 = CH4
3. Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом:
С + 2S = CS2
С + 2F2 = CF4
2С + N2 = (CN)2
Слайд 24Восстановительные свойства
1. При нагревании с водяным паром он вытесняет из воды
Н2O + С = СО + Н2
2. При нагревании углерода с оксидом углерода (IV) образуется угарный газ:
С + СО2 = 2СО
3. Углерод восстанавливает многие металлы из их оксидов:
2Fe2O3 + 3С = 4Fe + 3CO2
4. С металлами или их оксидами углерод образует карбиды:
CaO + 3C = CaC2 + СО
4Al + 3C = Al4C3
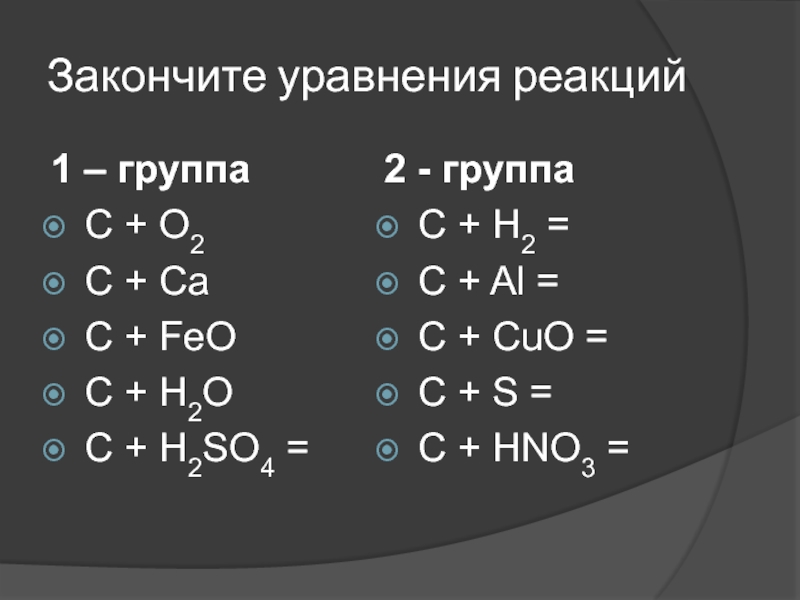
Слайд 25Закончите уравнения реакций
1 – группа
C + O2
C + Ca
C
C + H2O
C + H2SO4 =
2 - группа
C + H2 =
C + Al =
C + CuO =
С + S =
C + HNO3 =
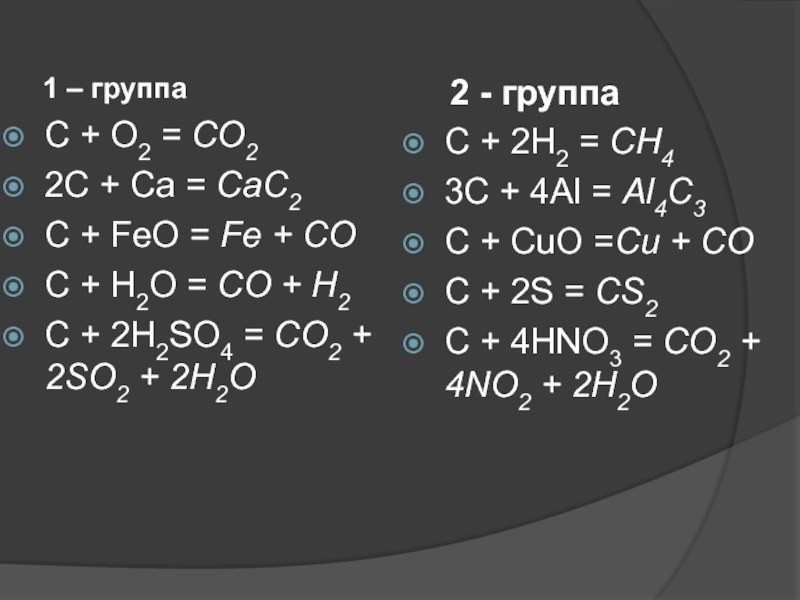
Слайд 26 1 – группа
C + O2 = СО2
2C + Ca
C + FeO = Fe + CO
C + H2O = CO + H2
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
2 - группа
C + 2H2 = СН4
3C + 4Al = Аl4С3
C + CuO =Сu + CO
С + 2S = CS2
C + 4HNO3 = CO2 + 4NO2 + 2H2O
Слайд 27Критерии оценивания:
Правильный ответ на 5 вопросов – 5
Правильный ответ
Правильный ответ на 2 – 3 вопроса – 3
Слайд 28Выполнение тестов
1 - группа.
1. Электронная формула внешнего энергетического уровня атома углерода
1) …2S2 2P2; 2) … 2S2 2P1; 3) … 2S22P4.
2. Аллотропия – это:
1) условный заряд атомов химического элемента;
2) способность атомов химического элемента образовывать несколько простых веществ;
3) определенный вид атомов.
3. Причины аллотропии:
1) строение кристаллических решеток и число атомов в молекулах;
2) число атомов в молекулах и цвет веществ;
3) строение кристаллических решеток и агрегатное состояние.
4. Аллотропными модификациями углерода являются:
1) кристаллическая и пластическая;
2) алмаз и графит;
3) красная и белая.
5. В каком агрегатном состоянии углерод встречается в природе:
1) в твердом;
2) в газообразном;
3) в жидком.
Слайд 29Выполнение тестов
2 – группа.
1. Углерод в химических реакциях может быть:
1) только окислителем;
2)
3) окислителем и восстановителем.
2. Степень окисления углерода в угарном газе равна:
1)+4 2) - 2 3) +2
3. Адсорбция – это:
1) способность поглощать вещества;
2) распадаться на ионы;
3) несмачиваемость.
4. Соединение Al4C3 называется:
1) карбонат алюминия; 2) нитрид алюминия; 3) карбид алюминия.
5. Сухой лед – это твердый
1) СО2; 2) СО; 3) СН4
Слайд 30Тест 1. 1) 1, 2) 2, 3) 1, 4) 2, 5)
Правильный ответ на 5 вопросов – 5
Правильный ответ на 4 вопроса – 4
Правильный ответ на 2 – 3 вопроса – 3
Слайд 32Рефлексия
1. Как ты оцениваешь полученные сегодня знания?
2. С каким настроением ты
3. Как оцениваешь свою деятельность?
4. Как оцениваешь деятельность партнера?