- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод и его свойства.
Содержание
- 1. Презентация по химии на тему Углерод и его свойства.
- 2. Цель : сформировать представления о свойствах
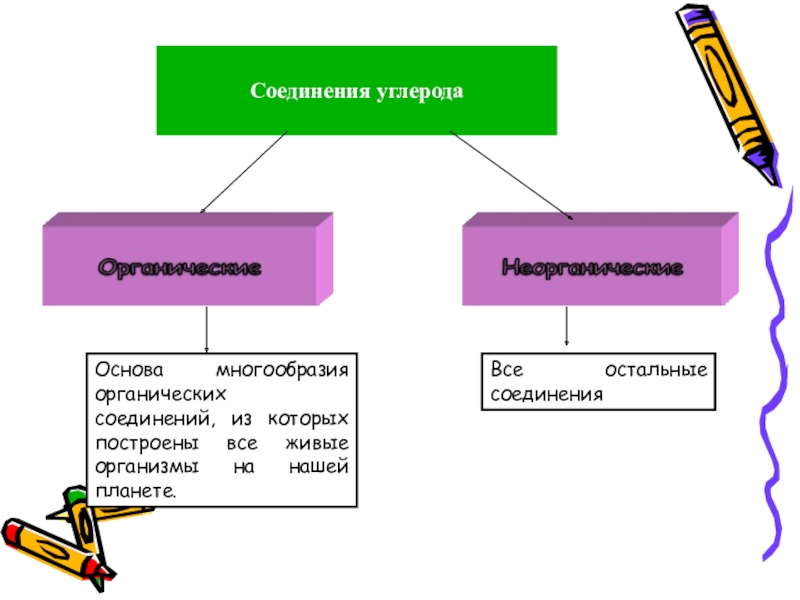
- 3. Соединения углеродаОснова многообразия органических соединений, из которых построены все живые организмы на нашей планете.Все остальные соединения
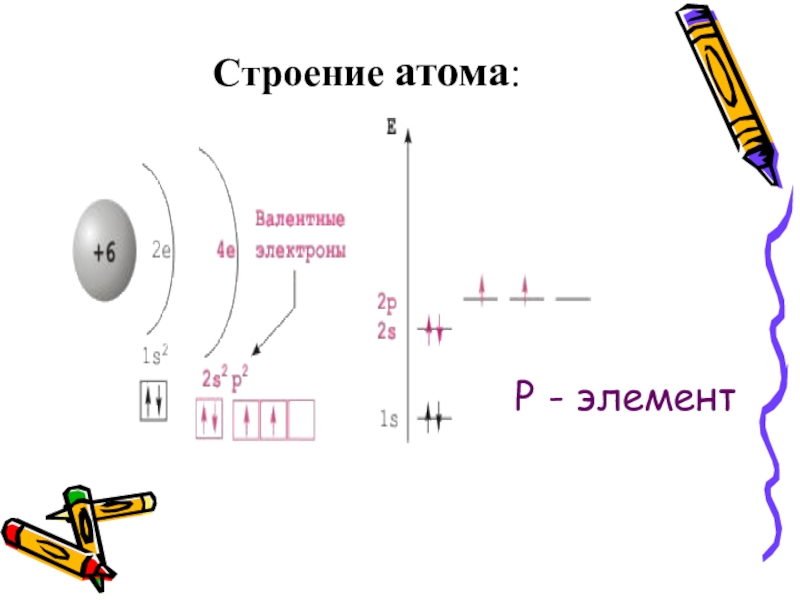
- 4. Строение атома Углерод (Carboneum-рождающий уголь)
- 5. Строение атома:Р - элемент
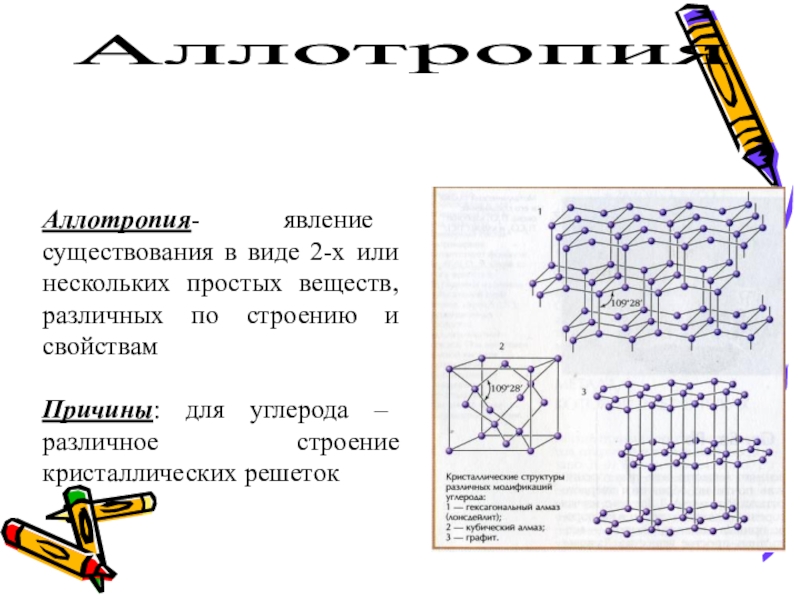
- 6. АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых веществ.?
- 7. Аллотропия Аллотропия- явление существования в виде 2-х
- 8. Аллотропные модификации Алмаз – бесцветное, прозрачное, сильно преломляющее
- 9. Аллотропные модификацииГрафит – устойчивая при нормальных условиях
- 10. Аморфный углеродАктивированный уголь - пористое вещество, которое
- 11. - свойство углерода удерживать на пористой поверхности
- 12. Химические свойства углерода При нагревании углерод соединяется
- 13. Углерод — сильный восстановитель. При нагревании с
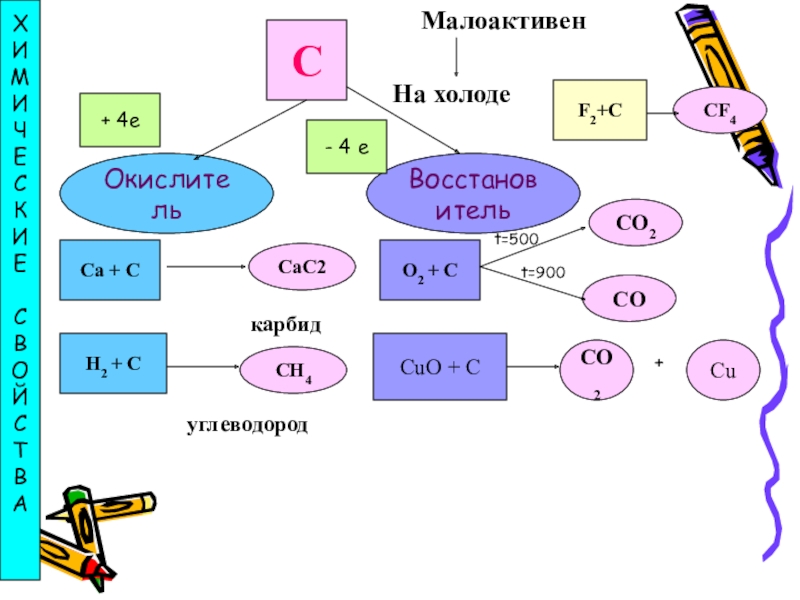
- 14. СМалоактивенНа холодеОкислительВосстановительХИМИЧЕСКИЕСВОЙСТВА+ 4e- 4 eCa + CF2+CO2 + CCuO + CH2 + CCaC2СH4CF4CO2карбидуглеводородCOt=500t=900CO2Cu+
- 15. Сстальсельское хозяйствотопливомедицинатипографияювелирные изделияадсорбентрезинакрем обувиПрименение
- 16. Слайд 16
- 17. Самостоятельная работа Составить схемы
- 18. Какое значение имеют для тебя знания и
- 19. Как ты оцениваешь полученные сегодня знания?Не осознанныеОсознанныеГлубокие
- 20. Домашнее задание 1.§ 29 упр 8 2.СОСТАВИТЬ ТАБЛИЦУ ПО СРАВНЕНИЮ СВОЙСТВ АЛМАЗА И ГРАФИТА.
- 21. Список использованной литературы: Габриелян,О.С. Химия. 9 класс
Слайд 1
Углерод и его свойства.
9 класс.
Учитель химии и биологии Лямцева Эльвира
Слайд 2 Цель : сформировать представления о свойствах углерода, уметь составлять схемы строения
Вопрос :
1. Почему на основе углерода строиться жизнь?
2. Почему углерод стал «началом вех начал» ?
Слайд 3Соединения углерода
Основа многообразия органических соединений, из которых построены все живые организмы
Все остальные соединения
Слайд 4
Строение атома
Углерод (Carboneum-рождающий уголь)
Химический элемент IV группы периодической системы Менделеева-неметалл
На внешнем энергетическом уровне содержит 4 электрона
Атомная масса 12,011
степени окисления: -4, 0, +2, +4
IV
II
Слайд 6АЛЛОТРОПИЯ -
способность атомов одного химического элемента образовывать несколько простых веществ.
?
Слайд 7Аллотропия
Аллотропия- явление существования в виде 2-х или нескольких простых веществ,
Причины: для углерода – различное строение кристаллических решеток
Слайд 8Аллотропные модификации
Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже
Куллинан
Эксельсиор
Орлов
Хоуп
Слайд 9Аллотропные модификации
Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет
а – модель строения алмаза
б – модель строения графита
Слайд 10Аморфный углерод
Активированный уголь - пористое вещество, которое получают из различных углеродсодержащих
Слайд 11- свойство углерода удерживать на пористой поверхности растворенные вещества и газы.
Н. Д. Зелинский
Н. Д. Зелинский разработал противогаз, который спас множество солдат в первой мировой войне. Так же применяется в медицине, химической, фармацевтической и пищевой промышленностях
Слайд 12Химические свойства углерода
При нагревании углерод соединяется с кислородом, образуя оксид
С + O2 = CO2
При недостатке кислорода образуется оксид углерода (II), или угарный газ:
2С + О2 = 2СО
С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан:
С + 2H2 = CH4
Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом:
С + 2S = CS2
С + 2F2 = CF4
2С + N2 = (CN)2
Слайд 13Углерод — сильный восстановитель. При нагревании с водяным паром он вытесняет
Н2O + С = СО + Н2
При нагревании углерода с оксидом углерода (IV) образуется угарный газ:
С + СО2 = 2СО
Углерод восстанавливает многие металлы из их оксидов:
2Fe2O3 + 3С = 4Fe + 3CO2
С металлами или их оксидами углерод образует карбиды:
CaO + 3C = CaC2 + СО
Слайд 14С
Малоактивен
На холоде
Окислитель
Восстановитель
Х
И
М
И
Ч
Е
С
К
И
Е
С
В
О
Й
С
Т
В
А
+ 4e
- 4 e
Ca + C
F2+C
O2 + C
CuO + C
H2
CaC2
СH4
CF4
CO2
карбид
углеводород
CO
t=500
t=900
CO2
Cu
+
Слайд 15С
сталь
сельское хозяйство
топливо
медицина
типография
ювелирные изделия
адсорбент
резина
крем обуви
Применение
Слайд 17
Самостоятельная работа
Составить схемы электронного баланса следующих реакций:
Ca + 2C = CaC2
4A1
C + 2FeO = 2Fe + CO2
Слайд 18 Какое значение имеют для тебя знания и умения, полученные на уроке?
Важные
Очень важны
Слайд 21Список использованной литературы:
Габриелян,О.С. Химия. 9 класс :учеб. Для общеобразоват. Учреждениц
Габриелян,О.С Настольная книга учителя химии. 9 класс», М.: «Блик и К0», 2001 -213 с.
CD: «Химия–9 («Просвещение»)», мультимедийное учебное пособие нового образца.
Иллюстрации : ресурсы сети Интернет.















![Презентация по химии на тему Углерод и его свойства. Список использованной литературы: Габриелян,О.С. Химия. 9 класс :учеб. Для общеобразоват. Учреждениц Список использованной литературы: Габриелян,О.С. Химия. 9 класс :учеб. Для общеобразоват. Учреждениц / М.: Дрофа, 2008 -267, [5]](/img/thumbs/6c2bdd9a8daeca0f0b438110a2cd413e-800x.jpg)





