- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Углерод, строение атома, валентные состояния, гибридизация электронных облаков (9 класс)
Содержание
- 1. Презентация по химии на тему Углерод, строение атома, валентные состояния, гибридизация электронных облаков (9 класс)
- 2. 1.1. УглеродСимвол С, элемент IVA группы 2-го периода Периодической
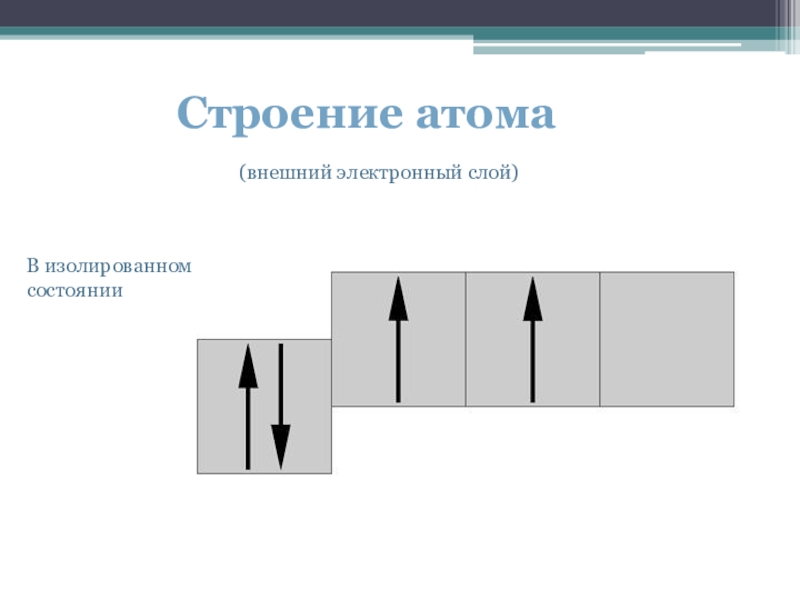
- 3. Строение атомаВ изолированном состоянии(внешний электронный слой)
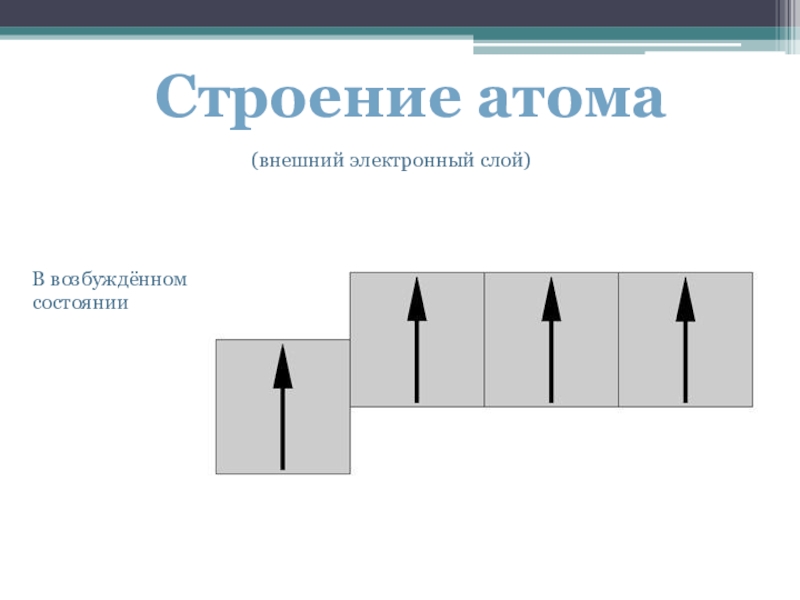
- 4. В возбуждённом состоянииСтроение атома(внешний электронный слой)
- 5. Форма электронных облаков
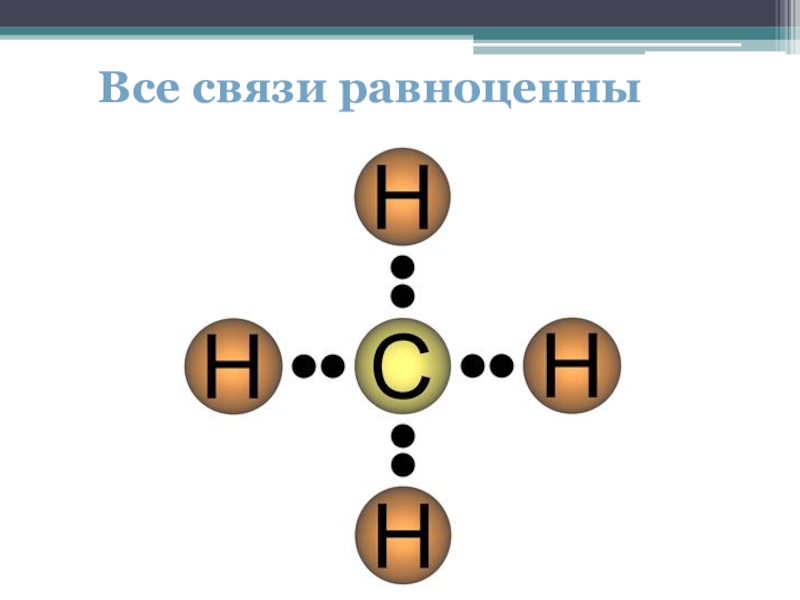
- 6. Все связи равноценны
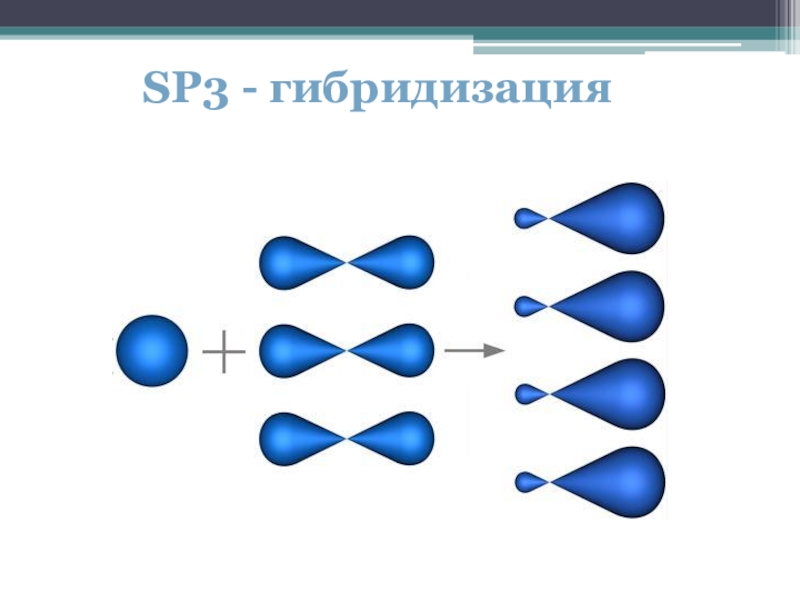
- 7. SP3 - гибридизация
- 8. Расположение гибридизованных облаков в атоме
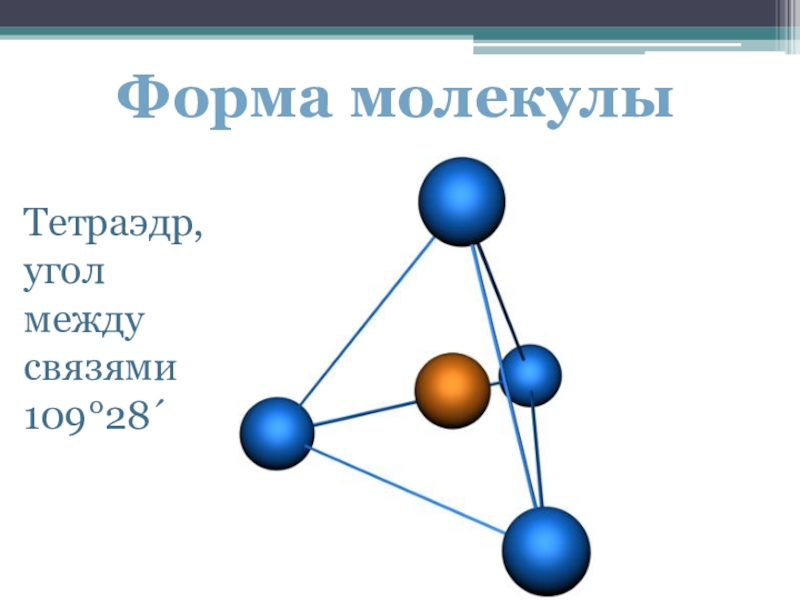
- 9. Форма молекулыТетраэдр, угол между связями 109°28´
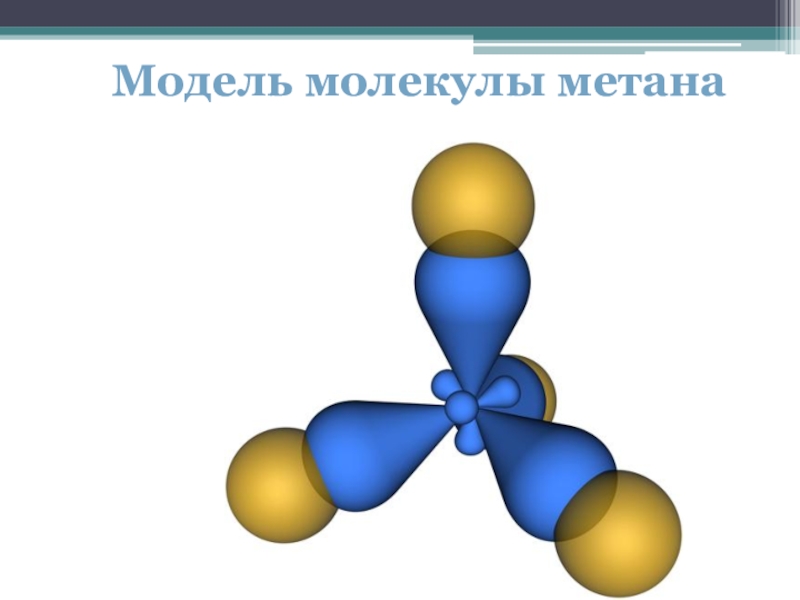
- 10. Модель молекулы метана
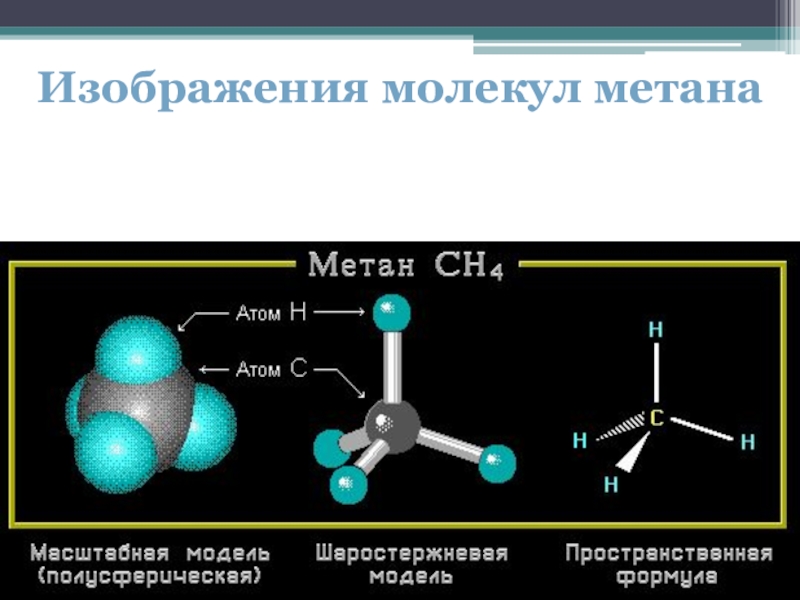
- 11. Изображения молекул метана
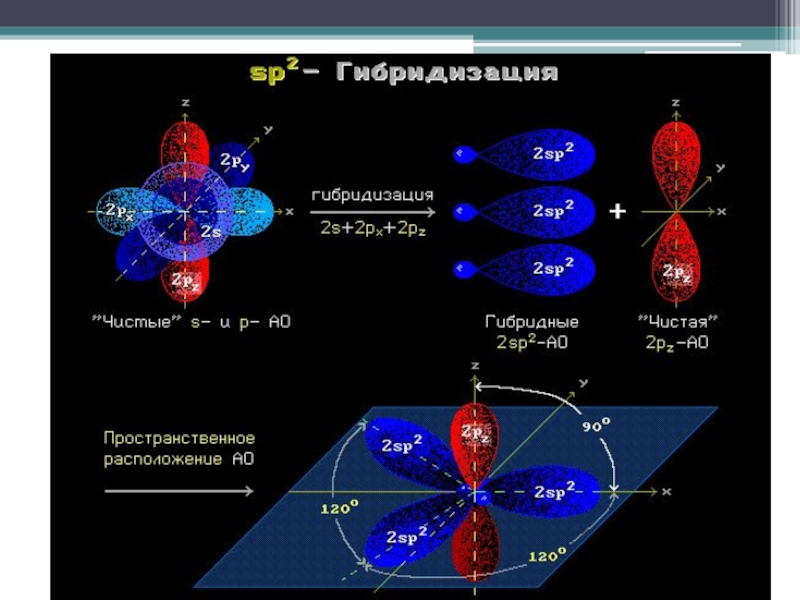
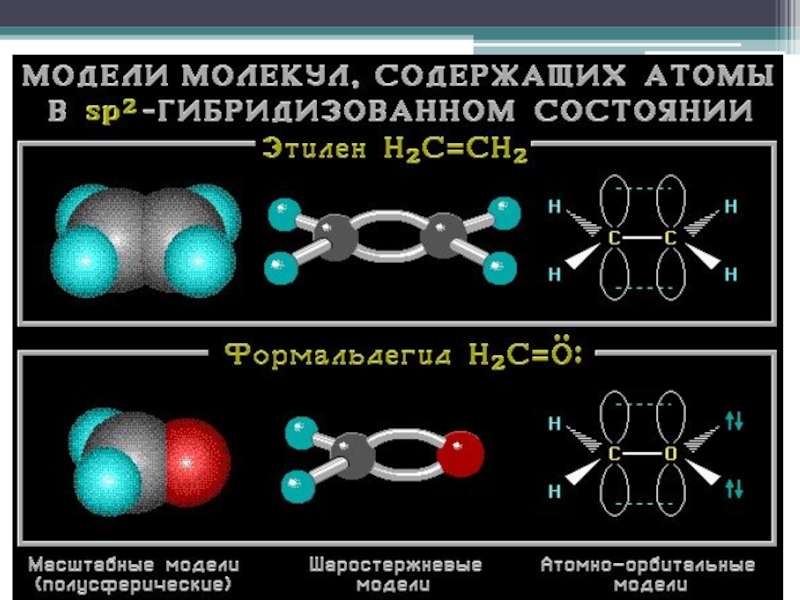
- 12. SP2 - гибридизация
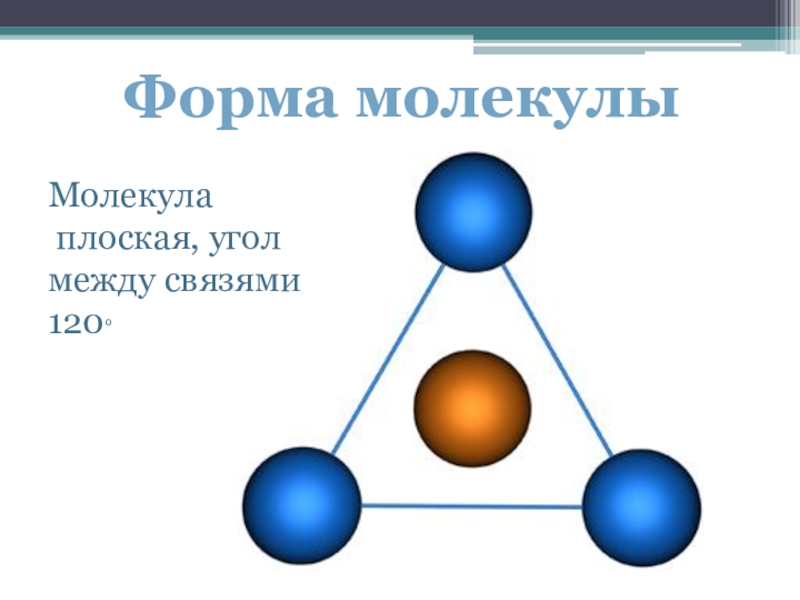
- 13. Форма молекулыМолекула плоская, угол между связями 120°
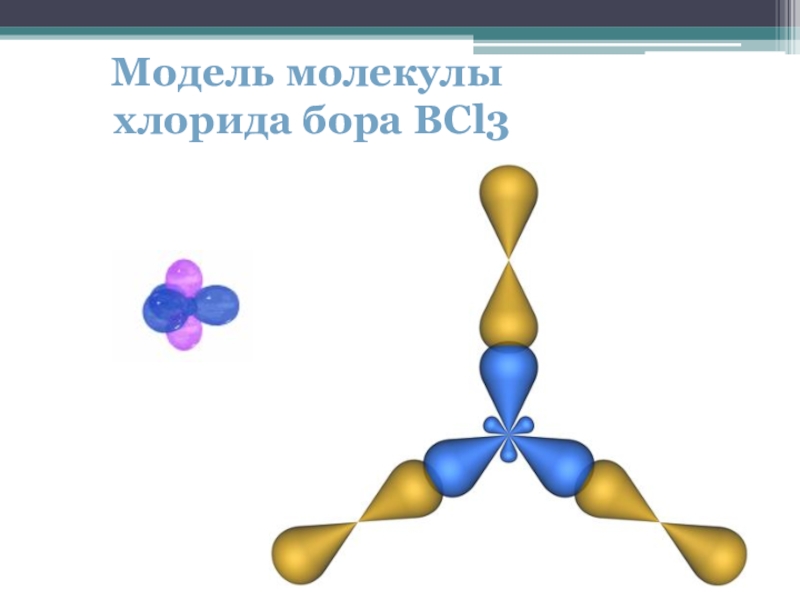
- 14. Модель молекулы хлорида бора BCl3
- 15. Слайд 15
- 16. Слайд 16
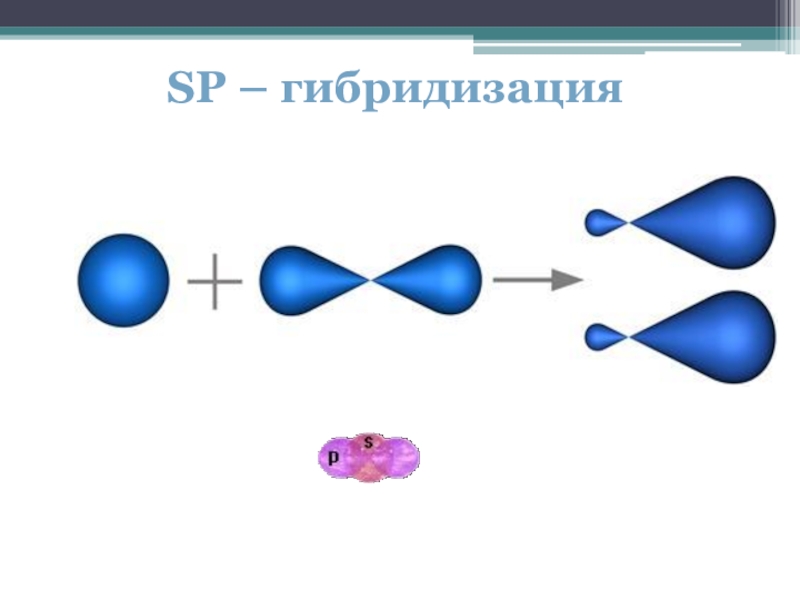
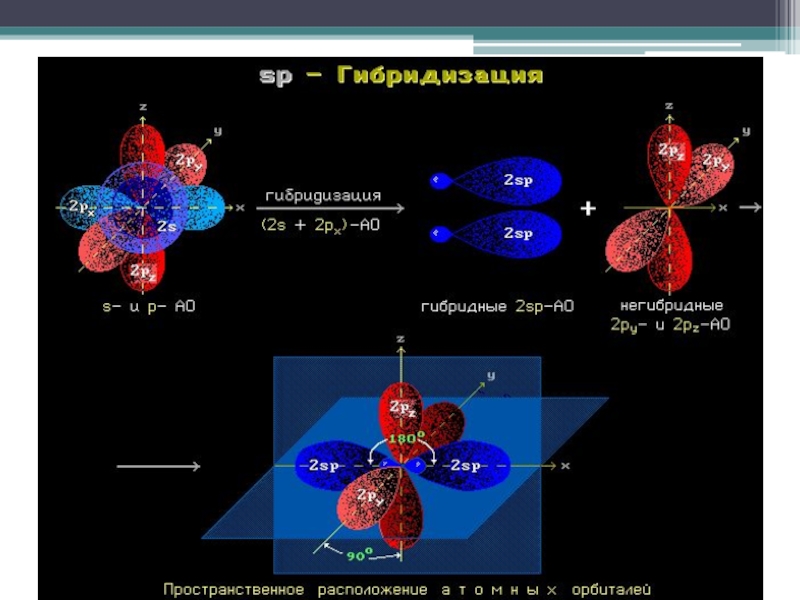
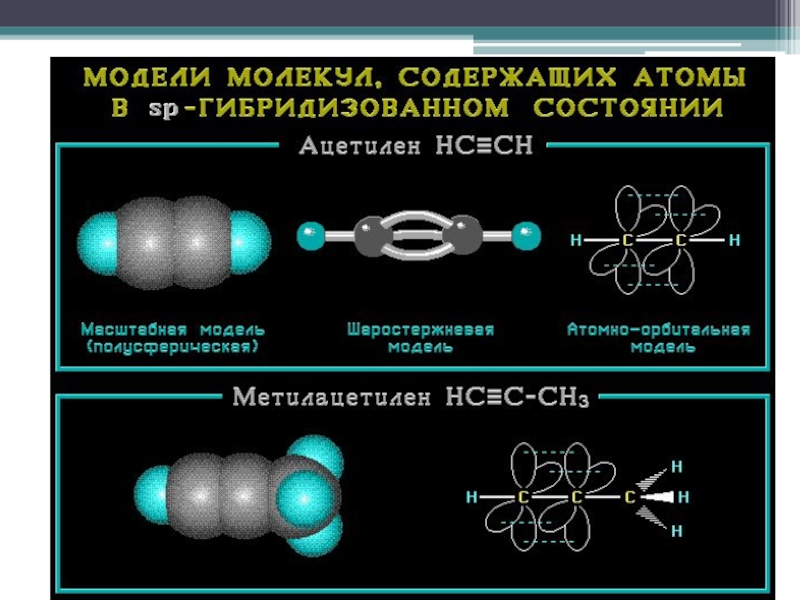
- 17. SP – гибридизация
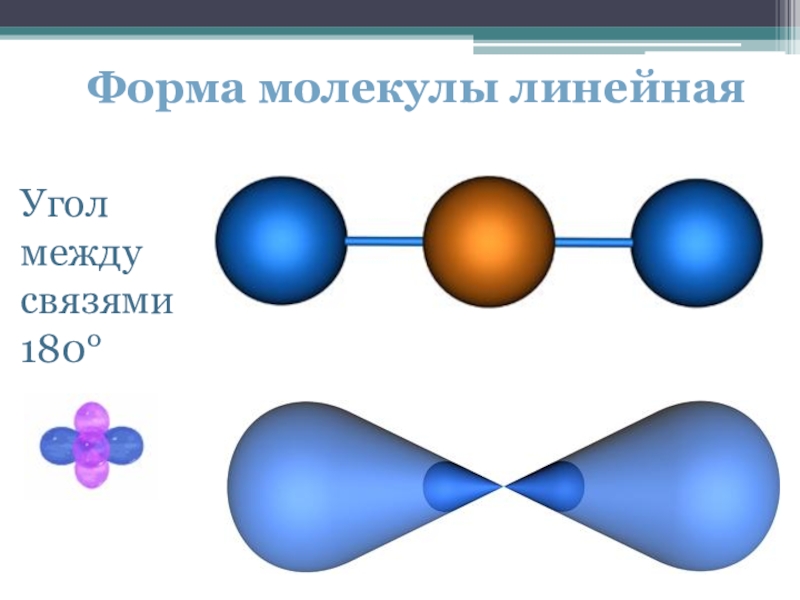
- 18. Форма молекулы линейнаяУгол между связями 180°
- 19. Слайд 19
- 20. Слайд 20
- 21. Что же мы сегодня узнали?Какие сведения мы
- 22. Источники ресурсов:http://www.chemistry.ssu.samara.ru/chem1/index1.htmhttp://hybridation.ru/default.htm
Слайд 1Углерод: строение атома,
валентные состояния,
гибридизация электронных облаков
Презентация к уроку
химии в
Автор: Коровин С.И.
учитель химии.
п. Чёбаково 2011 г.
Слайд 21.1. Углерод
Символ С, элемент IVA группы 2-го периода Периодической системы элементов; атомный номер
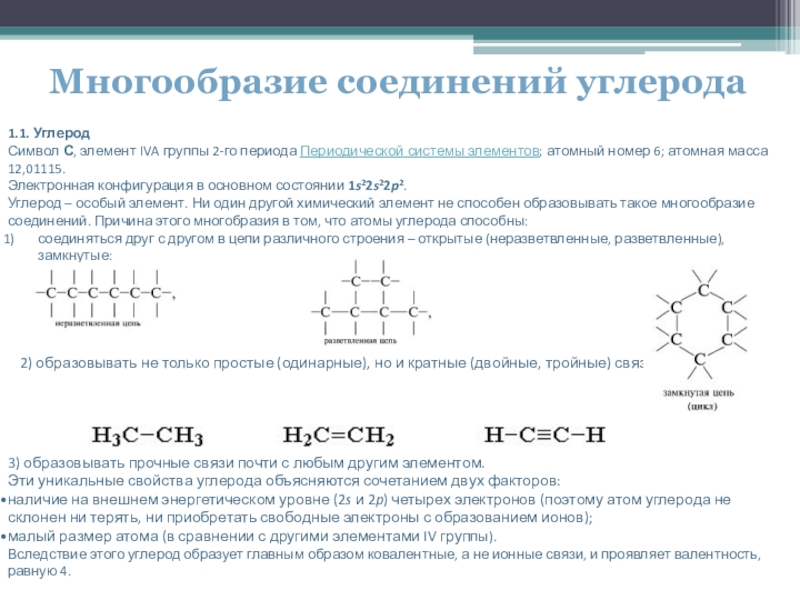
соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
Многообразие соединений углерода
Слайд 21Что же мы сегодня узнали?
Какие сведения мы получаем об атоме углерода
Имея заряд ядра +6, атом углерода в своей электронной оболочке имеет 6 электронов, расположенных в двух энергетических уровнях. 1s²2s²2p².
Каким образом имея на втором энергетическом уровне 2 не спаренных электрона атом углерода образует 4 ковалентных связи?
Поглощая «порцию» энергии один из s-электронов 2-го слоя превращается в p-электрон. Не спаренных электронов становится 4.
Внешний электронный слой атома содержит разные электроны (s и p), все же 4 связи атома углерода одинаковы. Устраните противоречие.
Указанные электроны вступают во взаимодействие – гибридизацию, в результате чего образуется 4, 3 или 2 одинаковых гибридизованных электронных облака. Они способны образовывать одинаковые связи.
Сравните SP³-, SP²- и SP – гибридизации.
В sp³- гибридизации принимают участие 1 s- и 3 p- электрона, в sp²- гибридизации участвуют 1s- и 2p-электрона, 1 p-электрон остаётся без изменений. В sp- гибридизации участвуют по одному s- и p- электрону и 2 p- электрона не изменяются.