все разные
Э2 ; Эn; Me- простые
Сложные:
Оксиды; кислоты; основания; соли
ЭO2; HnЭOm ; Me(OH)n MenЭOm
Me2 O
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Типы химических реакций
Содержание
- 1. Презентация по химии на тему Типы химических реакций
- 2. Типы химических реакцийРеакция соединения:Живут поодиночке ,живут в
- 3. Типы химических реакцийРеакция замещенияПростое вещество - один
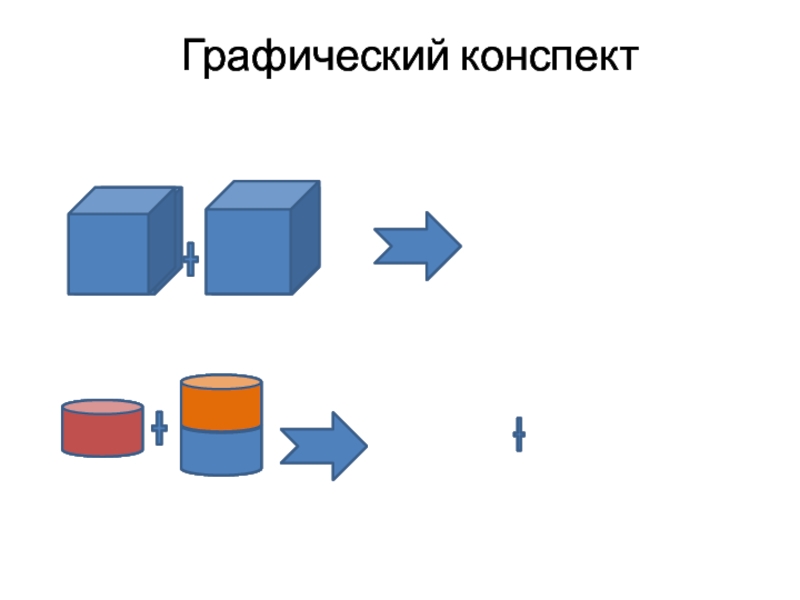
- 4. Графический конспект
- 5. Графический конспект
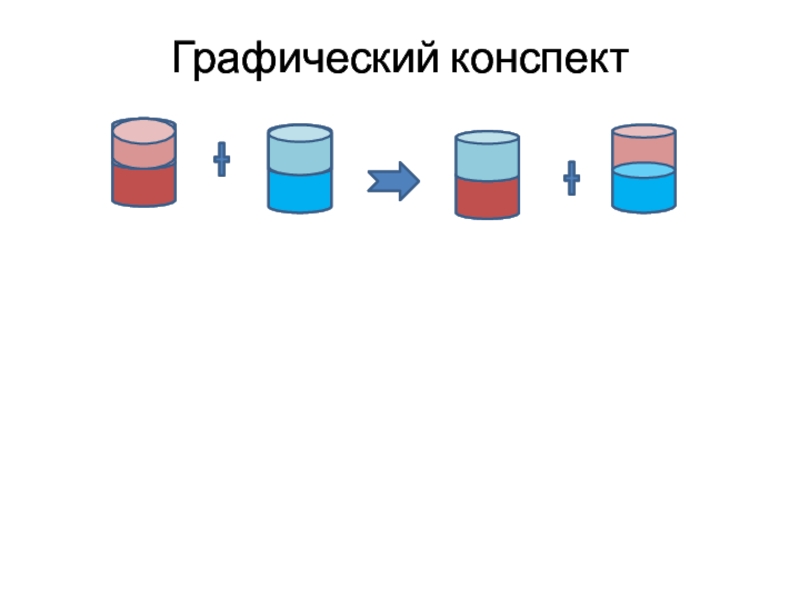
- 6. Графический конспект
- 7. Типы химических реакций Реакции разложенияА вот- сложное
- 8. Найти реакции соединения и замещения1.CuO + Fe
- 9. Типы химических реакцийРеакция обменаЕсли встречаются два сложных
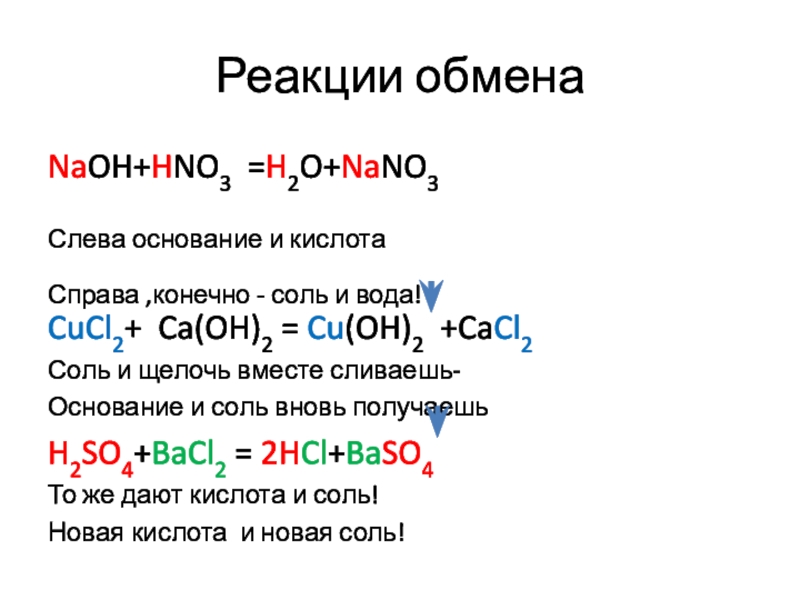
- 10. Реакции обменаNaOH+HNO3 =H2O+NaNO3Слева основание и кислотаСправа ,конечно
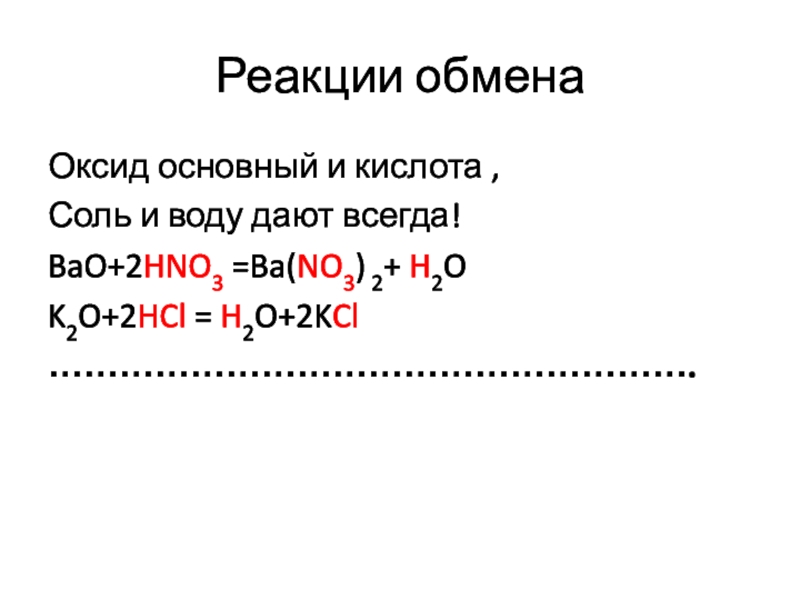
- 11. Реакции обменаОксид основный и кислота ,Соль и воду дают всегда!BaO+2HNO3 =Ba(NO3) 2+ H2OK2O+2HCl = H2O+2KCl……………………………………………….
- 12. Найти реакции обмена и разложения1.2KMnO4
Типы химических реакцийРеакция соединения:Живут поодиночке ,живут в уединении.Заскучали –объединилисьРеакция соединения!Было несколько -стало –одно,Между ними плюсы, после них - «равно»Соединяться могут простые вещества,Могут –оксиды , если их два!
Слайд 1Типы химических реакций
Вещества бывают очень разнообразные.
Металлы и неметаллы- простые!
Сложных много –они
Слайд 2Типы химических реакций
Реакция соединения:
Живут поодиночке ,живут в уединении.
Заскучали –объединились
Реакция соединения!
Было несколько
-стало –одно,
Между ними плюсы, после них - «равно»
Соединяться могут простые вещества,
Могут –оксиды , если их два!
Между ними плюсы, после них - «равно»
Соединяться могут простые вещества,
Могут –оксиды , если их два!
Слайд 3Типы химических реакций
Реакция замещения
Простое вещество - один элемент.
Постоянного места у элемента
нет.
Вещество очень долго живет одно,
Пока не заметит сложное вещество
К сложному подбирается,
Первого толкает и его место
Благополучно за – нимает.
Образовалось два новых вещества
Реакция замещения произошла.
Вещество очень долго живет одно,
Пока не заметит сложное вещество
К сложному подбирается,
Первого толкает и его место
Благополучно за – нимает.
Образовалось два новых вещества
Реакция замещения произошла.
Слайд 7Типы химических реакций
Реакции разложения
А вот- сложное вещество.
- KMnO4
От нескольких элементов произошло- K; Mn; O
Могут жить вместе много лет.
Пока необходимой температуры нет.
Как только температура повышается, O2 MnO2
Сложное вещество немедленно –разлагается.
Было одно- из нескольких элементов, - KMnO4 KMnO4
Стало несколько и в каждом меньше компонентов.
Такие реакции ,без сомненья, K2MnO4
Называют реакциями разложения
От нескольких элементов произошло- K; Mn; O
Могут жить вместе много лет.
Пока необходимой температуры нет.
Как только температура повышается, O2 MnO2
Сложное вещество немедленно –разлагается.
Было одно- из нескольких элементов, - KMnO4 KMnO4
Стало несколько и в каждом меньше компонентов.
Такие реакции ,без сомненья, K2MnO4
Называют реакциями разложения
Слайд 8Найти реакции соединения и замещения
1.CuO + Fe = FeO + Cu
2.
Fe + S = FeS
3. 2SO3 = 2SO2 + O2
4.CuCl2 + Fe = Cu + FeCl2
5. CuO + 2HCl = CuCl2 + H2O
1., 4.- реакции замещения
2.- реакция соединения
3. 2SO3 = 2SO2 + O2
4.CuCl2 + Fe = Cu + FeCl2
5. CuO + 2HCl = CuCl2 + H2O
1., 4.- реакции замещения
2.- реакция соединения
Слайд 9Типы химических реакций
Реакция обмена
Если встречаются два сложных вещества,
Обмен между ними возможен…
(не всегда)!
Если сумма элементов не меньше трех,
Два новых , сложных вещества найдешь.
Первые элементы обменялись местами.
Ну ,а в продуктах разбирайтесь сами!
Если сумма элементов не меньше трех,
Два новых , сложных вещества найдешь.
Первые элементы обменялись местами.
Ну ,а в продуктах разбирайтесь сами!
Слайд 10Реакции обмена
NaOH+HNO3 =H2O+NaNO3
Слева основание и кислота
Справа ,конечно - соль и вода!
CuCl2+
Ca(OH)2 = Cu(OH)2 +CaCl2
Соль и щелочь вместе сливаешь-
Основание и соль вновь получаешь
H2SO4+BaCl2 = 2HCl+BaSO4
То же дают кислота и соль!
Новая кислота и новая соль!
Соль и щелочь вместе сливаешь-
Основание и соль вновь получаешь
H2SO4+BaCl2 = 2HCl+BaSO4
То же дают кислота и соль!
Новая кислота и новая соль!
Слайд 11Реакции обмена
Оксид основный и кислота ,
Соль и воду дают всегда!
BaO+2HNO3 =Ba(NO3)
2+ H2O
K2O+2HCl = H2O+2KCl
……………………………………………….
K2O+2HCl = H2O+2KCl
……………………………………………….
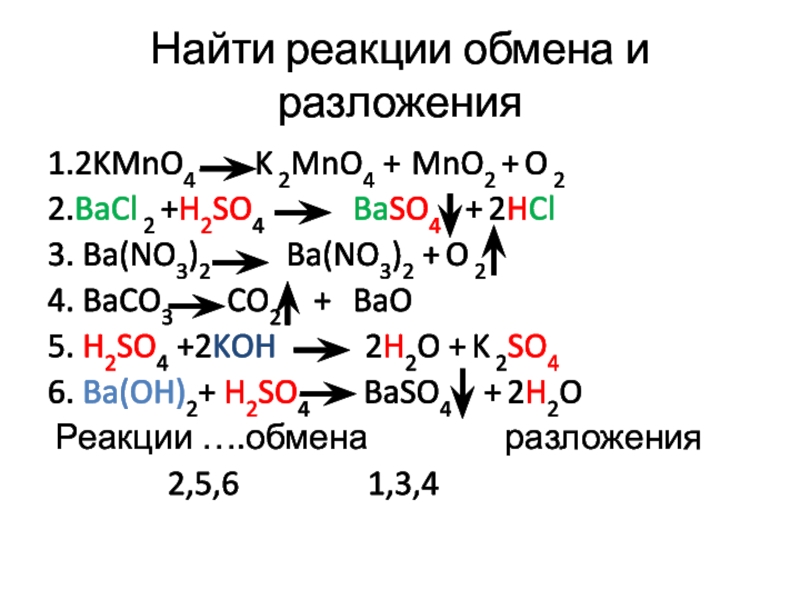
Слайд 12Найти реакции обмена и разложения
1.2KMnO4 K
2MnO4 + MnO2 + O 2
2.BaCl 2 +H2SO4 BaSO4 + 2HCl
3. Ba(NO3)2 Ba(NO3)2 + O 2
4. BaCO3 CO2 + BaO
5. H2SO4 +2KOH 2H2O + K 2SO4
6. Ba(OH)2+ H2SO4 BaSO4 + 2H2O
Реакции ….обмена разложения
2,5,6 1,3,4
2.BaCl 2 +H2SO4 BaSO4 + 2HCl
3. Ba(NO3)2 Ba(NO3)2 + O 2
4. BaCO3 CO2 + BaO
5. H2SO4 +2KOH 2H2O + K 2SO4
6. Ba(OH)2+ H2SO4 BaSO4 + 2H2O
Реакции ….обмена разложения
2,5,6 1,3,4