- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Типы химических реакций. Реакции разложения.
Содержание
- 1. Презентация по химии на тему Типы химических реакций. Реакции разложения.
- 2. ЦЕЛЬ УРОКА:
- 3. Лист самоконтроля
- 4. Критерии отметок0-9 баллов – «Старайся!»10-19 баллов – «Молодец!!»20 баллов и больше – «Умница!!!»
- 5. Химический ребус 1) обведите буквы, которые
- 6. В-1 Химический ребус В-2 Р.
- 7. Проверка В-1. Зашифрованное слово « реакция »
- 8. Признаки классификации химических реакций Выделение и поглощение
- 9. Оксид ртути = ртуть + кислород (двухатомная
- 10. Разложение перекиси водорода Катализаторы- это вещества,
- 11. Биологические катализаторы белковой природы называются ФЕРМЕНТАМИ (каталаза).
- 12. Разложение перекиси водорода.Н2 O2 = вода + кислород (двухатомная молекула).
- 13. Карбонат кальция = оксид кальция + углекислый газ (оксид углерода (IV).Разложение карбоната кальция CaCO3
- 14. Разложение дихромата аммония. (NH4)2 Cr2O7 = азот( двухатомная молекула) + оксид хрома(III) + вода.
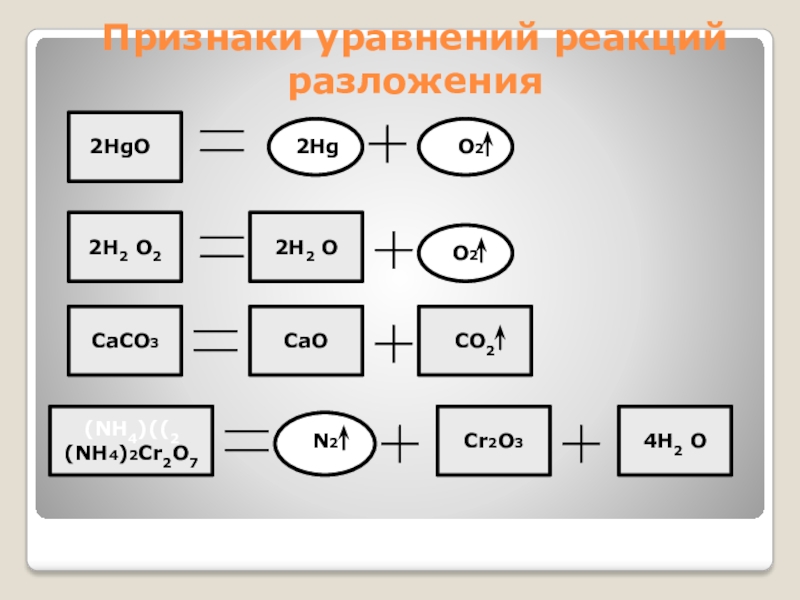
- 15. Признаки уравнений реакций разложения2HgO2HgO22Н2 O2 2Н2 O О2CaCO3CaOCO2(NH4)((2 (NH4)2Cr2O7Cr2O34Н2 O N2
- 16. Реакции разложения. Реакции, в результате которых
- 17. Вычеркните лишние реакции: 1)
- 18. Разложение гидроксида железа(III) Fe(OH)3. Гидроксид железа (III)
- 19. Домашнее задание:§29 «3»- № 3 (устно), стр.155;-«4»-
- 20. Успеха вам в изучении химии!
Слайд 1Типы химических реакций.
Реакции разложения.
Девиз урока: Природа, по-видимому, любит превращения.
Слайд 4Критерии отметок
0-9 баллов – «Старайся!»
10-19 баллов – «Молодец!!»
20 баллов и
Слайд 5Химический ребус
1) обведите буквы, которые соответствуют названию явления, указанного
2) из букв, соответствующих правильным ответам, вы составите зашифрованное слово ребуса;
3) дополнительное задание: расставить коэффициенты в схемах.
Слайд 6В-1 Химический ребус В-2
Р. Кипение воды.
Е. Образование на деревьях инея. А. Таяние льда. Х. Горение бенгальских огней. К. Плавление свечи.
Ц. Образование тумана.
У. Ржавление гвоздя.
И. Испарение воды.
Г. Фотосинтез.
Я. Приготовление сахарной пудры из сахара.
Я. Скисание молока.
В. Гниение мяса.
А. Испарение воды.
Л. Горение древесины.
М. Замерзание воды.
Е. Гниение растений.
Н. Горение свечи.
П. Испарение жидкой ртути.
И. Ржавление гвоздя.
Я. Горение бензина.
Слайд 7Проверка
В-1.
Зашифрованное слово « реакция » - 7 баллов.
4Р +
В-2.
Зашифрованное слово «явления» - 7 баллов.
4 Al +3 О2 = 2 Al2О3 - 2 балла.
Слайд 8Признаки классификации химических реакций
Выделение и поглощение теплоты (+Q ;–Q).
Слайд 9Оксид ртути = ртуть + кислород (двухатомная молекула).
Опыт Дж. Пристли. Разложение оксида ртути.
Слайд 10Разложение перекиси водорода
Катализаторы- это вещества, изменяющие скорость химических реакций,
Слайд 13Карбонат кальция = оксид кальция + углекислый газ (оксид углерода (IV).
Разложение
Слайд 14Разложение дихромата аммония.
(NH4)2 Cr2O7 = азот( двухатомная молекула) + оксид
Слайд 15Признаки уравнений реакций разложения
2HgO
2Hg
O2
2Н2 O2
2Н2 O
О2
CaCO3
CaO
CO2
(NH4)((2 (NH4)2Cr2O7
Cr2O3
4Н2 O
N2
Слайд 16Реакции разложения.
Реакции, в результате которых из одного сложного вещества
АВ А + В
АВС= АВ+ С
Слайд 17Вычеркните лишние реакции:
1) 2 H2O =
2) 2Na+Cl2=2NaCl
3) CaO+H2O =Ca(OH) 2
4) 2KMnO4 = K2 MnO4+ MnO2 + O2
5) 2H2 + O2 = 2 H2O
6) Cu(OH)2=CuO+H2O
Слайд 18Разложение гидроксида железа(III) Fe(OH)3.
Гидроксид железа (III) = оксид железа(III)
1 балл- за формулы;
1 балл- за коэффициенты.
Слайд 19Домашнее задание:
§29
«3»- № 3 (устно), стр.155;
-«4»- упр. № 2 (а-г),
-«5»-упр. № 4 стр.155
( письменно).