Кутина Ольги Евгеньевны
Учителя химии
МБОУ «СШ №11»
г. Смоленск
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Типы химических реакций (8-11 классы)
Содержание
- 1. Презентация по химии на тему Типы химических реакций (8-11 классы)
- 2. Слайд 2
- 3. Слайд 3
- 4. Химических реакций известно в мире многоИ каждая
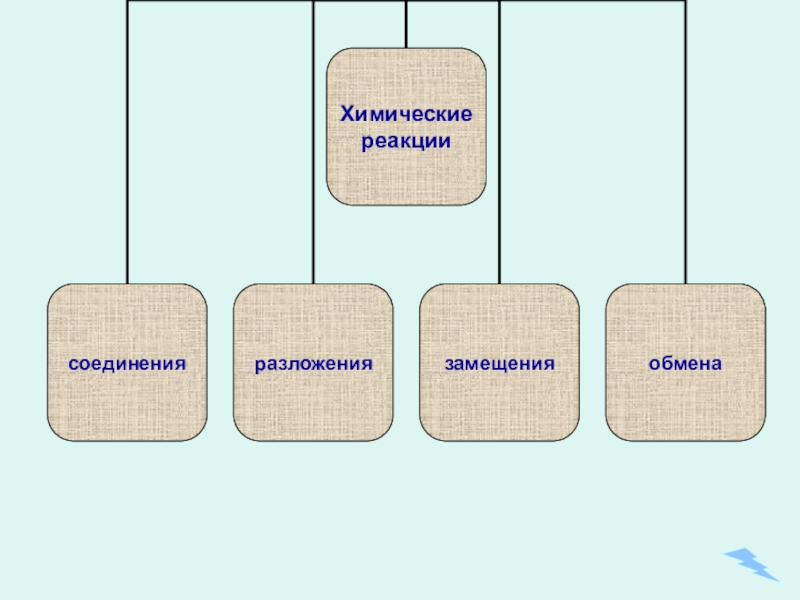
- 5. Типы химических реакций
- 6. Содержание урокаТипы химических реакций: Соединения Разложения Замещения ОбменаУпражнения по темеПроверь себяЛитература
- 7. Девиз урокаЧтобы что-то узнать, нужно уже что-то знать С. Лем
- 8. Цель урока обеспечение усвоения учащимися понятия классификации химических реакций, деления их на типы
- 9. Задачи урока познакомиться с классификацией химических реакций
- 10. Слайд 10
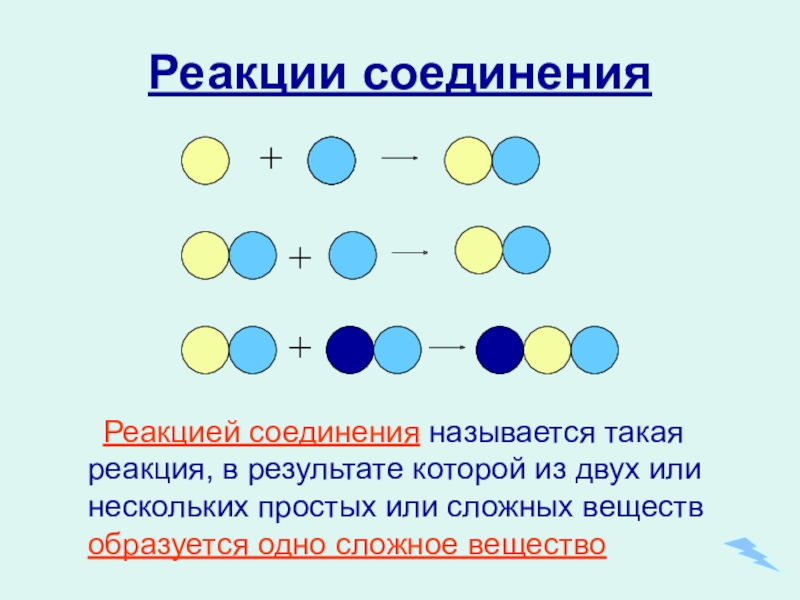
- 11. Реакции соединенияРеакцией соединения называется такая реакция, в
- 12. Металлы (с простыми веществами)ПероксидыNa2O2ОксидыCaOСолиFeSГидридыAlH3Реакциисоединения
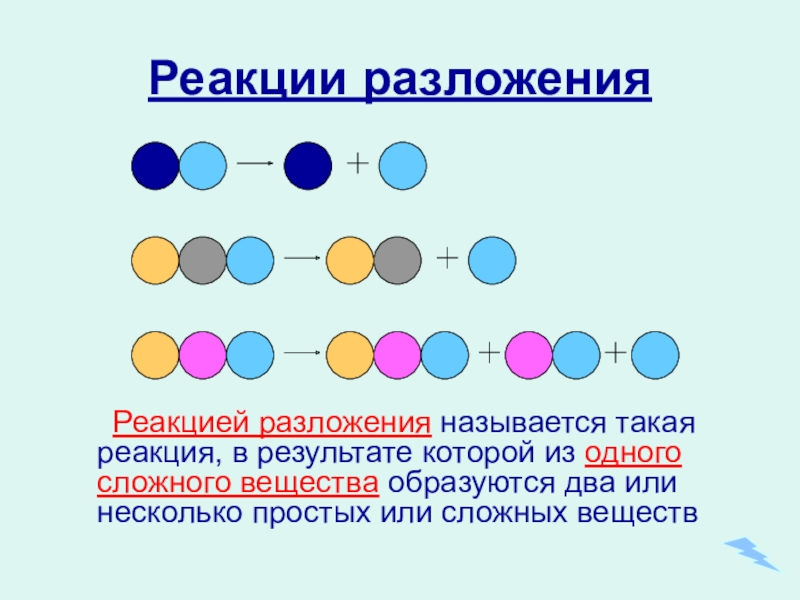
- 13. Реакции разложенияРеакцией разложения называется такая реакция, в
- 14. Реакции замещенияРеакцией замещения называется реакция, протекающая между
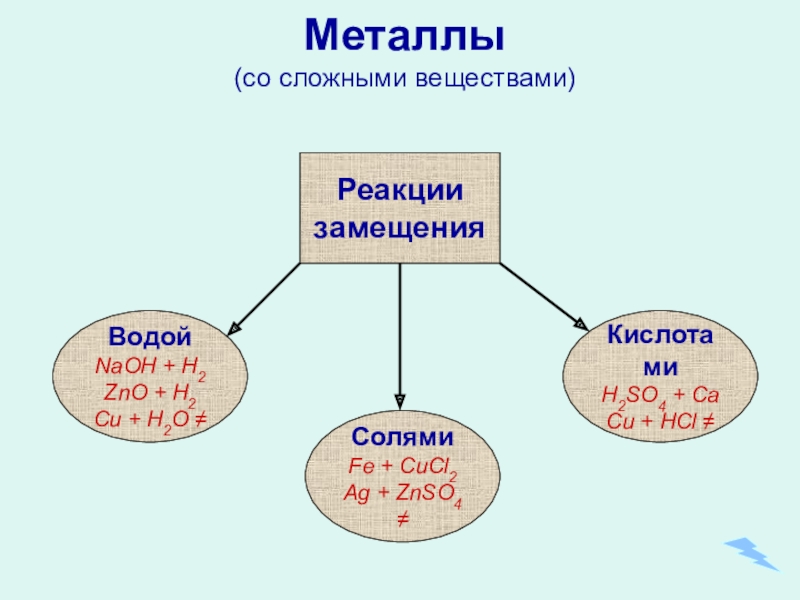
- 15. Металлы (со сложными веществами) СолямиFe
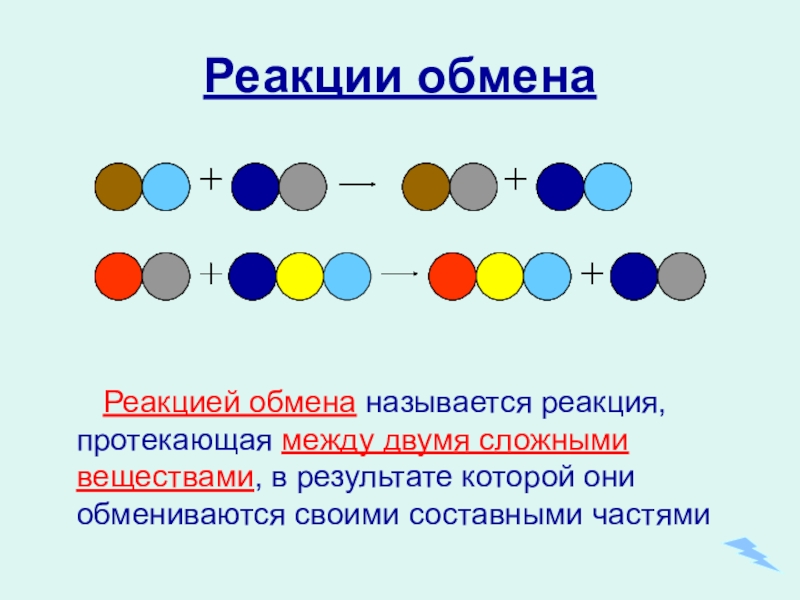
- 16. Реакции обмена Реакцией обмена называется реакция, протекающая
- 17. Реакции ионного обмена-это реакции, протекающие между ионами в водных растворах электролитовИонные уравнения-это уравнения реакций ионного обмена.
- 18. Реакции ионного обмена в растворах электролитов практически
- 19. Запомни!!!Если выделится газ- Это раз;И получится
- 20. Вещество выпадает в осадокмолекулярное уравнениеLi2SO4 + Ba(NO3)2
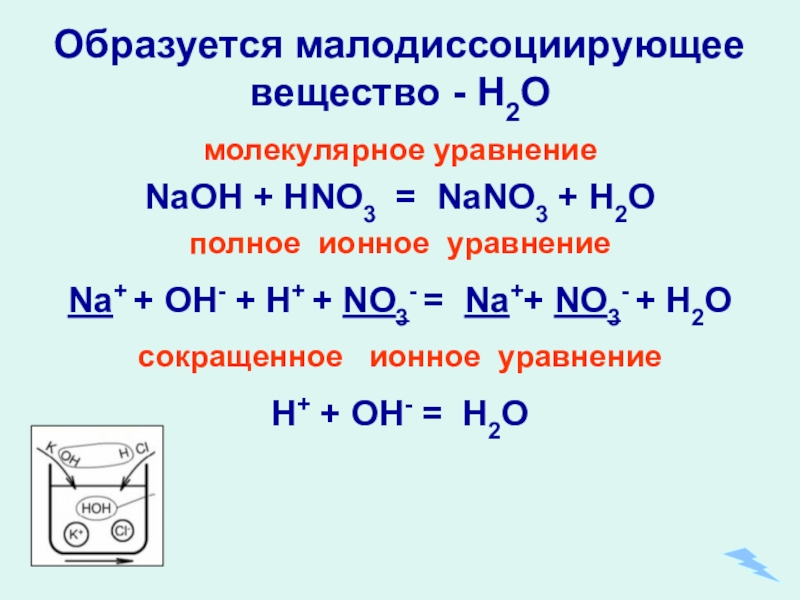
- 21. Образуется малодиссоциирующее вещество - Н2О молекулярное уравнениеNaOH
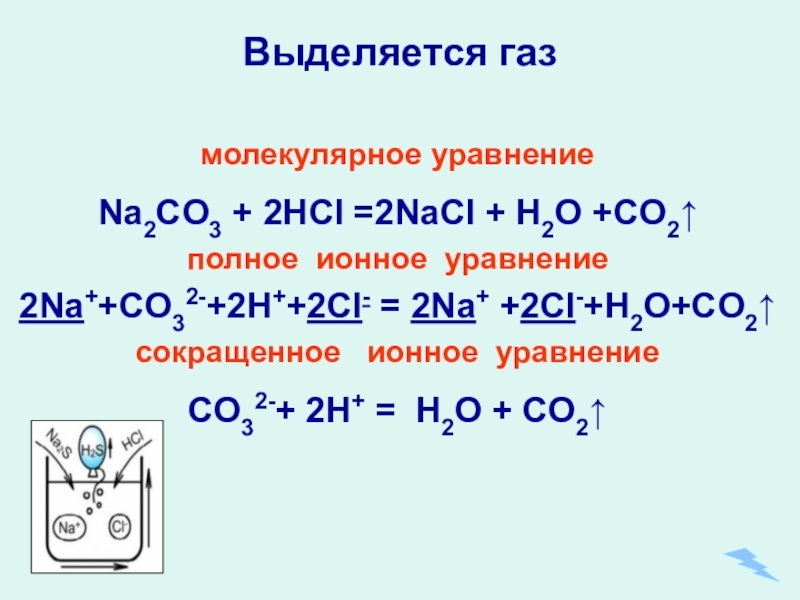
- 22. Выделяется газ молекулярное уравнениеNa2CO3 + 2HCl =2NaCl
- 23. Силу уму придают упражнения
- 24. Упражнения по темеРасставьте коэффициенты в уравнениях реакций
- 25. Проверь себяРасставьте коэффициенты в уравнениях реакций и
- 26. Спасибо за работуВсе, что выучили вы пригодится,И весомее станет стократ
Слайд 1Электронное пособие к урокам химии по теме: «Типы химических реакций» 8
Слайд 2
Все что нас окружает состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. Без химических реакций невозможна жизнь и все многообразие веществ. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром.
Слайд 4
Химических реакций известно в мире много
И каждая в отдельности важна, поверьте
Реакции мы делим на типы очень строго
Какие это типы? Поведаю я Вам.
Слайд 6Содержание урока
Типы химических реакций:
Соединения
Разложения
Замещения
Обмена
Упражнения по теме
Проверь себя
Литература
Слайд 8Цель урока
обеспечение усвоения учащимися понятия классификации химических реакций, деления их
Слайд 9Задачи урока
познакомиться с классификацией химических реакций по исходным веществам
научиться определять тип химической реакции;
развивать умения в написании уравнений химических реакций и расстановке коэффициентов
Слайд 11Реакции соединения
Реакцией соединения называется такая реакция, в результате которой из двух
Слайд 13Реакции разложения
Реакцией разложения называется такая реакция, в результате которой из одного
Слайд 14Реакции замещения
Реакцией замещения называется реакция, протекающая между простым и сложным веществами,
Слайд 15
Металлы
(со сложными веществами)
Солями
Fe + CuCl2
Ag + ZnSO4 ≠
Кислотами
H2SO4 + Ca
Cu
Водой
NaOH + H2
ZnO + H2
Cu + H2O ≠
Реакции
замещения
Слайд 16Реакции обмена
Реакцией обмена называется реакция, протекающая между двумя сложными веществами,
Слайд 17Реакции ионного обмена-
это реакции, протекающие между ионами
в водных растворах электролитов
Ионные
это уравнения реакций ионного обмена
.
Слайд 18Реакции ионного обмена
в растворах электролитов практически необратимо
протекают только в том
образуется осадок ( ↓ )
образуется малодиссоциирующее вещество (например, Н2О)
выделяется газ( ↑ )
Слайд 19Запомни!!!
Если выделится газ-
Это раз;
И получится вода -
Это два;
А
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
Слайд 20Вещество выпадает в осадок
молекулярное уравнение
Li2SO4 + Ba(NO3)2 = BaSO4 ↓ +
полное ионное уравнение
2Li++SO42-+Ba2++2NO3- = BaSO4↓ +Li++2NO3-
сокращенное ионное уравнение
Ba2+ + SO42- = BaSO4 ↓
Слайд 21Образуется малодиссоциирующее вещество - Н2О
молекулярное уравнение
NaOH + HNO3 = NaNO3
полное ионное уравнение
Na+ + OH- + H+ + NO3- = Na++ NO3- + H2O
сокращенное ионное уравнение
H+ + OH- = H2O
Слайд 22Выделяется газ
молекулярное уравнение
Na2CO3 + 2HCl =2NaCl + H2O +CO2↑
полное ионное уравнение
2Na++CO32-+2H++2Cl-
сокращенное ионное уравнение
CO32-+ 2H+ = H2O + CO2↑
Слайд 24Упражнения по теме
Расставьте коэффициенты в уравнениях реакций и укажите их тип
N2
Fe2O3 + H2SO4 = Fe2(SO4)3 + H2O
KCIO3 = KCI + O2
Zn + HCI = ZnCI2 + H2
Слайд 25Проверь себя
Расставьте коэффициенты в уравнениях реакций и укажите их тип
N2 +
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O (обмена)
2KCIO3 = 2KCI + 3O2 (разложения)
Zn + 2HCI = ZnCI2 + H2 (замещения)