- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Типы химических связей
Содержание
- 1. Презентация по химии на тему Типы химических связей
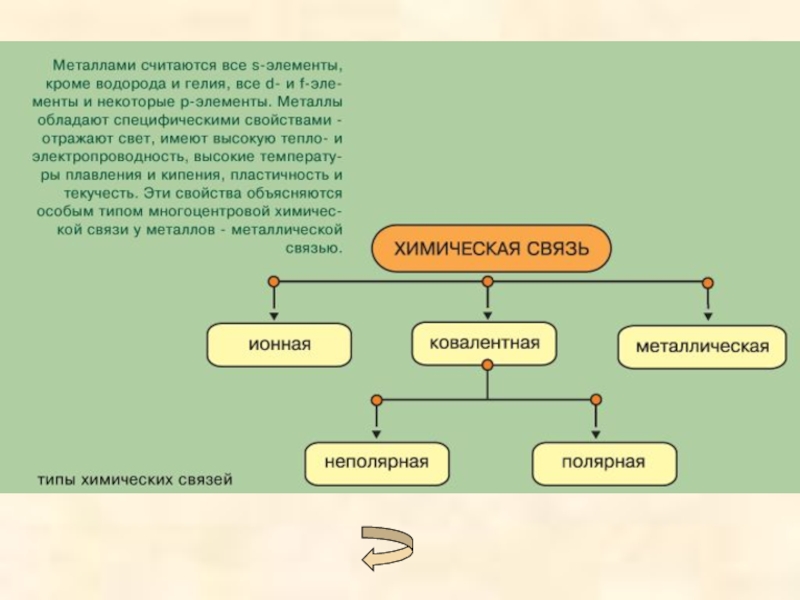
- 2. Природа химической связиХарактеристики связи:ЭнергияДлинаНасыщаемостьНаправленность Виды химических связей:КовалентнаяИоннаяМеталлическаяВодородная
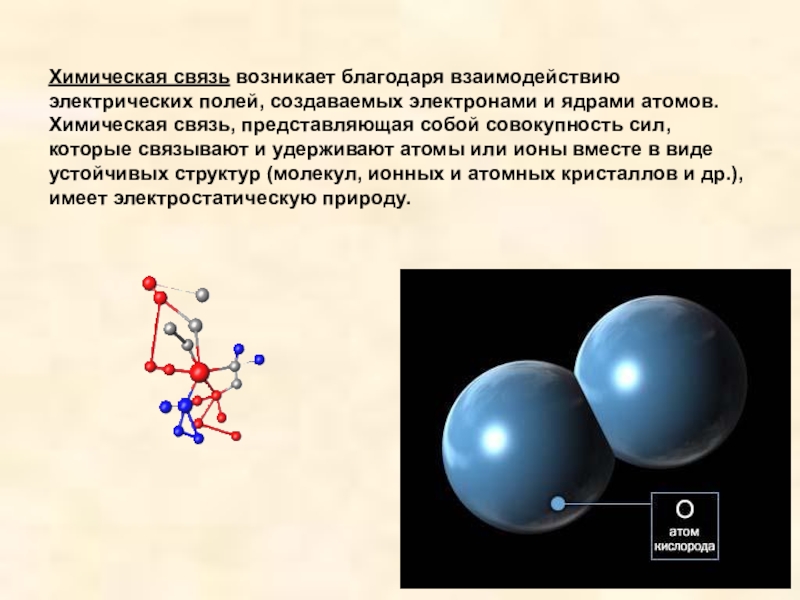
- 3. Химическая связь возникает благодаря взаимодействию электрических полей,
- 4. Слайд 4
- 5. Связь атомов посредством общих электронных пар называется
- 6. Слайд 6
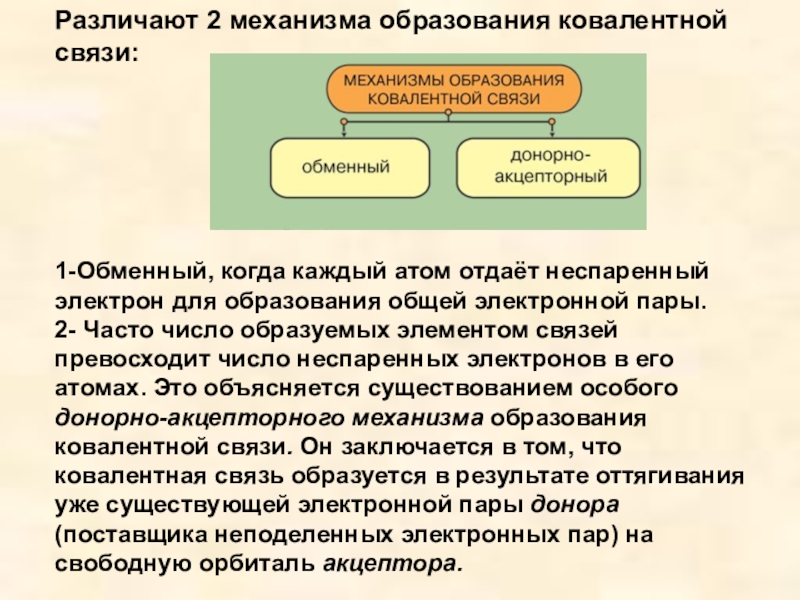
- 7. Различают 2 механизма образования ковалентной связи: 1-Обменный,
- 8. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона
- 9. Слайд 9
- 10. Слайд 10
- 11. Ионной называется химическая связь между заряженными частицами
- 12. Слайд 12
- 13. Слайд 13
- 14. Водородную связь могут образовывать только такие вещества,
- 15. Энергия водородной связи невелика и на порядок
- 16. Водородная связь может быть и внутримолекулярной, особенно
- 17. Металлическая химическая связь образуется в металлах и
- 18. Слайд 18
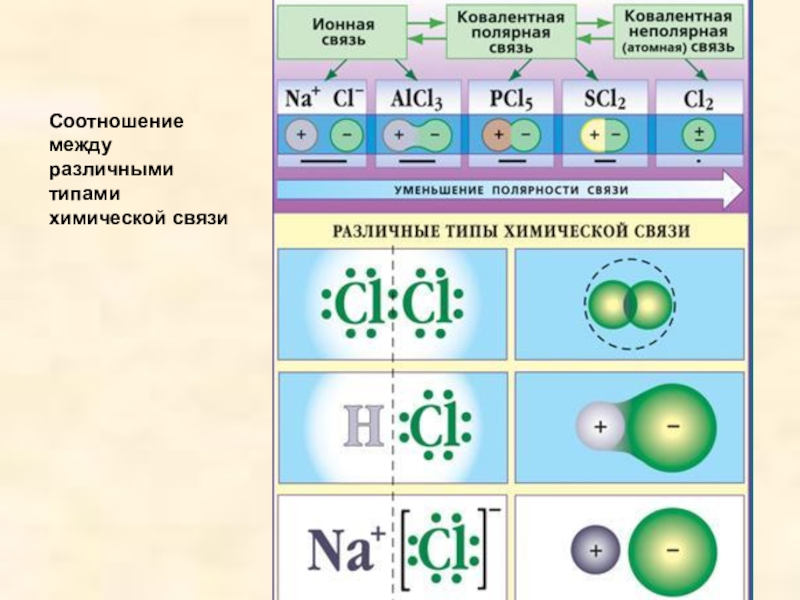
- 19. Соотношение между различными типами химической связи
Природа химической связиХарактеристики связи:ЭнергияДлинаНасыщаемостьНаправленность Виды химических связей:КовалентнаяИоннаяМеталлическаяВодородная
Слайд 2Природа химической связи
Характеристики связи:
Энергия
Длина
Насыщаемость
Направленность
Виды химических связей:
Ковалентная
Ионная
Металлическая
Водородная
Слайд 3Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами
атомов. Химическая связь, представляющая собой совокупность сил, которые связывают и удерживают атомы или ионы вместе в виде устойчивых структур (молекул, ионных и атомных кристаллов и др.), имеет электростатическую природу.
Слайд 5Связь атомов посредством общих электронных пар называется ковалентной связью.
Как считают
в настоящее время, образование общих электронных пар происходит между неспаренными электронами, причем они должны иметь разные спины. Атомы, имеющие неспаренные электроны с параллельными спинами отталкиваются, и химическая связь между ними не возникает.
Различают неполярную и полярную ковалентную связь.
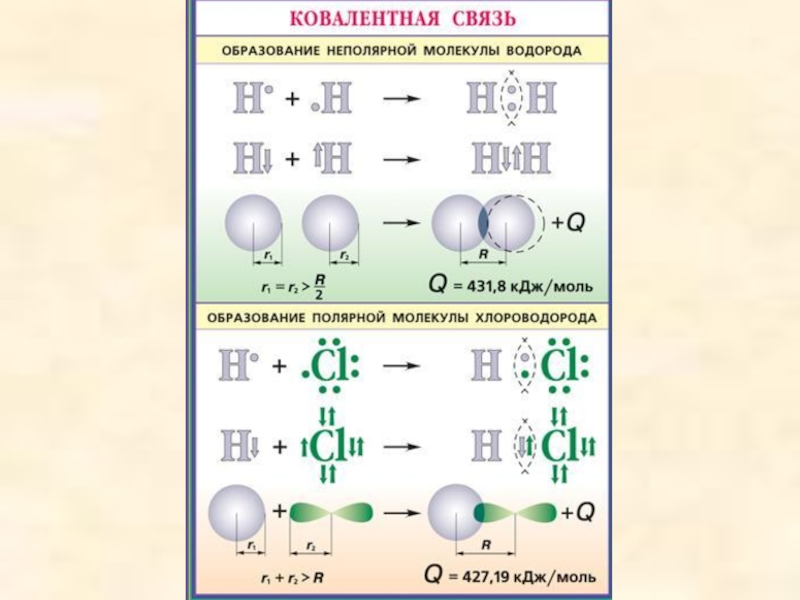
При ковалентной неполярной связи электронное облако распределяется в пространстве на одинаковом расстоянии от ядер атомов. Такая связь возникает между молекулами, состоящими из одинаковых атомов ( например, молекулы водорода, кислорода).
Н-Н О=О Cl-Cl
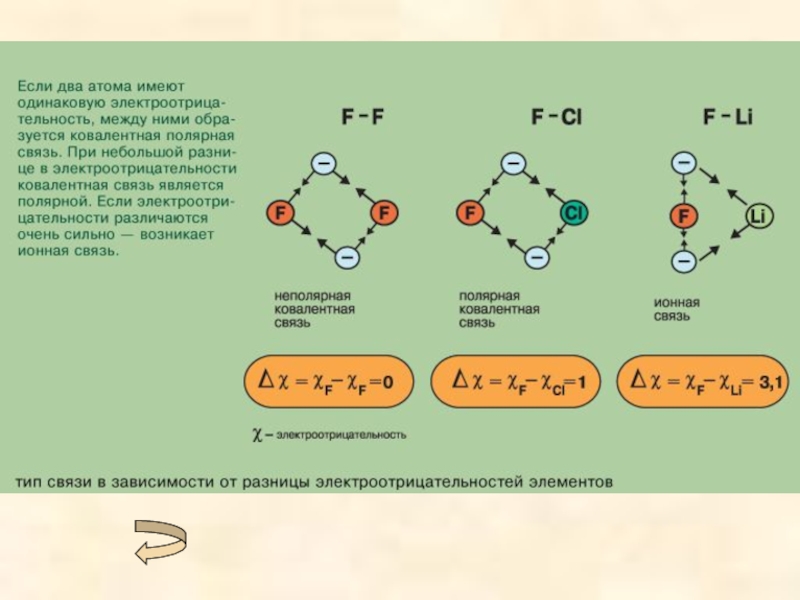
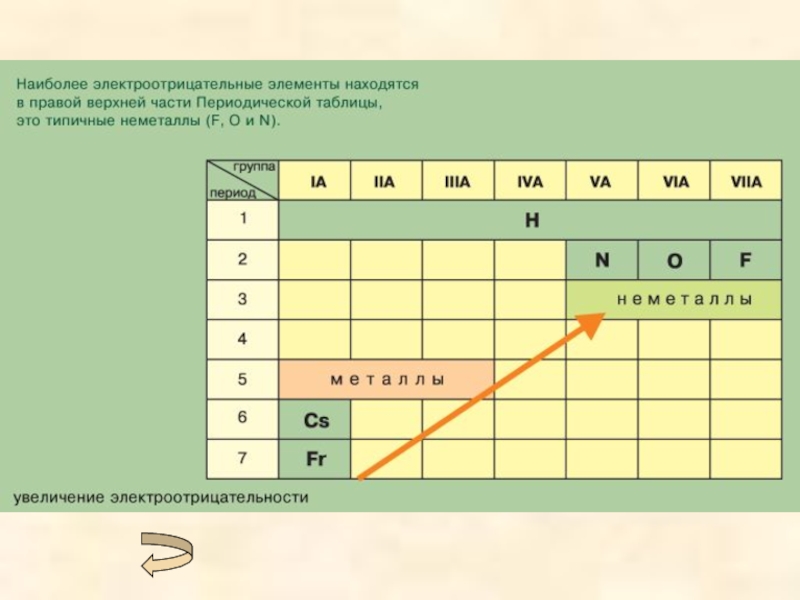
При ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (разница <1,7). (Электроотрицательность - это свойство атомов оттягивать к себе электроны, связывающие их с другими атомами).
H Cl
Различают неполярную и полярную ковалентную связь.
При ковалентной неполярной связи электронное облако распределяется в пространстве на одинаковом расстоянии от ядер атомов. Такая связь возникает между молекулами, состоящими из одинаковых атомов ( например, молекулы водорода, кислорода).
Н-Н О=О Cl-Cl
При ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (разница <1,7). (Электроотрицательность - это свойство атомов оттягивать к себе электроны, связывающие их с другими атомами).
H Cl
Слайд 7Различают 2 механизма образования ковалентной связи:
1-Обменный, когда каждый атом отдаёт
неспаренный электрон для образования общей электронной пары. 2- Часто число образуемых элементом связей превосходит число неспаренных электронов в его атомах. Это объясняется существованием особого донорно-акцепторного механизма образования ковалентной связи. Он заключается в том, что ковалентная связь образуется в результате оттягивания уже существующей электронной пары донора (поставщика неподеленных электронных пар) на свободную орбиталь акцептора.
Слайд 8Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония.
H +
H - N - H
H
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Связи H-N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. возникающие ковалентные связи равноценны. Это обусловлено тем, что орбитали 2s- и 2р-электронов атома азота изменяют свою форму, в результате чего возникают четыре совершенно одинаковые по форме орбитали. Форма этих новых орбиталей представляет из себя нечто среднее между s- и р-орбиталями, поэтому эти новые орбитали называются гибридными, а их возникновение - гибридизацией атомных орбиталей. Число гибридных орбиталей всегда равно числу исходных.
H - N - H
H
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Связи H-N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. возникающие ковалентные связи равноценны. Это обусловлено тем, что орбитали 2s- и 2р-электронов атома азота изменяют свою форму, в результате чего возникают четыре совершенно одинаковые по форме орбитали. Форма этих новых орбиталей представляет из себя нечто среднее между s- и р-орбиталями, поэтому эти новые орбитали называются гибридными, а их возникновение - гибридизацией атомных орбиталей. Число гибридных орбиталей всегда равно числу исходных.
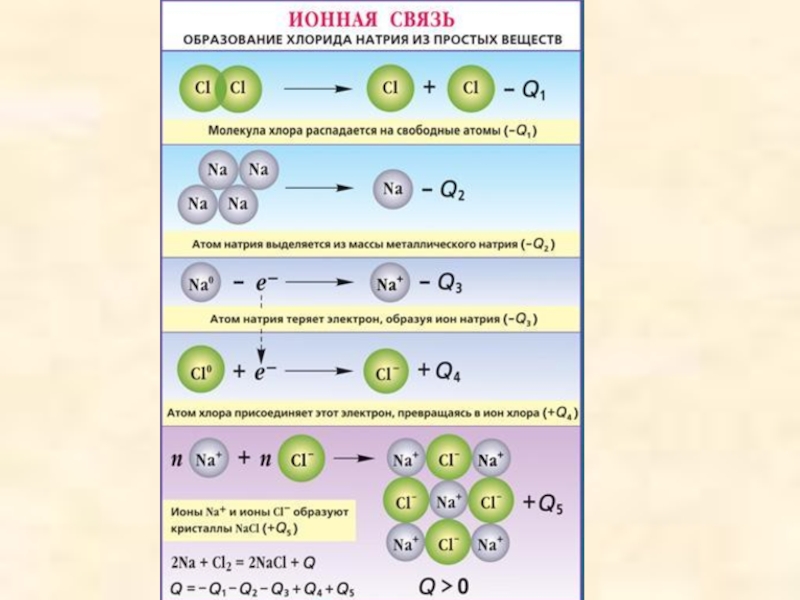
Слайд 11Ионной называется химическая связь между заряженными частицами - ионами, в которые
превращаются атомы в результате отдачи или присоединения электронов. Вещества, образованные из ионов, называются ионными.
Например, хлорид натрия Na+Cl-
Чем больше дипольный момент - тем выше степень ионности связи и реакционная способность молекул. Чем больше разность электроотрицательностей атомов – тем в большей мере электронное облако смещено к атому с большей электроотрицательностью и тем выше степень ионности связи.
Ионная связь образуется только между атомами таких элементов, которые значительно отличаются по своей электроотрицательности (разность >1,7). Однако полного перехода электронов от одних атомов к другим не происходит. Следовательно, полностью ионных соединений не существует. В отличие от ковалентной связи ионная связь не обладает направленностью и насыщенностью.
Например, хлорид натрия Na+Cl-
Чем больше дипольный момент - тем выше степень ионности связи и реакционная способность молекул. Чем больше разность электроотрицательностей атомов – тем в большей мере электронное облако смещено к атому с большей электроотрицательностью и тем выше степень ионности связи.
Ионная связь образуется только между атомами таких элементов, которые значительно отличаются по своей электроотрицательности (разность >1,7). Однако полного перехода электронов от одних атомов к другим не происходит. Следовательно, полностью ионных соединений не существует. В отличие от ковалентной связи ионная связь не обладает направленностью и насыщенностью.
Слайд 14Водородную связь могут образовывать только такие вещества, в молекулах которых атом
водорода связан с электроотрицательными атомами. Объясняется возникновение водородной связи действием электростатических сил.
Рассмотрим водородную связь в молекуле воды. Электроны, образующие связи H-O, смещены к более электроотрицательному атому кислорода. Ядро атома водорода имеет только один электрон, который уже смещен к атому кислорода и атом водорода почти полностью лишается электронной оболочки. Между ним и атомом кислорода соседней молекулы воды возникает некоторое электростатическое притяжение. Это и есть механизм образования водородной связи. Чем больше электрон водорода оттянут к другому атома, тем сильнее протон притягивает электроны атома соседней молекулы.
Рассмотрим водородную связь в молекуле воды. Электроны, образующие связи H-O, смещены к более электроотрицательному атому кислорода. Ядро атома водорода имеет только один электрон, который уже смещен к атому кислорода и атом водорода почти полностью лишается электронной оболочки. Между ним и атомом кислорода соседней молекулы воды возникает некоторое электростатическое притяжение. Это и есть механизм образования водородной связи. Чем больше электрон водорода оттянут к другому атома, тем сильнее протон притягивает электроны атома соседней молекулы.
Н Н Н
/ / /
H − O:δ- ⋅ ⋅ ⋅ Hδ+ − O:δ- ⋅ ⋅ ⋅ Hδ+ −O:
Слайд 15Энергия водородной связи невелика и на порядок меньше энергии ковалентной связи,
что не мешает ей оказывать значительное влияние на физические и химические свойства многих веществ.
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей. Например, у спиртов:
R R R
/ / /
H − O:δ- ⋅ ⋅ ⋅ Hδ+ − O:δ- ⋅ ⋅ ⋅ Hδ+ −O:
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей. Например, у спиртов:
R R R
/ / /
H − O:δ- ⋅ ⋅ ⋅ Hδ+ − O:δ- ⋅ ⋅ ⋅ Hδ+ −O:
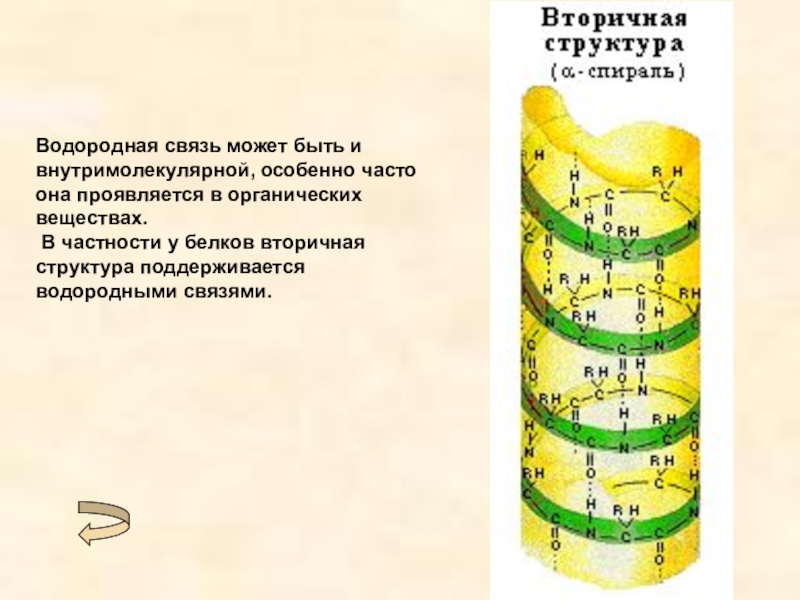
Слайд 16Водородная связь может быть и внутримолекулярной, особенно часто она проявляется в
органических веществах.
В частности у белков вторичная структура поддерживается водородными связями.
В частности у белков вторичная структура поддерживается водородными связями.
Слайд 17Металлическая химическая связь образуется в металлах и сплавах.
Атомы металлов имеют небольшое
число валентных электронов. Они слабо связаны с ядром и могут легко отрываться от него. В результате в узлах кристаллической решетки появляются положительно заряженные ионы, а между ними свободно перемещаются электроны – образуется так называемый “электронный газ”. Вид связи между положительными ионами, осуществляемой за счет притяжения электронов, свободно перемещающихся по кристаллу, называется металлической.