- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Теория электролитической диссоциации
Содержание
- 1. Презентация по химии на тему Теория электролитической диссоциации
- 2. СодержаниеТребование к студентам Требования к студентамУчебная информация:-Электролитическая
- 3. Требования к студентамЗнать - основные понятия;-слабые
- 4. Электролитическая диссоциацияТеория электролитической диссоциации( С. Аррениус, 1887г.
- 5. Механизм электролитической диссоциации При растворении соединений
- 6. Электролиты неэлектролитыЭлектролиты и неэлектролиты Электролитическая диссоциация веществ, идущая
- 7. Электролиты, неэлектролиты (продолжение)Сильные электролитыЭто вещества, которые при
- 8. Электролиты, неэлектролитыСлабые электролитыВещества, частично диссоциирующие на ионы.
- 9. Электролиты, неэлектролитыОни плохо (или почти не проводят)
- 10. Электролиты, неэлектролитыНеэлектролитыВещества, водные растворы и расплавы которых
- 11. Степень диссоциации. Константа диссоциации Концентрация ионов
- 12. Степень диссоциации. Константа диссоциации Концентрации ионов
- 13. Контрольные задания
- 14. Задание. Решить задачуОпределите мольную концентрацию катионов и
- 15. ПроверитьПравильный ответ
- 16. Степень диссоциации зависит от концентрации раствора слабого
- 17. Конец выполнения контрольных заданий
- 18. Термины и определения
- 19. ЛитератураХимия.: учебник для студ.учреждений сред.проф.образования/ О.С. Габриелян,
- 20. Конец работы. Вы действительно хотите закончить работу с информационным учебным материалом темы «Теория электролитической диссоциации»?ДаНет
СодержаниеТребование к студентам Требования к студентамУчебная информация:-Электролитическая диссоциации Электролитическая диссоциация-Механизм электролитической диссоциации Механизм электролитической диссоциации -Электролиты, неэлектролиты Электролиты неэлектролитыСтепень диссоциации. Константа диссоциации Степень диссоциации. Константа диссоциации
Слайд 1Дисциплина «Химия»
Составитель: Сагдиева М.С., преподаватель химии КМК.
Теория электролитической диссоциации
Химия
Слайд 2Содержание
Требование к студентам Требования к студентам
Учебная информация:
-Электролитическая диссоциации Электролитическая диссоциация
-Механизм электролитической
диссоциации Механизм электролитической диссоциации
-Электролиты, неэлектролиты Электролиты неэлектролиты
Степень диссоциации. Константа диссоциации Степень диссоциации. Константа диссоциации
-Электролиты, неэлектролиты Электролиты неэлектролиты
Степень диссоциации. Константа диссоциации Степень диссоциации. Константа диссоциации
Слайд 3Требования к студентам
Знать
- основные понятия;
-слабые электролиты;
-сильные электролиты;
уметь:
Определять мольную концентрацию
катионов и анионов в растворах;
Определять концентрацию недиссоциированных молекул и ионов в растворах.
Определять концентрацию недиссоциированных молекул и ионов в растворах.
Слайд 4Электролитическая диссоциация
Теория электролитической диссоциации
( С. Аррениус, 1887г. )
1. При растворении в воде
(или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
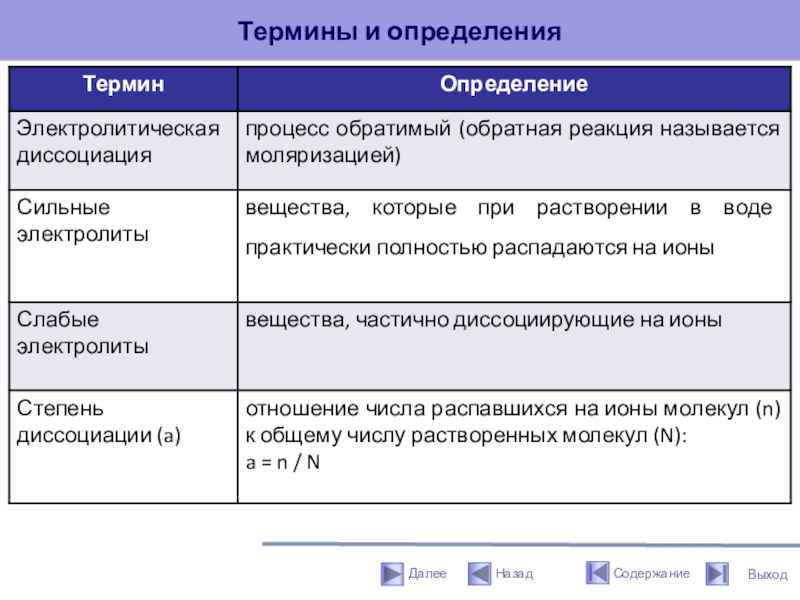
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
a = n / N 0
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
a = n / N 0
Слайд 5Механизм электролитической диссоциации
При растворении соединений с ионными связями (например, NaCl) процесс
гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Слайд 6Электролиты
неэлектролиты
Электролиты и неэлектролиты
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет
электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
CaCl2 Ca2+ + 2Cl-
KAl(SO4)2 K+ + Al3+ + 2SO42-
HNO3 H+ + NO3-
Ba(OH)2 Ba2+ + 2OH-
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
Например, для
Al2(SO4)3 –– 2 • (+3) + 3 • (-2) = +6 - 6 = 0
KCr(SO4)2 –– 1 • (+1) + 3 • (+3) + 2 • (-2) = +1 + 3 - 4 = 0
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
CaCl2 Ca2+ + 2Cl-
KAl(SO4)2 K+ + Al3+ + 2SO42-
HNO3 H+ + NO3-
Ba(OH)2 Ba2+ + 2OH-
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
Например, для
Al2(SO4)3 –– 2 • (+3) + 3 • (-2) = +6 - 6 = 0
KCr(SO4)2 –– 1 • (+1) + 3 • (+3) + 2 • (-2) = +1 + 3 - 4 = 0
Слайд 7Электролиты, неэлектролиты (продолжение)
Сильные электролиты
Это вещества, которые при растворении в воде практически
полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слайд 8Электролиты, неэлектролиты
Слабые электролиты
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду
с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4) вода.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4) вода.
Слайд 9Электролиты, неэлектролиты
Они плохо (или почти не проводят) электрический ток.
СH3COOH CH3COO- + H+
Cu(OH)2
[CuOH]+ + OH- (первая ступень)
[CuOH]+ Cu2+ + OH- (вторая ступень)
H2CO3 + + HCO- (первая ступень)
HCO3- H+ + CO32- (вторая ступень)
[CuOH]+ Cu2+ + OH- (вторая ступень)
H2CO3 + + HCO- (первая ступень)
HCO3- H+ + CO32- (вторая ступень)
Слайд 10Электролиты, неэлектролиты
Неэлектролиты
Вещества, водные растворы и расплавы которых не проводят электрический ток.
Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Слайд 11
Степень диссоциации. Константа диссоциации
Концентрация ионов в растворах зависит от того, насколько
полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам), например:
Слайд 12
Степень диссоциации. Константа диссоциации
Концентрации ионов в растворах слабых электролитов качественно характеризуют
степенью и константой диссоциации.
Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
a = n / N
и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
a = n / N
и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Слайд 14Задание. Решить задачу
Определите мольную концентрацию катионов и анионов в 0,01 М
растворах KBr, NH4OH, Ba(OH)2, H2SO4 и CH3COOH.
Степень диссоциации слабых электролитов a = 0,3.
Объясните полученный ответ
Степень диссоциации слабых электролитов a = 0,3.
Объясните полученный ответ
Слайд 16Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой
степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации a и исходную концентрацию вещества c в растворе.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации a и исходную концентрацию вещества c в растворе.
Слайд 19
Литература
Химия.: учебник для студ.учреждений сред.проф.образования/ О.С. Габриелян, И.Г. Остроумов. – 12-е
изд., стер. – М.: Издательский центр «Академия», 2014. – 336 с., (16) л.цв.ил.
Дополнительная литература:
Травень В.Ф. органическая химия. Учебник для вузов. –М.: Академкнига, 2010г.
Дополнительная литература:
Травень В.Ф. органическая химия. Учебник для вузов. –М.: Академкнига, 2010г.
Слайд 20Конец работы. Вы действительно хотите закончить работу с информационным учебным материалом темы
«Теория электролитической диссоциации»?
Да
Нет








![Презентация по химии на тему Теория электролитической диссоциации Электролиты, неэлектролитыОни плохо (или почти не проводят) электрический ток.СH3COOH CH3COO- + H+Cu(OH)2 Электролиты, неэлектролитыОни плохо (или почти не проводят) электрический ток.СH3COOH CH3COO- + H+Cu(OH)2 [CuOH]+ + OH- (первая ступень)[CuOH]+ Cu2+ + OH- (вторая ступень)H2CO3 + + HCO- (первая](/img/thumbs/991351bdaebd691b2e1da392d555eb98-800x.jpg)