- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему ТЭД. Растворы электролитов (11 класс)
Содержание
- 1. Презентация по химии на тему ТЭД. Растворы электролитов (11 класс)
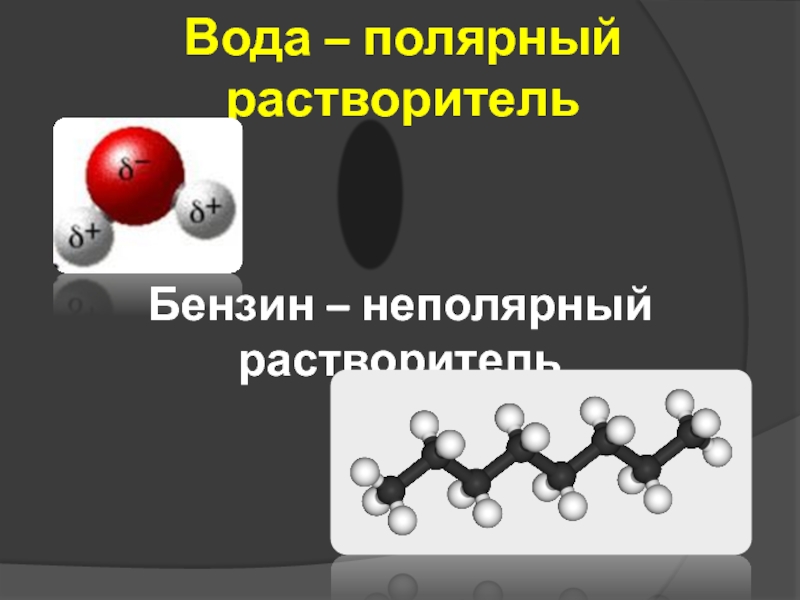
- 2. Вода – полярный растворитель Бензин – неполярный растворитель «диполь»
- 3. Типы химической связиКОВАЛЕНТНАЯПОЛЯРНАЯНЕПОЛЯРНАЯHCl, H2O …O2 , H2 , N2 …ИОННАЯNaCl, KBr …
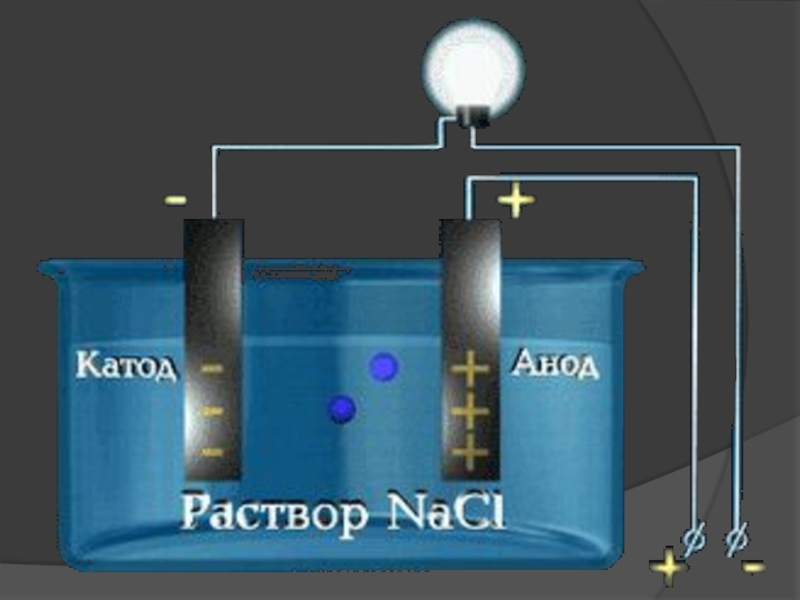
- 4. Электропроводность веществ:213
- 5. КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИВЕЩЕСТВАЭЛЕКТРОЛИТЫНЕЭЛЕКТРОЛИТЫРастворы кислот, щелочей,
- 6. Слайд 6
- 7. Сванте Август Аррениус (1859-1927)Шведский ученый, академик. В
- 8. Электролитическая диссоциация – процесс распада электролита на
- 9. Ива́н Алексе́евич Каблуко́в (1857-1942)Влади́мир Алекса́ндрович Кистяко́вский (1865-1952)
- 10. Слайд 10
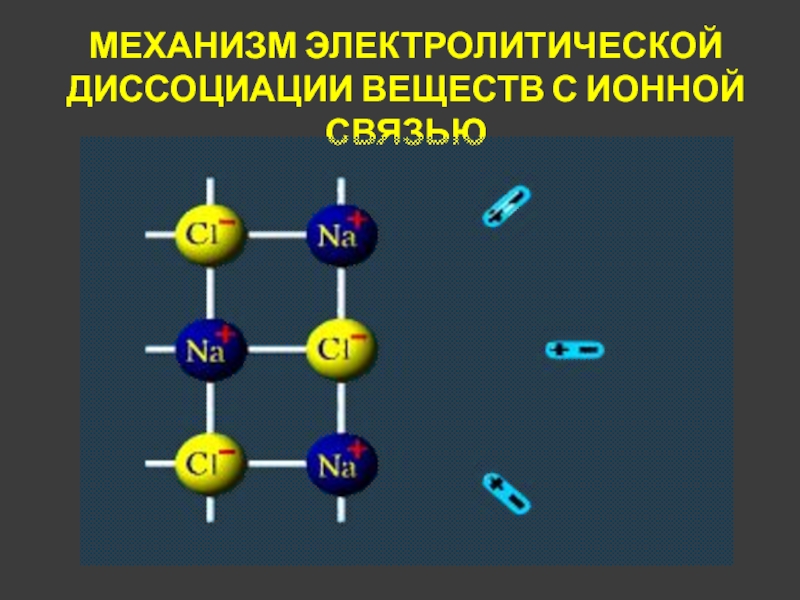
- 11. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ
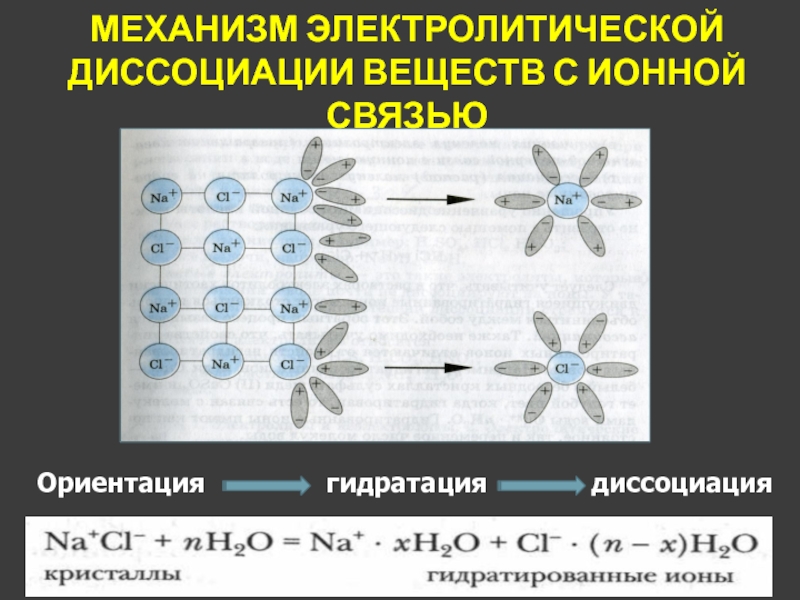
- 12. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮдиссоциация Ориентация гидратация
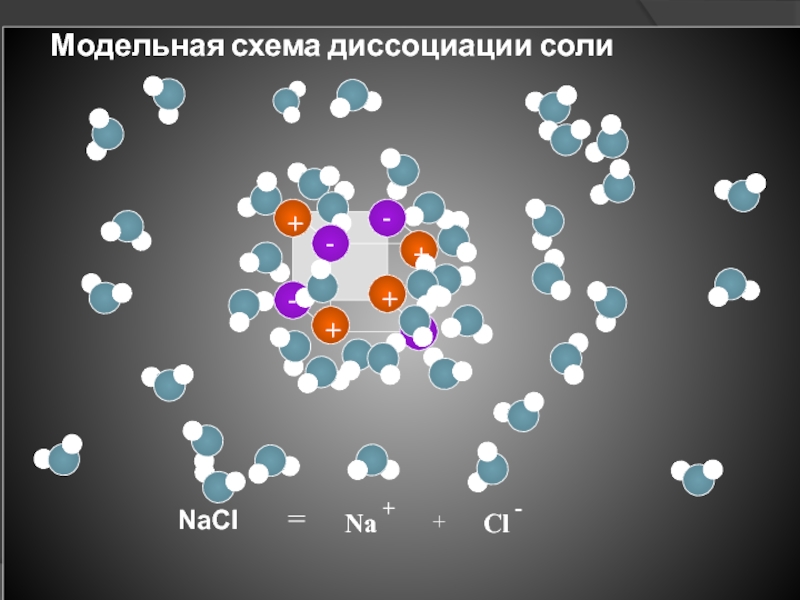
- 13. Модельная схема диссоциации солиNaCl = + Na+
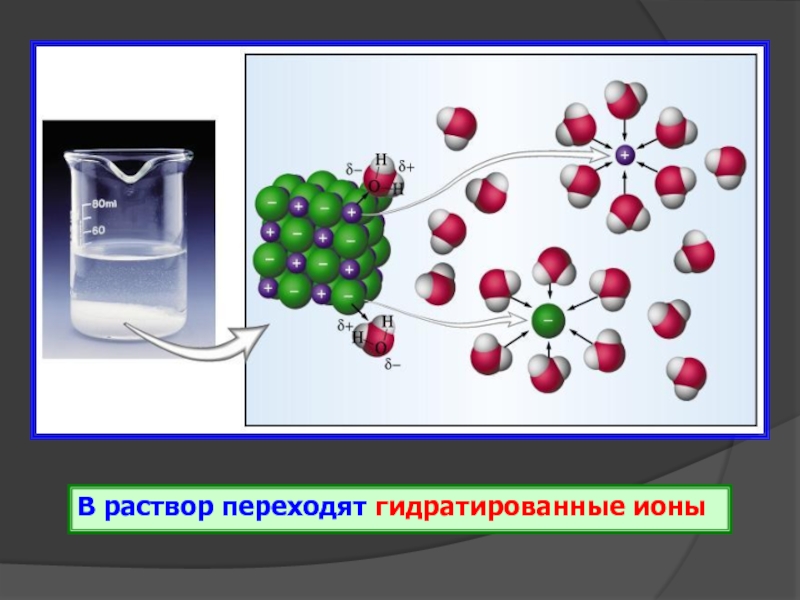
- 14. В раствор переходят гидратированные ионы
- 15. Гидраты:CuSO4 ∙ 5H2OCuSO4
- 16. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮДиссоциация
- 17. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮдиссоциация Ориентация гидратацияионизация
- 18. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮдиссоциация Ориентация гидратацияионизация
- 19. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮДиссоциация
- 20. Слайд 20
- 21. ОСНОВАНИЯ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИОснования – это
- 22. КИСЛОТЫ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИКислоты – это
- 23. СОЛИ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИСоли – это
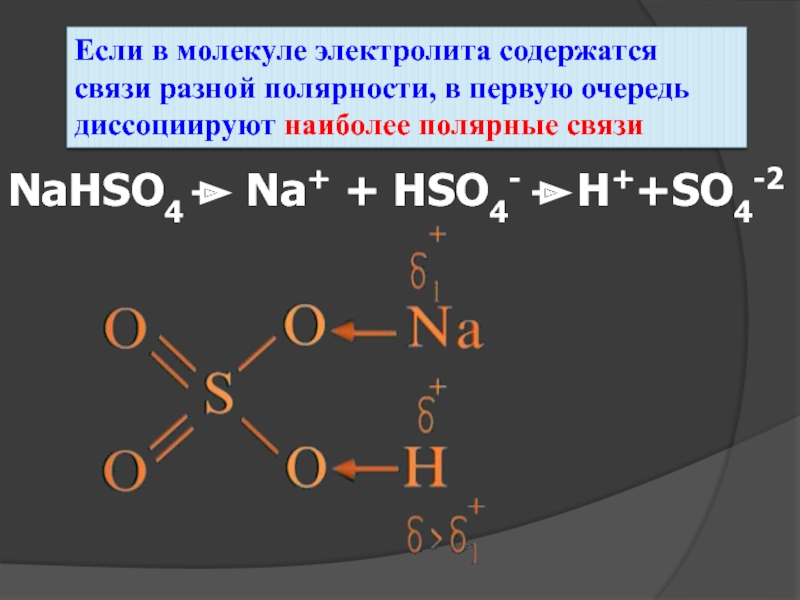
- 24. Если в молекуле электролита содержатся связи разной
- 25. ВЫБЕРИТЕ ПРАВИЛЬНЫЙ ОТВЕТКакое из перечисленных веществ не
- 26. Электролиты – это вещества с:1) металлической связью;2) ионной связью;3) ковалентной полярной связью;4) ковалентной неполярной связью.
- 27. Какое из перечисленных веществ проводит электрический ток:1) водород;2) хлор;3) гидроксид калия;4) дистиллированная вода
- 28. Частицы, заряженные отрицательно называются:1) ионами;2) катионами;3) анионами;4) атомы
- 29. Кислоты в растворе и расплаве
- 30. Свойства оснований определяются наличием в растворе:1) катиона металла2) аниона кислотного остатка3) катиона водорода;4) аниона гидроксогруппы.
Слайд 5КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИ
ВЕЩЕСТВА
ЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
Растворы кислот, щелочей, солей
Кислород, азот, водород, спирт,
это вещества, которые в растворах или расплавах распадаются (диссоциируют)
на ионы.
это вещества, водные растворы или расплавы которых проводят электрический ток.
Слайд 7Сванте Август Аррениус
(1859-1927)
Шведский ученый, академик. В 1887 году сформулировал основные
Слайд 8Электролитическая диссоциация –
процесс распада электролита на ионы при растворении его
Слайд 12МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ
диссоциация
Ориентация
гидратация
Слайд 16МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ
Диссоциация ионных соединений в водных
т. е. соединения с ионным типом связи практически полностью диссоциируют на ионы. Поэтому в уравнениях диссоциации таких электролитов ставится знак равенства или стрелка →.
Слайд 17МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ
диссоциация
Ориентация
гидратация
ионизация
Слайд 18МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ
диссоциация
Ориентация
гидратация
ионизация
Слайд 19МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ
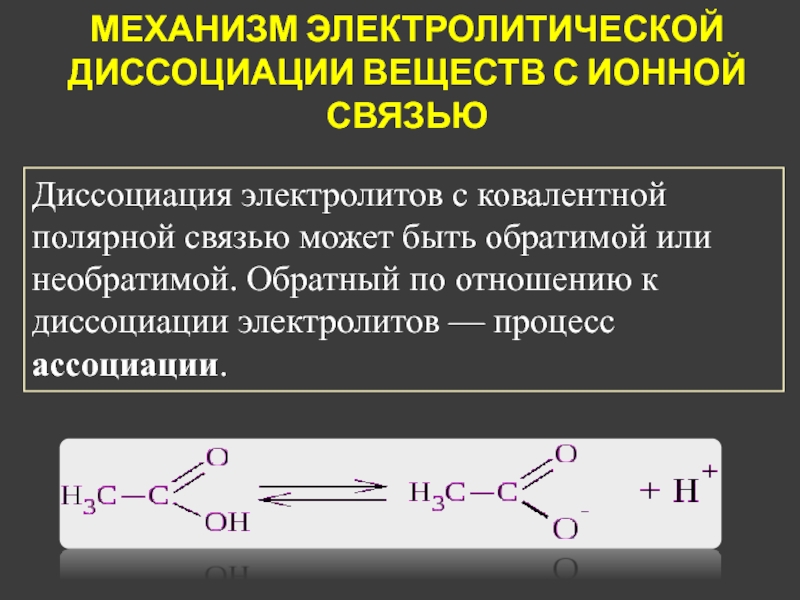
Диссоциация электролитов с ковалентной полярной
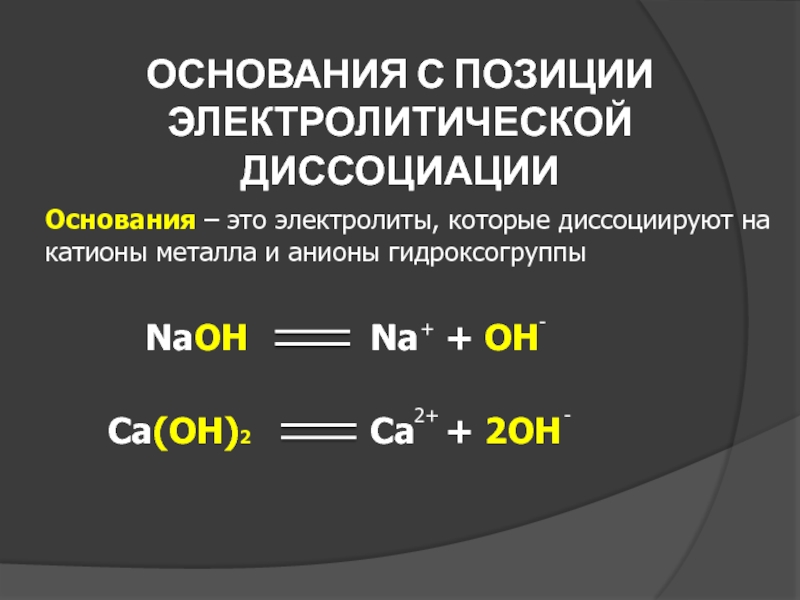
Слайд 21ОСНОВАНИЯ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Основания – это электролиты, которые диссоциируют на
+
+ OH
-
NaOH
Na
2+
+ 2OH
-
Ca(OH)2
Ca
Слайд 22КИСЛОТЫ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Кислоты – это электролиты, которые диссоциируют на
+
+ SO4
2-
Н2SO4
2Н
+
+ NO2
-
НNO2
Н
Слайд 23СОЛИ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Соли – это электролиты, которые диссоциируют на
+
+ Cl
-
NaСl
Na
+
+ SO4
2-
K2SO4
2K
Слайд 24Если в молекуле электролита содержатся связи разной полярности, в первую очередь
NaHSO4
Na+ + HSO4-
H++SO4-2
Слайд 25ВЫБЕРИТЕ ПРАВИЛЬНЫЙ ОТВЕТ
Какое из перечисленных веществ
не является электролитом :
1) хлорид
2) сахар;
3) азотная кислота;
4) сульфат железа
Слайд 26Электролиты – это вещества с:
1) металлической связью;
2) ионной связью;
3) ковалентной полярной
4) ковалентной неполярной связью.
Слайд 27Какое из перечисленных веществ проводит электрический ток:
1) водород;
2) хлор;
3) гидроксид калия;
4)
Слайд 29Кислоты в растворе и расплаве диссоциируют на:
1) анион кислотного
2) катион водорода;
3) катион металла;
4) анион гидроксогруппы.
Слайд 30Свойства оснований определяются наличием в растворе:
1) катиона металла
2) аниона кислотного остатка
3)
4) аниона гидроксогруппы.