- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему ТЭД
Содержание
- 1. Презентация по химии на тему ТЭД
- 2. --------------------------------------------------------------------------------------------------Закончи предложение одним словом: 1.Положительно заря-женный электрод
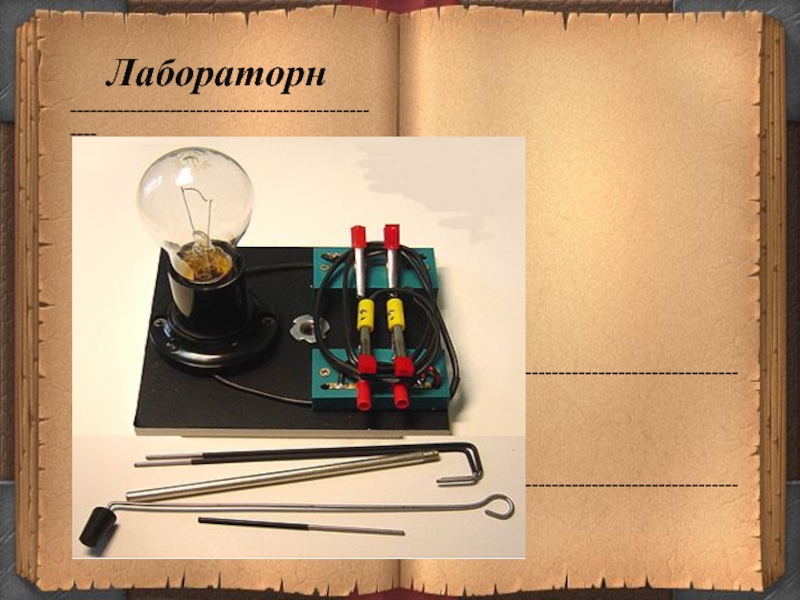
- 3. Лабораторн---------------------------------------------------------------------------------------------------------------------------------------------------
- 4. Сванте ---------------------------------------------------------------------------------------------------------------------------------------------------Дата рождения: 19 февраля
- 5. Основные пПри растворении в воде или расплавлении
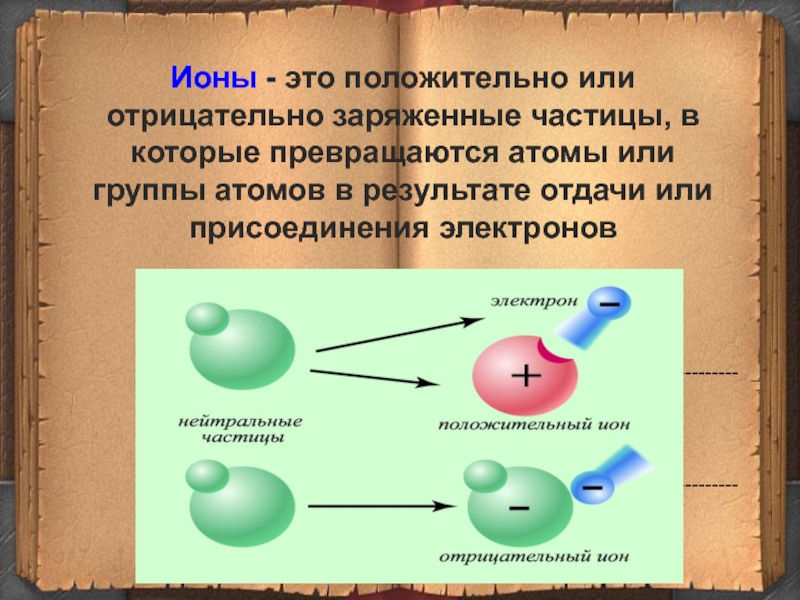
- 6. Ионы - это положительно или отрицательно заряженные
- 7. Электронны--------------------------------------------------------------------------------------------------+11Na0 2ē 8ē 1ē +11Na+
- 8. --------------------------------------------------------------------------------------------------Основные п2. Причиной диссоциации электролита
- 9. Основные п--------------------------------------------------------------------------------------------------3. Под действием электрического тока
- 10. -------------------------------------------------------------------------------------------------- 4. Электролитическая диссоциация –
- 11. --------------------------------------------------------------------------------------------------Основные п 5. Не все электролиты
- 12. --------------------------------------------------------------------------------------------------Основные п6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
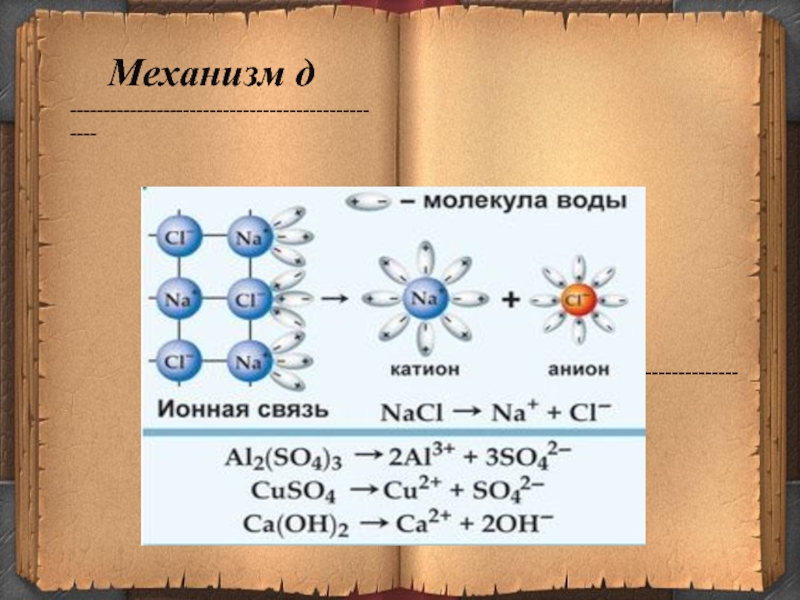
- 13. Механизм д--------------------------------------------------------------------------------------------------
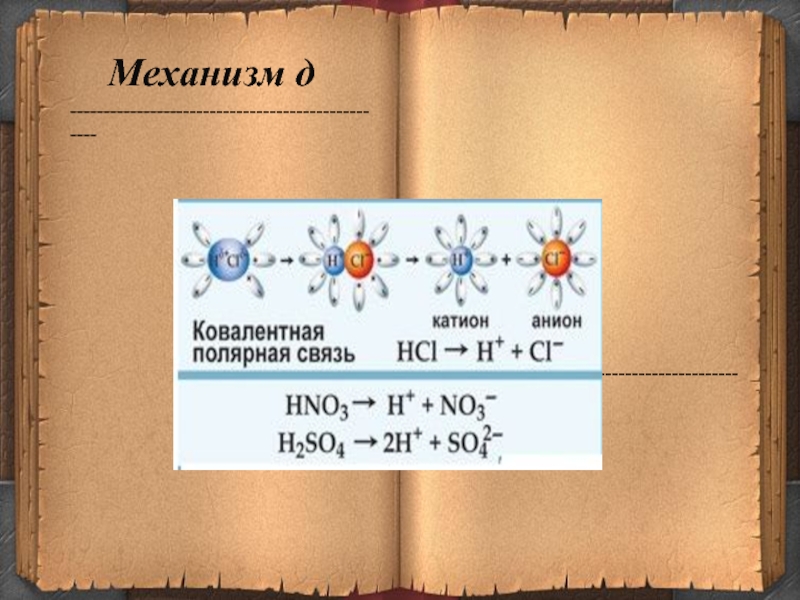
- 14. --------------------------------------------------------------------------------------------------Механизм д
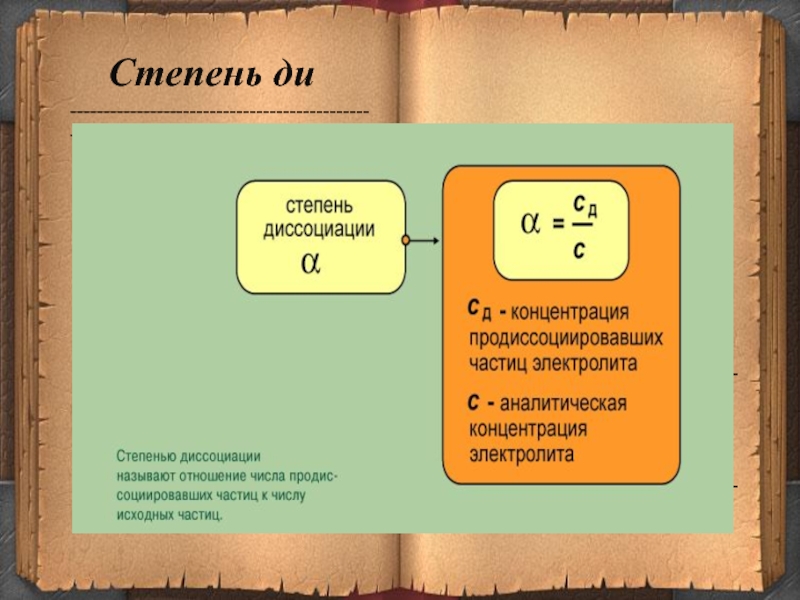
- 15. ---------------------------------------------------------------------------------------------------------------------------------------------------Степень ди
- 16. ЭЛЕКТРОЛИТЫ(по степени диссоциации) СЛАБЫЕ
- 17. Водорастворимые средние соли (кроме Fe (NCS)3 ,
- 18. --------------------------------------------------------------------------------------------------------------------------------------------------- Слабые элГидроксиды d - элементов, вода, гидрат аммиака NH3˟H2O, органические кислоты, некоторые неорганические кислоты.
- 19. ---------------------------------------------------------------------------------------------------------------------------------------------------Степень диссоциации уксусной кислоты равна 2%. Вычислите
- 20. Слайд 20
- 21. --------------------------------------------------------------------------------------------------МногоосновH3PO4 (фосфорная кислота)1) Образование дигидрофосфат-ионовH3PO4 ↔ H+
- 22. Слайд 22
- 23. Ba(OH)2 (гидроксид бария)1) Образование гидроксо-ионов барияBa(OH)2 ↔
- 24. Слайд 24
- 25. --------------------------------------------------------------------------------------------------------------------------------------------------- Домашнее §15, с. 148-151,
Слайд 2-------------------------------------------------
-------------------------------------------------
Закончи предложение одним словом:
1.Положительно заря-женный электрод - … .
2.Отрицательнозаря- женный
3. Направленное движение заряженных частиц - … .
4.Положительнозаряженные частицы -… .
5.Отрицательнозаряженные частицы -… .
6. Вещества, водные растворы или расплавы которых проводят электрический ток -… .
7. Вещества, водные растворы или расплавы которых не проводят электрический ток -… .
8. Процесс распада электролита на ионы при растворении или расплавлении вещества -… .
Слайд 3Лабораторн
-------------------------------------------------
-------------------------------------------------
-------------------------------------------------
Слайд 4 Сванте
-------------------------------------------------
-------------------------------------------------
-------------------------------------------------
Дата рождения: 19 февраля
Место рождения: Швеция,
имение Вейк, недалеко от
Уппсалы
Дата смерти: 2 октября
1927 года (68 лет)
Научная сфера: химия,
физика,
астрофизика
Награды: нобелевская
премия
по химии
1903 год
Слайд 5Основные п
При растворении в воде или расплавлении электролиты диссоциируют (распадаются) на
NaCl = Na+ + Cl-
Ионы – это одна из форм
существования химического
элемента.
-------------------------------------------------
-------------------------------------------------
Слайд 6Ионы - это положительно или отрицательно заряженные частицы, в которые превращаются
-------------------------------------------------
-------------------------------------------------
Слайд 7Электронны
-------------------------------------------------
-------------------------------------------------
+11Na0 2ē 8ē 1ē +11Na+ 2ē 8ē
+17Cl0 2ē 8ē 7ē +17Cl0 2ē 8ē 8ē
атом ион
Слайд 8-------------------------------------------------
-------------------------------------------------
Основные п
2. Причиной диссоциации
электролита в водном растворе
является его гидратация, т.е.
взаимодействие электролита с
молекулами воды и разрыв
химической связи в нем.
Слайд 9Основные п
-------------------------------------------------
-------------------------------------------------
3. Под действием электрического тока положительно заряженные ионы движутся
Слайд 10-------------------------------------------------
-------------------------------------------------
4. Электролитическая диссоциация –
процесс обратимый
электролитов.
Наряду с процессом диссоциации
протекает и обратный процесс –
ассоциация (соединение ионов)
HNO2 ↔ H+ + NO2-
Основные п
Слайд 11-------------------------------------------------
-------------------------------------------------
Основные п
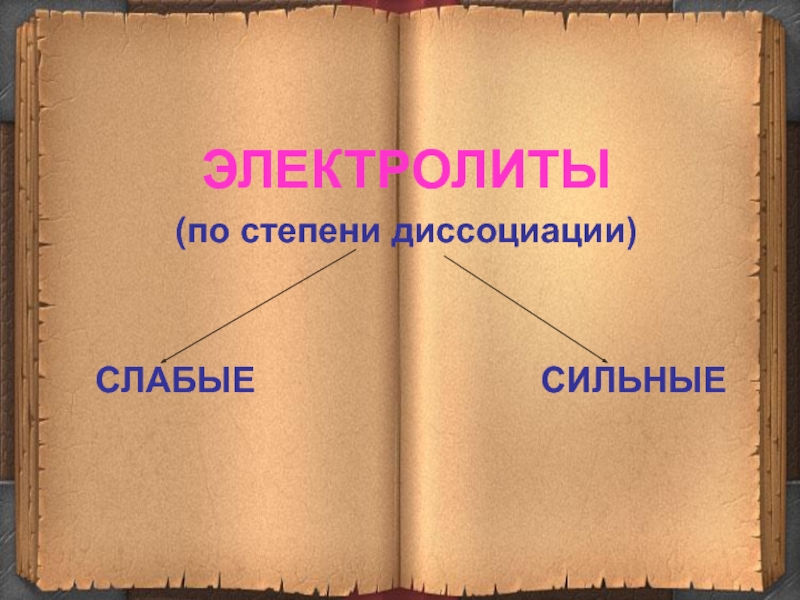
5. Не все электролиты в одинаковой мере диссоциируют
ЭЛЕКТРОЛИТЫ
(по степени диссоциации)
СЛАБЫЕ СИЛЬНЫЕ
Слайд 12-------------------------------------------------
-------------------------------------------------
Основные п
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые
Слайд 13Механизм д
-------------------------------------------------
-------------------------------------------------
Слайд 14-------------------------------------------------
-------------------------------------------------
Механизм д
Слайд 15-------------------------------------------------
-------------------------------------------------
-------------------------------------------------
Степень ди
Слайд 17Водорастворимые средние соли (кроме Fe (NCS)3 , HgCl2), основания, образованные щелочными
-------------------------------------------------
-------------------------------------------------
-------------------------------------------------
Сильные э
Слайд 18-------------------------------------------------
-------------------------------------------------
-------------------------------------------------
Слабые эл
Гидроксиды d - элементов,
вода, гидрат аммиака NH3˟H2O,
органические
некоторые неорганические кислоты.
Слайд 19-------------------------------------------------
-------------------------------------------------
-------------------------------------------------
Степень диссоциации уксусной кислоты равна 2%. Вычислите молярную концентрацию (Сm) данной
Слайд 20
это электролиты,
которые при диссоциации образуют катионы водорода и
анионы кислотного остатка.
HCl = H+ + Cl-
HNO3 = H+ + NO3-
Слайд 21-------------------------------------------------
-------------------------------------------------
Многооснов
H3PO4 (фосфорная кислота)
1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+ + H2PO4-
2) Образование гидрофосфат-ионов
H2PO4-
3) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
Слайд 22
это электролиты, которые
при диссоциации образуют
катионы металла и
гидроксид-анионы.
NaOH = Na+ + OH-
KOH = K+ + OH-
Слайд 23Ba(OH)2 (гидроксид бария)
1) Образование гидроксо-ионов бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование
BaOH+ ↔ Ba2+ + OH-
Многокисло
Слайд 24
это электролиты,
которые при диссоциации образуют
катионы металла (или аммония NH4)
и анионы кислотных остатков.
K3PO4 = 3K+ + PO43-
NH4Cl = NH4+ + Cl-