- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Свойства s-металлов (11 класс)
Содержание
- 1. Презентация по химии на тему Свойства s-металлов (11 класс)
- 2. В периодической таблице s-элементы расположены в I-А
- 3. Слайд 3
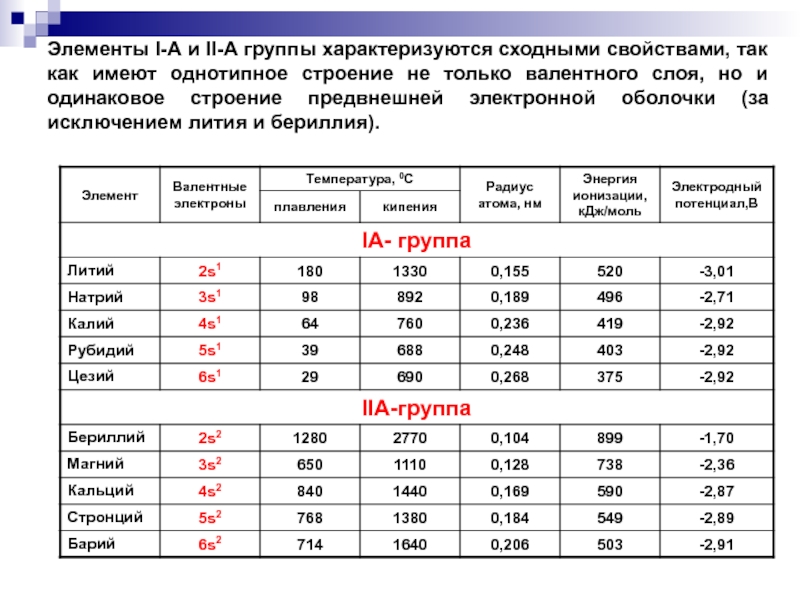
- 4. Элементы I-А и II-А группы характеризуются сходными
- 5. Физические свойстваВ свободном состоянии металлы I-А группы
- 6. Хранение цезия
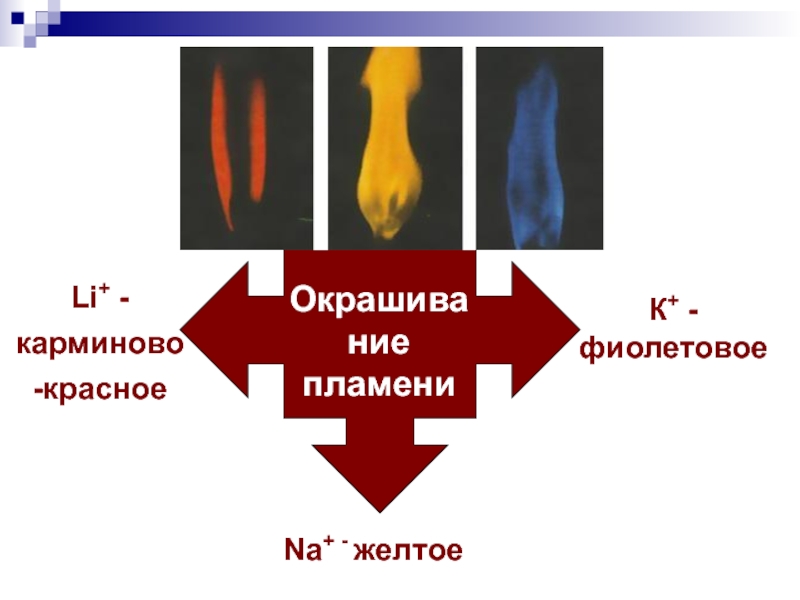
- 7. Окрашивание пламени ионами калия
- 8. Окрашивание пламениК+ - фиолетовоеNa+ - желтоеLi+ - карминово-красное
- 9. Окрашивание пламениСа2+- кирпично-красноеSr2+ - карминово-красноеBа2+ - желто-зеленое
- 10. В свободном виде металлы I-А и II-А
- 11. Химические свойстваВзаимодействие с кислородомБольшинство s-элементов легко окисляются
- 12. Горение лития
- 13. Взаимодействие с неметалламиВсе s-элементы энергично взаимодействуют с
- 14. Хлор с калием
- 15. С азотом без нагревания взаимодействует только литий,
- 16. Взаимодействие с водой Все s-элементы I группы
- 17. Взаимодействие с кислотами. Все металлы I-А и
- 18. Взаимодействие металлов с азотной кислотой зависит от
- 19. Свойства соединений s-элементовСвойства оксидов. Оксиды типа Ме2О
- 20. Среди оксидов второй группы по свойствам от
- 21. Свойства гидроксидов. Гидроксиды образуются при взаимодействии шелочных
- 22. Гидроксиды s-элементов второй группы Ме(ОН)2 – более
- 23. Слайд 23
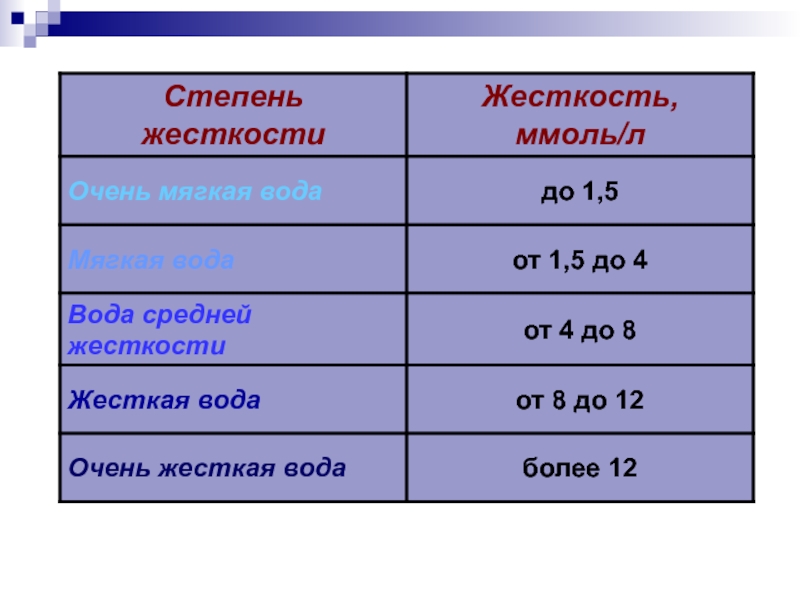
- 24. Жесткость воды выражается суммой миллиэквивалентов ионов Ca2+
- 25. Слайд 25
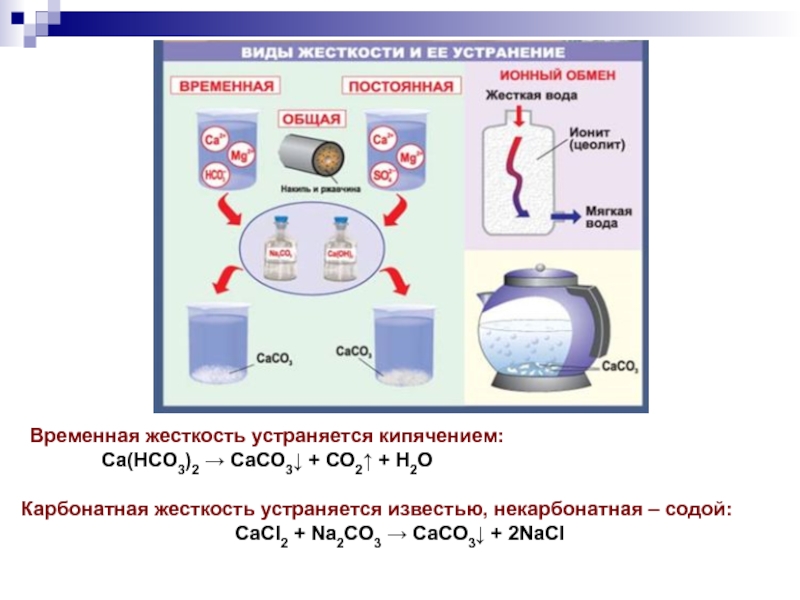
- 26. Временная жесткость устраняется кипячением:Са(НСО3)2 → СаСО3↓ +
- 27. Литийионные аккумуляторы безопасны, экологичны, экономичны и способны
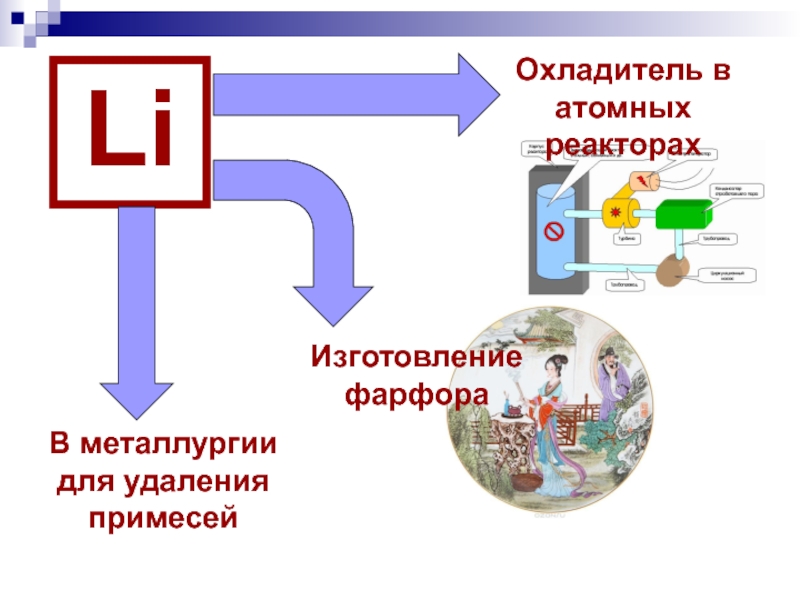
- 28. LiОхладитель в атомных реакторахИзготовление фарфораВ металлургии для удаления примесей
- 29. Применение натрияNaHCO3
- 30. Применение калияИзготовление жидкого мылаПроизводство удобренийБертолетова соль KClO3 – необходимый компонент праздничных фейерверков
- 31. Применение магнияИзготовление легкосплавных материалов на основе алюминия и магнияЛекарственные добавкиВ чистом виде – для изготовления фейерверков
- 32. Применение кальцияХлорид кальция CaCl2 используют наряду с поваренной
Слайд 2В периодической таблице s-элементы расположены в I-А и II-А группах.
Элементы
Элементы второй группы:
Ca, Sr, Ba, Ra называются щелочноземельными металлами.
Слайд 4Элементы I-А и II-А группы характеризуются сходными свойствами, так как имеют
Слайд 5Физические свойства
В свободном состоянии металлы I-А группы характеризуются низкими температурами плавления
Цезий
Литий
Барий
Слайд 10В свободном виде металлы I-А и II-А групп не встречаются. Получают
2 NaCl → 2 Na + Cl2
Такие металлы, как калий, рубидий, цезий, стронций и барий, можно получить методом алюминотермии:
4 SrO + 2 Al = 3 Sr + SrO·Al2O3
[или Sr(AlO2)2 – алюминат стронция]
Франций и радий получают путем ядерных реакций
Получение металлов:
Слайд 11Химические свойства
Взаимодействие с кислородом
Большинство s-элементов легко окисляются на воздухе При взаимодействии
а) Нормальные оксиды образуют – Li, Be, Mg, Ca и Sr:
4 Li + O2 = 2 Li2O
2 Ca + O2 = 2CaO
б) Натрий и барий соединяясь с кислородом, образуют пероксиды:
2 Na + O2 = Na2O2
Вa + O2 = ВaO2
в) Калий, рубидий и цезий с кислородом образуют надпероксиды
(супероксиды):
К + O2 = КO2 (К2О4)
Рубидий и цезий воспламеняются при комнатной температуре, натрий и калий – только при нагревании. Бериллий на воздухе покрывается оксидной пленкой (ВеО), которая защищает металл от дальнейшего разрушения.
Слайд 13Взаимодействие с неметаллами
Все s-элементы энергично взаимодействуют с галогенами:
2Na + Сl2 =
2К(Rb, Cs) + Br2 (ж) = 2КBr Ва + Br2(ж) = ВаBr2
(взрыв)
С серой и другими неметаллами эти металлы взаимодействуют при нагревании:
2Na + S→ Na2S Са + S→ СaS
При нагревании с углеродом получаются карбиды металлов. Карбид кальция используют для получения ацетилена:
2Na + 2С → Na2С2 Са + 2С → СaС2
СаС2 + 2Н2О = Са(ОН)2 + С2Н2↑
Слайд 15С азотом без нагревания взаимодействует только литий, остальные s-элементы взаимодействуют с
6Li + N2 = 2Li3N 3Ca + N2 → Ca3N2
Ca3N2 + 6Н2О = 3Са(ОН)2 + 2NН3↑
Металлы I-А и II-А групп могут взаимодействовать с водородом с образованием гидридов металлов:
2Na + Н2 = 2NaH Ca + Н2 = CaH2
Гидриды разлагаются водой, с образованием водорода:
NaH + Н2О = NaОH + Н2
Слайд 16Взаимодействие с водой
Все s-элементы I группы энергично взаимодействуют с водой.
2Na + 2Н2О = 2 NaОН + Н2↑
Менее энергично с водой взаимодействуют s-элементы II группы. Бериллий с водой не взаимодействует за счет образования на его поверхности защитной оксидной пленки ВеО (так же, как и алюминий). Магний медленно взаимодействует с водой из-за образования малорастворимого гидроксида магния на поверхности металла. Остальные s-элементы II-А группы вытесняют водород из воды при комнатной температуре:
Ba + 2Н2О = Bа(ОН)2 + Н2↑
Слайд 17Взаимодействие с кислотами.
Все металлы I-А и II-А групп легко растворяются
2Na + 2НСl = 2NaСl + Н2↑
Mg + Н2SO4 (разб.) = MgSO4 + Н2↑
При взаимодействии металлов с концентрированной серной кислотой окислителем является сера, а поскольку металлы очень активны, то восстановление серы в серной кислоте идет до низшей степени окисления, т. е. до Н2S.
4Mg + 5Н2SO4 (конц.) = 4MgSO4 + Н2S↑ + 4Н2О
Слайд 18Взаимодействие металлов с азотной кислотой зависит от степени разбавления кислоты и
3 Mg + 8 НNO3 (конц.) = 3 Mg(NO3)2 + 2 NО↑ + 4 Н2О
4 Mg + 10 НNO3 (разб.) = 4 Mg(NO3)2 + N2О↑ + 5 Н2О
4 Mg + 10 НNO3 (оч. разб.) = 4 Mg(NO3)2 + NН4NO3 + 3 Н2О
Бериллий концентрированными серной и азотной кислотами пассивируется. Из всех s-элементов только бериллий обладает амфотерными свойствами и поэтому растворяется в кислотах и в щелочах:
Ве + 2 НСl = ВеСl2 + Н2↑
Ве + 2 NaOH + 2 H2O = Na2[Be(OH)4] + Н2↑
Слайд 19Свойства соединений
s-элементов
Свойства оксидов.
Оксиды типа Ме2О и МеО проявляют основные
При взаимодействии с водой оксиды s-элементов образуют соответствующие гидроксиды и легко взаимодействуют с кислотами:
Na2О + Н2О = 2NaОН CaО + Н2О = Ca(ОН)2
Na2О + 2НСl = 2NaСl + Н2О CaО + Н2SО4 = CaSО4 + Н2О
Слайд 20Среди оксидов второй группы по свойствам от остальных оксидов отличается оксид
Оксид бериллия не взаимодействует с водой, но реагирует с кислотами и щелочами, кислотными и основными оксидами:
ВеО + Н2SО4 (разб.) = ВеSО4 + Н2О
ВеО + 2КОН + Н2О = К2[Ве(ОН)4]
ВеО + SiO2 → BeSiO3 (сплавление)
BeO + Na2O → Na2BeO2 (сплавление)
Слайд 21Свойства гидроксидов.
Гидроксиды образуются при взаимодействии шелочных и щелочноземельных металлов и
Гидроксиды s-элементов IA группы (МеОН) –
бесцветные кристаллические вещества, хорошо растворимые в воде (кроме LiOH), относятся к сильным основаниям, которые называются щелочами. Щелочи легко поглощают влагу из воздуха (расплываются на воздухе). Гидроксиды МеОН поглощают СО2 из воздуха и разъедают стекло и фарфор:
2 NaOH + CO2 = Na2CO3 + Н2О
2 NaOH + SiO2 = Na2SiO3 + Н2О
Слайд 22Гидроксиды s-элементов второй группы Ме(ОН)2 – более слабые основания, чем гидроксиды
Mg(OH)2 + 2 НСl = МgСl2 + 2 Н2О
Гидроксид бериллия проявляет амфотерные свойства:
Ве(OH)2 + Н2SO4 = ВеSO4 + 2 Н2О
Ве(OH)2 + 2 NaОН = Na2[Ве(ОН)4]
Гидроксиды металлов второй группы при нагревании разлагаются:
Mg(OH)2 MgO + Н2О
В ряду: Ве(ОН)2 – Mg(OH)2 – Ca(OH)2 – Sr(OH)2 – Ba(OH)2
Слабые основания Сильные основания
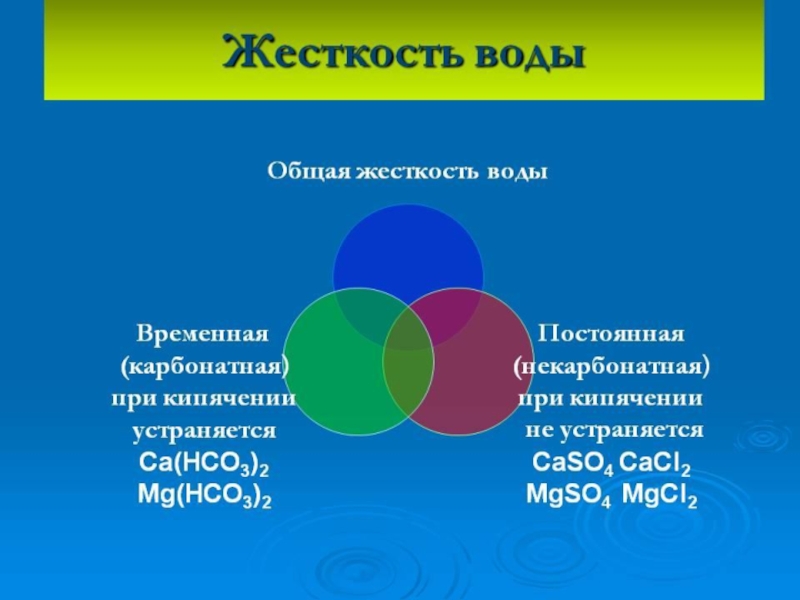
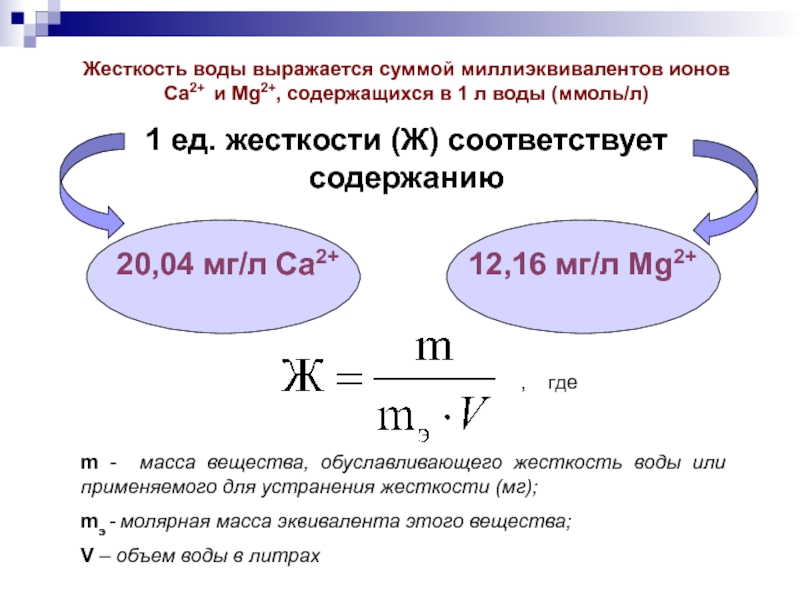
Слайд 24Жесткость воды выражается суммой миллиэквивалентов ионов Ca2+ и Mg2+, содержащихся в
1 ед. жесткости (Ж) соответствует содержанию
20,04 мг/л Ca2+ 12,16 мг/л Mg2+
, где
m - масса вещества, обуславливающего жесткость воды или применяемого для устранения жесткости (мг);
mэ - молярная масса эквивалента этого вещества;
V – объем воды в литрах
Слайд 26Временная жесткость устраняется кипячением:
Са(НСО3)2 → СаСО3↓ + СО2↑ + Н2О
Карбонатная жесткость
СаСl2 + Na2CO3 → СаСО3↓ + 2NaCl
Слайд 27Литийионные аккумуляторы безопасны, экологичны, экономичны и способны «проехать» до 600 тыс.
Применение лития
Миниатюрные батарейки для электронных часов и радиоэлектроники
Слайд 30Применение калия
Изготовление жидкого мыла
Производство удобрений
Бертолетова соль KClO3 – необходимый компонент праздничных
Слайд 31Применение магния
Изготовление легкосплавных материалов на основе алюминия и магния
Лекарственные добавки
В чистом
Слайд 32Применение кальция
Хлорид кальция CaCl2 используют наряду с поваренной солью для борьбы с
Кристаллический карбонат кальция — мрамор — прекрасный отделочный материал.
Мел используют для побелки.
В качестве дезинфицирующего средства очень эффективна хлорная известь — «хлорка» Ca(OCl)Cl
Гипс (CaSO4·2H2O) широко используют в строительстве, в скульптуре, для изготовления лепнины и различных художественных изделий. Применяют гипс и в медицине для фиксации костей при переломах.