- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атома
Содержание
- 1. Презентация по химии на тему Строение атома
- 2. У-5. Основные сведения о строении атомов.
- 3. Цель урока: Формирование умения определять состав
- 4. Этап-5. Творческий1. Задача «Кто больше?»Какое максимальное количество
- 5. Ответ: I, H, K, Cd, Ra, Sc,
- 6. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 7. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 8. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 9. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 10. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 11. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 12. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 13. Этап -I.Актуализация знаний. Упр.3 с.43 Используя рисунок 2
- 14. Упр.4 с.43. Какой форме существования химического элемента
- 15. Упр.4 с.43. Какой форме существования химического элемента
- 16. Упр.4 с.43. Какой форме существования химического элемента
- 17. Упр.5 с.43. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
- 18. Упр.5 с.43. Почему относительная атомная масса элемента
- 19. 1) Какую информацию можно извлечь из химической формулы
- 20. СН4• название вещества-метан; • качественный состав –• тип вещества -;
- 21. СН4• название вещества-метан; • качественный состав –углерод и водород• тип
- 22. СН4• название вещества-метан; • качественный состав –углерод и водород• тип
- 23. СН4• название вещества-метан; • качественный состав –углерод и водород• тип
- 24. СН4• название вещества-метан; • качественный состав –углерод и водород• тип
- 25. СН4• название вещества-метан; • качественный состав –углерод и водород• тип
- 26. СН4• название вещества-метан; • качественный состав –углерод и водород• тип
- 27. Этап -2. Строение атома.«Атом», в переводе с древнегреческого
- 28. Слайд 28
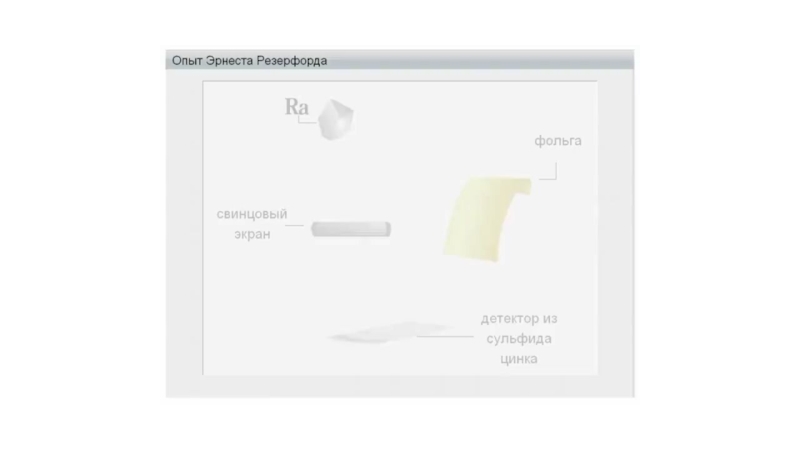
- 29. Эрнест РезерфордВ 1911 году Эрнест Резерфорд предложил
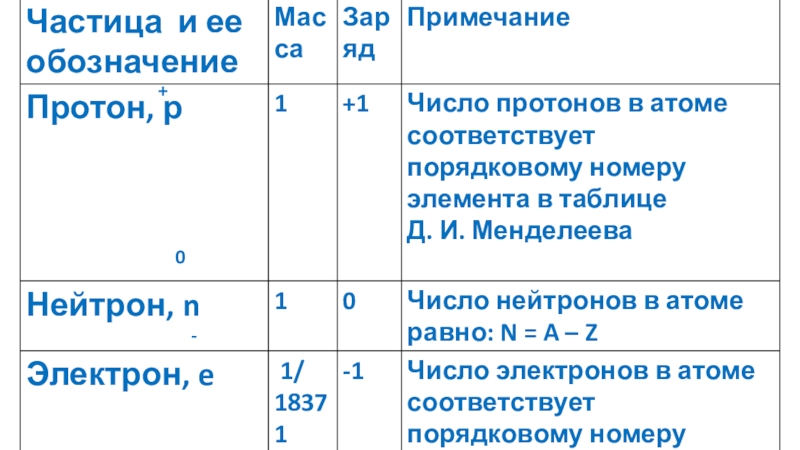
- 30. 0+-
- 31. Аr - массовое числоAr(P)=31Р1530,97ФОСФОРПорядковый номер= заряд ядра
- 32. Определите число протонов, нейтронов и электронов в атоме фосфора с массовым числом 31. протонов 15;
- 33. Г.БИННИНГ И Г.РОРЕРНаночастицы (размер 10-9м)Швейцарские ученые Биннинг
- 34. Л/О «Моделирование принципа сканирующего микроскопа» стр.48Домашний эксперимент.Распакуйте
- 35. Если изменить число протонов в его
- 36. Записи в тетрадиИзотопы — разновидности атомов одного и
- 37. Записи в тетради
- 38. Заряд ядра — основная характеристика атома. Химический элемент — совокупность атомов с одинаковым зарядом ядра.Записи в тетради
- 39. Э-3. Систематизация пройденного материалаУпражнения –изменение состава ядра:1.Какой
- 40. Этап-4. Подведение итоговКак развивались понятия «атом» и
Слайд 3Цель урока:
Формирование умения определять состав атома и атомного ядра
Проблемный вопрос урока:
Каковы современные представления о строении атомов?
Слайд 4Этап-5. Творческий
1. Задача «Кто больше?»
Какое максимальное количество названий химических элементов можно
Слайд 5Ответ: I, H, K, Cd, Ra, Sc, In, Si, Sn, V,
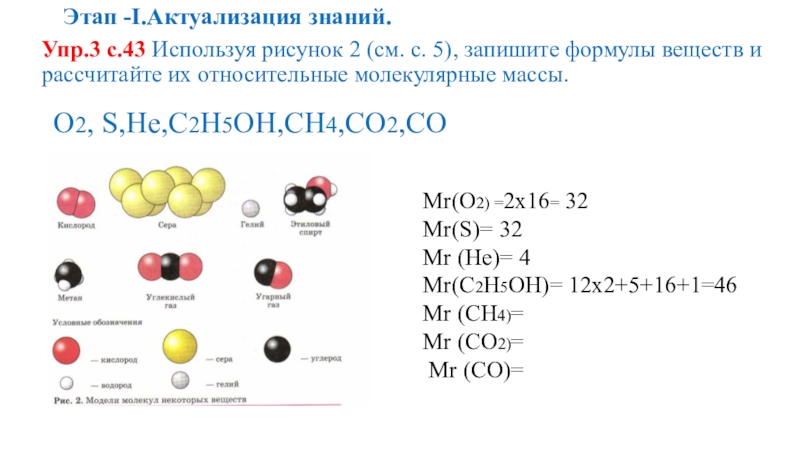
Слайд 6Этап -I.Актуализация знаний.
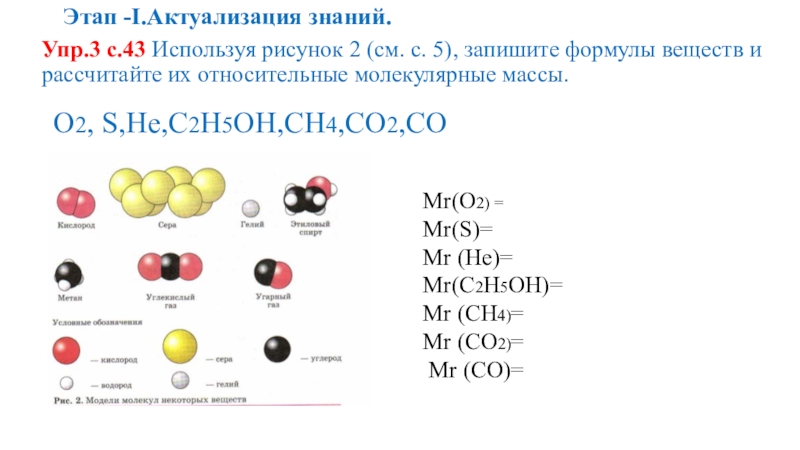
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =
Mr(S)=
Mr (He)=
Mr(C2H5OH)=
Mr (CH4)=
Mr (CO2)=
Mr (CO)=
Слайд 7Этап -I.Актуализация знаний.
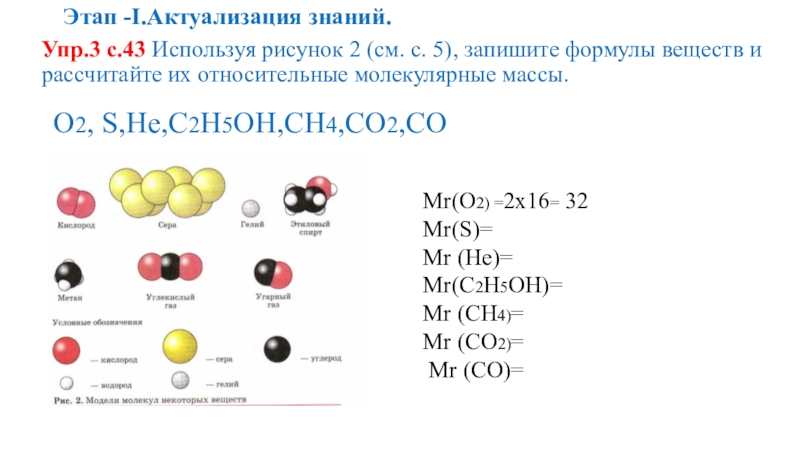
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)=
Mr (He)=
Mr(C2H5OH)=
Mr (CH4)=
Mr (CO2)=
Mr (CO)=
Слайд 8Этап -I.Актуализация знаний.
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S8,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)= 32 х8=256
Mr (He)=
Mr(C2H5OH)=
Mr (CH4)=
Mr (CO2)=
Mr (CO)=
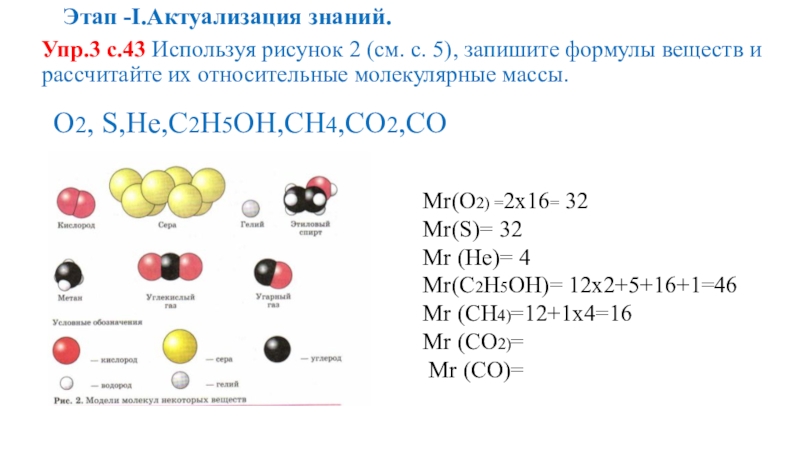
Слайд 9Этап -I.Актуализация знаний.
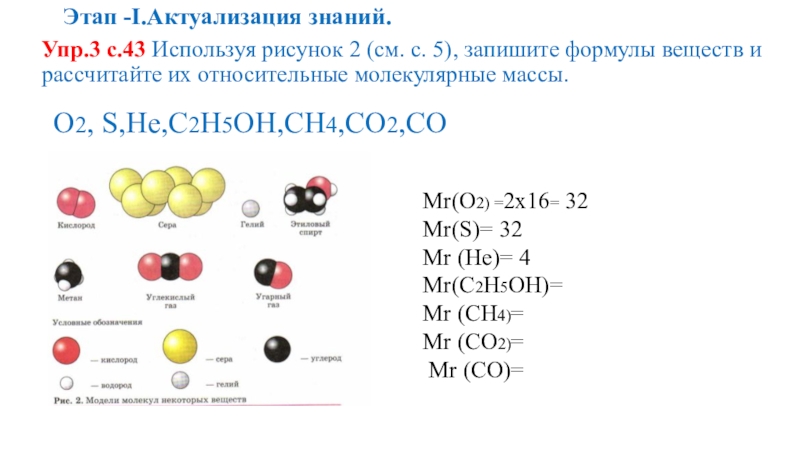
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)= 32
Mr (He)= 4
Mr(C2H5OH)=
Mr (CH4)=
Mr (CO2)=
Mr (CO)=
Слайд 10Этап -I.Актуализация знаний.
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)= 32
Mr (He)= 4
Mr(C2H5OH)= 12х2+5+16+1=46
Mr (CH4)=
Mr (CO2)=
Mr (CO)=
Слайд 11Этап -I.Актуализация знаний.
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)= 32
Mr (He)= 4
Mr(C2H5OH)= 12х2+5+16+1=46
Mr (CH4)=12+1х4=16
Mr (CO2)=
Mr (CO)=
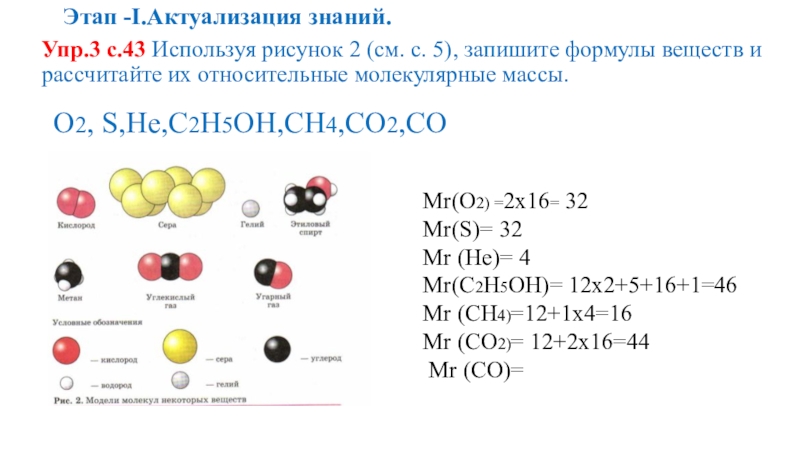
Слайд 12Этап -I.Актуализация знаний.
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)= 32
Mr (He)= 4
Mr(C2H5OH)= 12х2+5+16+1=46
Mr (CH4)=12+1х4=16
Mr (CO2)= 12+2х16=44
Mr (CO)=
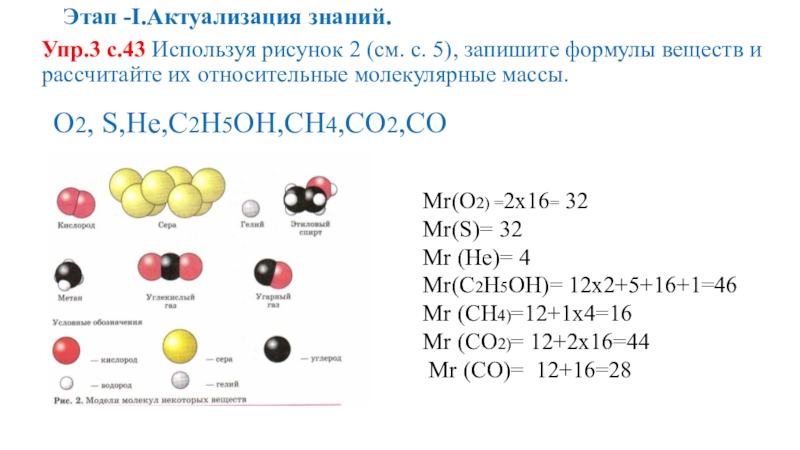
Слайд 13Этап -I.Актуализация знаний.
Упр.3 с.43 Используя рисунок 2 (см. с. 5), запишите
О2, S,He,C2H5OH,CH4,CO2,CO
Mr(О2) =2х16= 32
Mr(S)= 32
Mr (He)= 4
Mr(C2H5OH)= 12х2+5+16+1=46
Mr (CH4)=12+1х4=16
Mr (CO2)= 12+2х16=44
Mr (CO)= 12+16=28
Слайд 14Упр.4 с.43. Какой форме существования химического элемента кисло-
рода соответствует каждая из
5O2; 4CO2
3O-три атома кислорода;
5O2-;
4CO2-
Слайд 15Упр.4 с.43. Какой форме существования химического элемента кисло-
рода соответствует каждая из
5O2; 4CO2
3O-три атома кислорода;
5O2-пять молекул кислорода;
4CO2-
Слайд 16Упр.4 с.43. Какой форме существования химического элемента кисло-
рода соответствует каждая из
5O2; 4CO2
3O-три атома кислорода;
5O2-пять молекул кислорода;
4CO2- четыре молекулы углекислого газа
Слайд 17Упр.5 с.43. Почему относительная атомная масса элемента и относительная молекулярная масса
Слайд 18Упр.5 с.43. Почему относительная атомная масса элемента и относительная молекулярная масса
Относительная атомная масса элемента и относительная
молекулярная масса вещества показывают во сколько раз масса элемента или молекулы больше, чем атомная единица массы.
Слайд 191) Какую информацию можно извлечь из химической формулы вещества?
2) Дайте полную
Этап -I. Проверка домашнего задания
Слайд 20СН4
• название вещества-метан;
• качественный состав –
• тип вещества -;
• количественный состав-
• относительная молекулярная
• соотношение масс элементов в веществе;
• массовые доли элементов в веществе
Слайд 21СН4
• название вещества-метан;
• качественный состав –углерод и водород
• тип вещества -;
• количественный состав-
• соотношение масс элементов в веществе;
• массовые доли элементов в веществе
Слайд 22СН4
• название вещества-метан;
• качественный состав –углерод и водород
• тип вещества - сложное;
• количественный
• относительная молекулярная масса-;
• соотношение масс элементов в веществе;
• массовые доли элементов в веществе
Слайд 23СН4
• название вещества-метан;
• качественный состав –углерод и водород
• тип вещества - сложное;
• количественный
• относительная молекулярная масса-;
• соотношение масс элементов в веществе;
• массовые доли элементов в веществе
Слайд 24СН4
• название вещества-метан;
• качественный состав –углерод и водород
• тип вещества - сложное;
• количественный
• относительная молекулярная масса- Mr(CH4)= Ar(C) +4Ar(H)=16;
• соотношение масс элементов в веществе;
• массовые доли элементов в веществе
Слайд 25СН4
• название вещества-метан;
• качественный состав –углерод и водород
• тип вещества - сложное;
• количественный
• относительная молекулярная масса- Mr(CH4)= Ar(C) +4Ar(H)=16;
• соотношение масс элементов в веществе 1:4;
• массовые доли элементов в веществе
Слайд 26СН4
• название вещества-метан;
• качественный состав –углерод и водород
• тип вещества - сложное;
• количественный
• относительная молекулярная масса- Mr(CH4)= Ar(C) +4Ar(H)=16;
• соотношение масс элементов в веществе 1:4;
• массовые доли элементов в веществе
W(H)=0,25
Слайд 27Этап -2. Строение атома.
«Атом», в переводе с древнегреческого означающее «неделимый».
Резерфорд на
Резерфорд предположил, что в центре атома содержится ядро, в котором сосредоточен весь положительный заряд и практически вся масса атома; вокруг ядра подобно планетам Солнечной системы вращаются отрицательно заряженные электроны. Затем было установлено, что ядро также состоит из элементарных частиц — протонов и нейтронов. Сумма чисел протонов (Z) и нейтронов (N) в атоме называется массовым числом (А).
Слайд 29Эрнест Резерфорд
В 1911 году Эрнест Резерфорд предложил планетарную модель строения атома
Свою
Слайд 32Определите число протонов, нейтронов и электронов в атоме фосфора с массовым
протонов 15;
Слайд 33Г.БИННИНГ И Г.РОРЕР
Наночастицы (размер 10-9м)
Швейцарские ученые Биннинг и Рорер с помощью
Слайд 34Л/О «Моделирование принципа сканирующего
микроскопа» стр.48
Домашний эксперимент.
Распакуйте пластику жевательной резинки и
Этот принцип используется для изготовлений печатной продукции для слепых.
Слайд 35
Если изменить число протонов в его ядре образуются другие
Если, не изменяя заряд ядра, изменить число нейтронов в ядре атома , полученные атомы будут иметь другую массу, отличную от массы исходных атомов. В результате такого процесса возникнут изотопы (в переводе с греческого изос — «одинаковый», топос — «место»).
Слайд 36Записи в тетради
Изотопы — разновидности атомов одного и того же химического элемента,
Почему относительные атомные массы химических элементов в таблице Д. И. Менделеева имеют дробные значения? Это связано с тем, что в природе практически все химические элементы присутствуют в виде нескольких изотопов. Поэтому относительные атомные массы химических элементов являются средними значениями атомных масс природных изотопов с учетом их распространенности в природе.
Слайд 38
Заряд ядра — основная характеристика атома.
Химический элемент — совокупность атомов с одинаковым
Записи в тетради
Слайд 39Э-3. Систематизация пройденного материала
Упражнения –изменение состава ядра:
1.Какой элемент образуется, если в
2.Выполнить задания № 4 после § 7 учебника,
№ 1, 2, 5 после § 8
Слайд 40Этап-4. Подведение итогов
Как развивались понятия «атом» и «химический элемент»? Каковы современные
Домашнее задание: § 7(у), § 8(чит.), упр.1-4после § 7