- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение электронных оболочек атомов химических элементов
Содержание
- 1. Презентация по химии на тему Строение электронных оболочек атомов химических элементов
- 2. Цели урокаСформировать представления об электронной обоблочек атома и энергетических уровняхРассмотреть электронное строение элементов 1-3 периодов
- 3. Проверка домашнего заданияУпражнения – стр. 46Я́дерная реа́кция —
- 4. Правило смещения (правило Содди-Фаянса): При α –
- 5. ОБОЗНАЧЕНИЕ ЯДРА АТОМА АЛЬФА α - РАСПАД
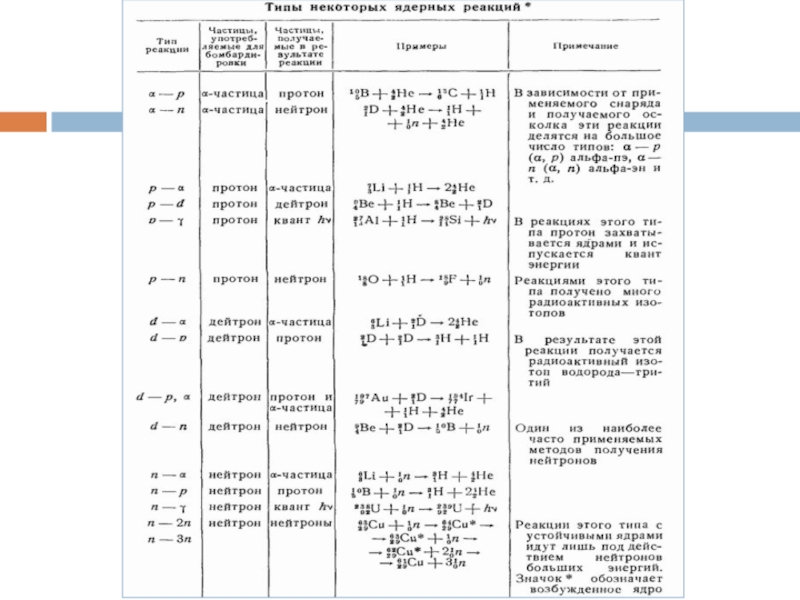
- 6. Написание уравнений ядерных реакций
- 7. Слайд 7
- 8. Ответьте на вопросыЧем можно объяснить различие в
- 9. Электронная оболочкаСовокупность всех электронов в атоме, окружающих
- 10. Подуровни состоят из орбиталей. Число орбиталей на
- 11. Энергетические уровни, содержащие максимальное число электронов, называются
- 12. Запомните!Электроны, расположенные на последней электронной оболочке, называются
- 13. Форма электронных облаков (орбиталей)Область наиболее вероятного местонахождения
- 14. 1 периодН + 11n=1S1 S1Нe + 22n=1S1
- 15. 2 периодLi + 32 1n=1n=21 S2
- 16. 2 периодС + 62 4n=1n=2N +
- 17. 2 периодF + 92 7n=1n=2Ne +
- 18. 3 периодMg + 122 8 2n=1n=2Al
- 19. 3 периодP + 152 8 5n=1n=2S
- 20. 3 периодAr + 182 8 8n=1n=2K
- 21. Выводы Причина сходства элементов заключается в одинаковом
- 22. Домашнее заданиеПараграф 8, записи в тетрадиЗарисовать строение химических элементов 3 периодаУпражнения 2-5, стр. 52-53
Слайд 2Цели урока
Сформировать представления об электронной обоблочек атома и энергетических уровнях
Рассмотреть электронное
Слайд 3Проверка домашнего задания
Упражнения – стр. 46
Я́дерная реа́кция — процесс образования новых ядер
.
Слайд 4Правило смещения
(правило Содди-Фаянса):
При α – распаде радиоактивный элемент превращается
Фредерик Содди
(1877-1956), открыл
явление изотопии в 1910г.
(Нобелевская премия по
химии, 1921г.)
Казимир Фаянс
(1887-1975)
Закон смещения дал возможность предсказывать последовательность распада многих радиоактивных элементов, определяя образующиеся таким образом элементы на основе вида излучения и включая их в таблицу периодической системы.
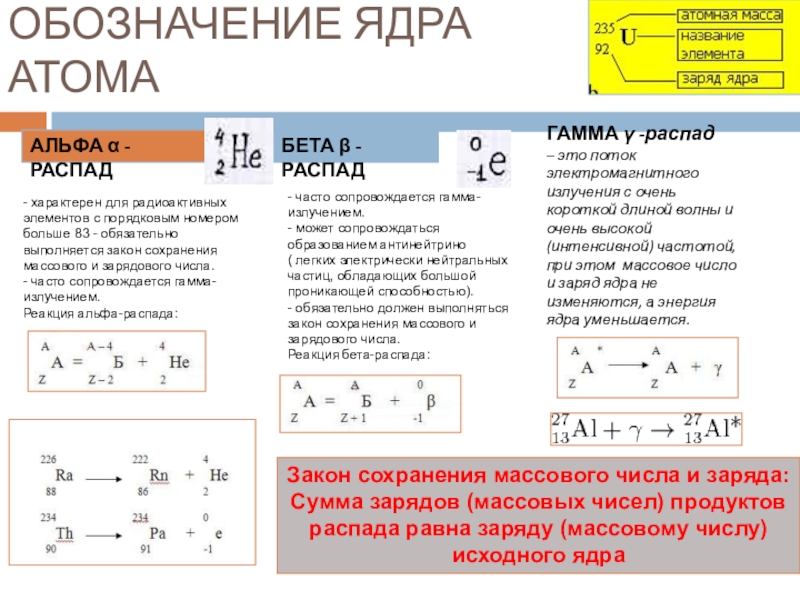
Слайд 5ОБОЗНАЧЕНИЕ ЯДРА АТОМА
АЛЬФА α - РАСПАД
- характерен для радиоактивных
БЕТА β - РАСПАД
- часто сопровождается гамма-излучением.
- может сопровождаться образованием антинейтрино
( легких электрически нейтральных частиц, обладающих большой проникающей способностью).
- обяэательно должен выполняться закон сохранения массового и зарядового числа.
Реакция бета-распада:
ГАММА γ -распад
– это поток электромагнитного излучения с очень короткой длиной волны и очень высокой (интенсивной) частотой, при этом массовое число и заряд ядра не изменяются, а энергия ядра уменьшается.
Закон сохранения массового числа и заряда:
Сумма зарядов (массовых чисел) продуктов распада равна заряду (массовому числу) исходного ядра
Слайд 8Ответьте на вопросы
Чем можно объяснить различие в свойствах элементов?
Причина – различие
Чем можно объяснить сходство некоторых элементов?
- Причина – сходство внутреннего строения атома
Слайд 9Электронная оболочка
Совокупность всех электронов в атоме, окружающих ядро
Каждый электрон имеет свою
Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Слайд 10
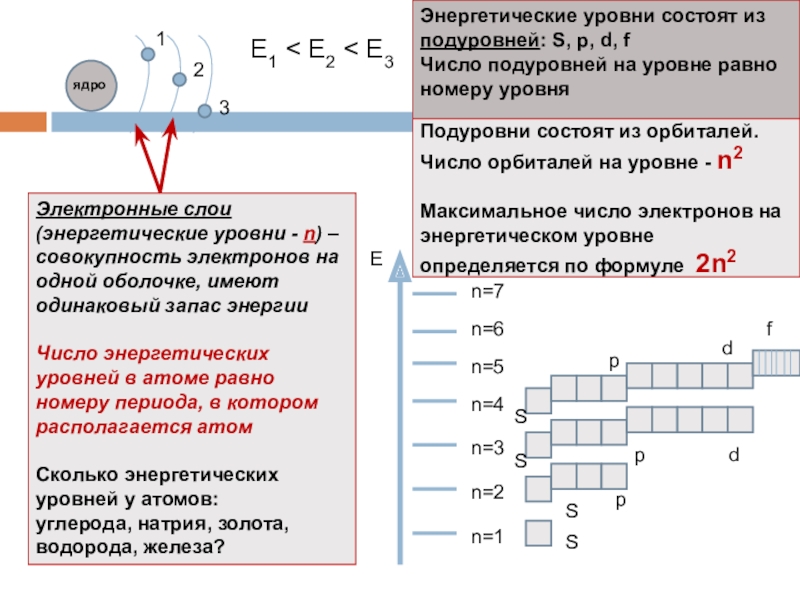
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное
1
2
3
Е1 < E2 < E3
Электронные слои (энергетические уровни - n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Слайд 11Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
Слайд 12Запомните!
Электроны, расположенные на последней электронной оболочке, называются внешними.
Число внешних электронов для
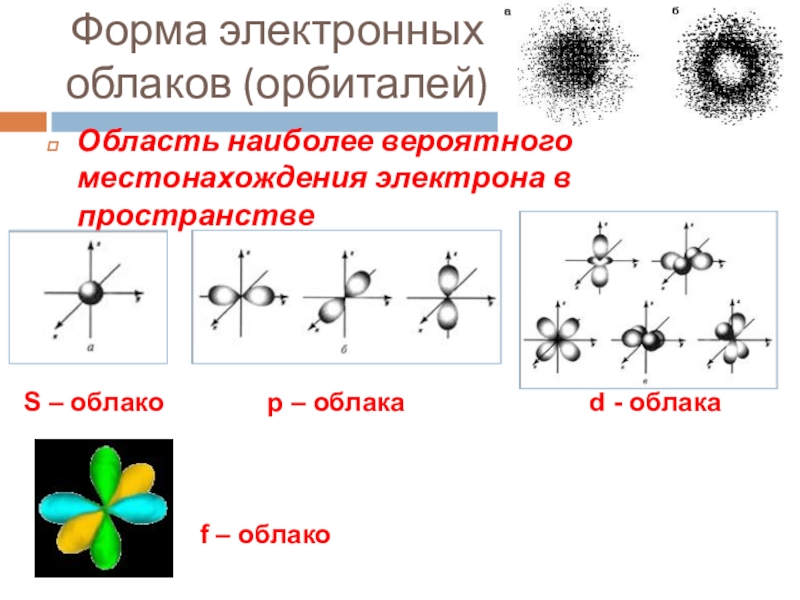
Слайд 13Форма электронных облаков (орбиталей)
Область наиболее вероятного местонахождения электрона в пространстве
S –
f – облако
Слайд 141 период
Н + 1
1
n=1
S
1 S1
Нe + 2
2
n=1
S
1 S2
Одиночный электрон на незавершенной
2 спаренных электрона на завершенной оболочке
S - элементы
+
+
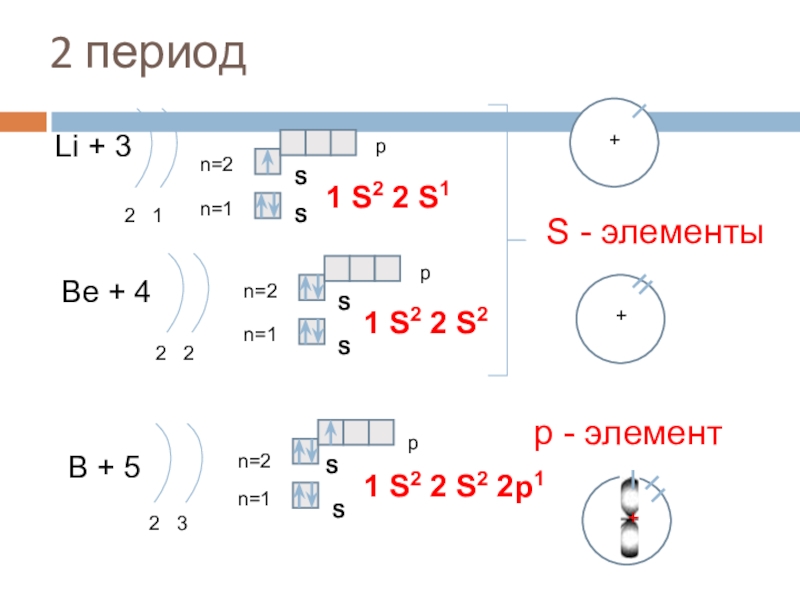
Слайд 152 период
Li + 3
2 1
n=1
n=2
1 S2 2 S1
Be + 4
2
n=1
n=2
1 S2 2 S2
B + 5
2 3
n=1
n=2
1 S2 2 S2 2p1
S - элементы
р - элемент
S
S
S
S
S
S
p
p
p
+
+
+
+
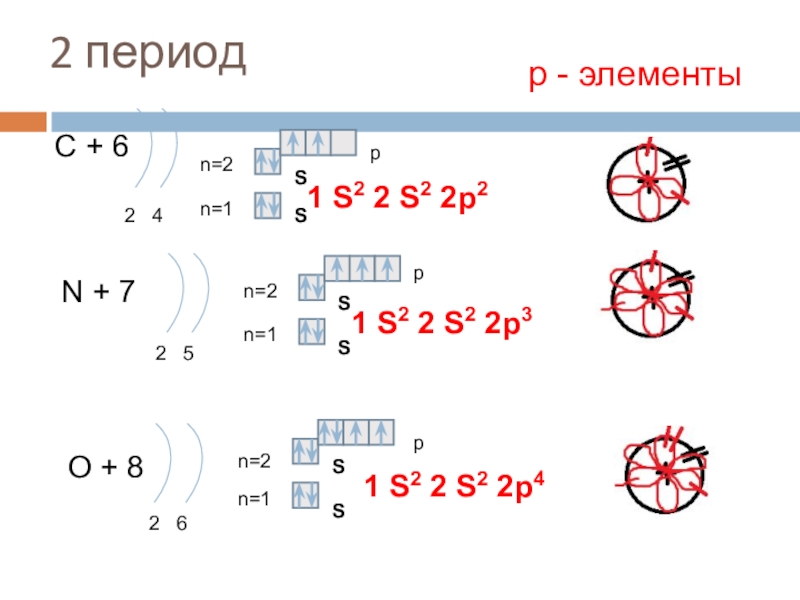
Слайд 162 период
С + 6
2 4
n=1
n=2
N + 7
2 5
n=1
n=2
O +
2 6
n=1
n=2
1 S2 2 S2 2p4
р - элементы
1 S2 2 S2 2p2
1 S2 2 S2 2p3
S
S
S
S
S
S
p
p
p
Слайд 17
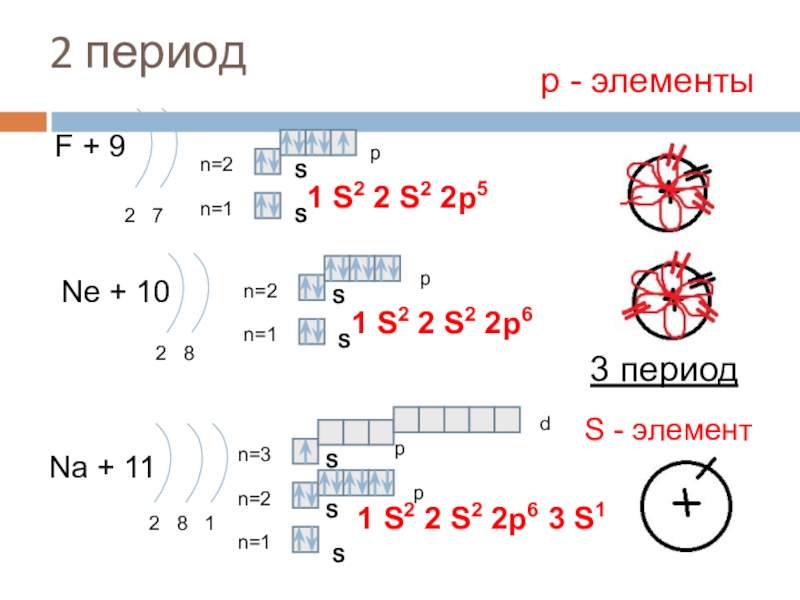
2 период
F + 9
2 7
n=1
n=2
Ne + 10
2 8
n=1
n=2
Na +
2 8 1
n=1
n=2
1 S2 2 S2 2p6 3 S1
р - элементы
1 S2 2 S2 2p5
1 S2 2 S2 2p6
3 период
S - элемент
S
S
S
S
S
S
S
p
p
p
p
d
n=3
Слайд 18
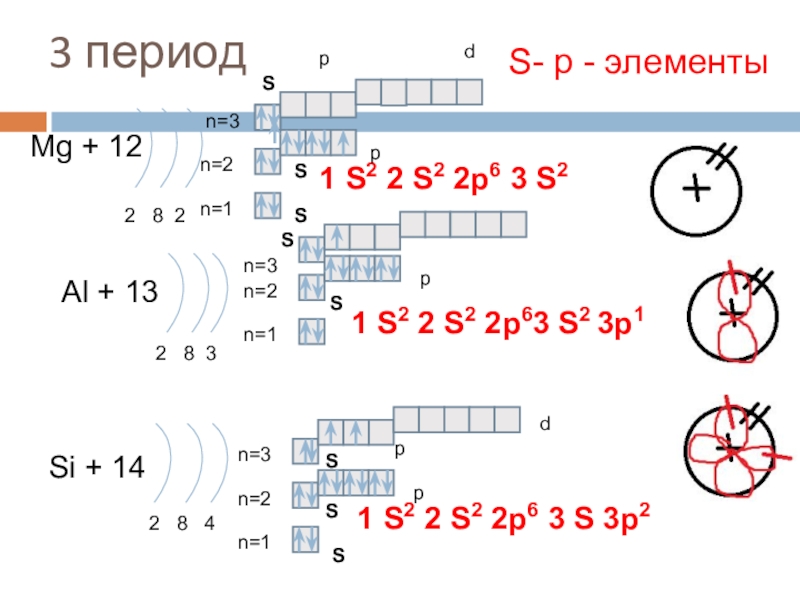
3 период
Mg + 12
2 8 2
n=1
n=2
Al + 13
2 8
n=1
n=2
Si + 14
2 8 4
n=1
n=2
1 S2 2 S2 2p6 3 S 3p2
S- р - элементы
1 S2 2 S2 2p6 3 S2
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p1
Слайд 19
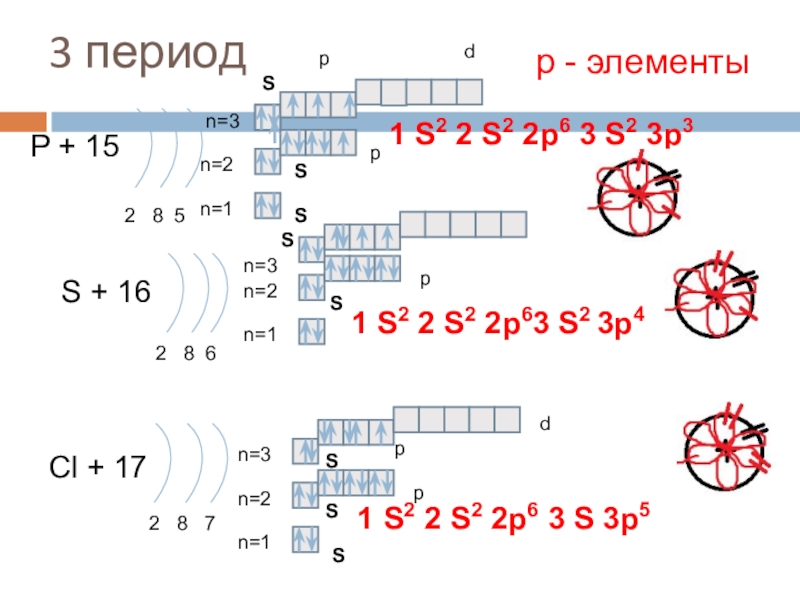
3 период
P + 15
2 8 5
n=1
n=2
S + 16
2 8
n=1
n=2
Cl + 17
2 8 7
n=1
n=2
1 S2 2 S2 2p6 3 S 3p5
р - элементы
1 S2 2 S2 2p6 3 S2 3p3
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p4
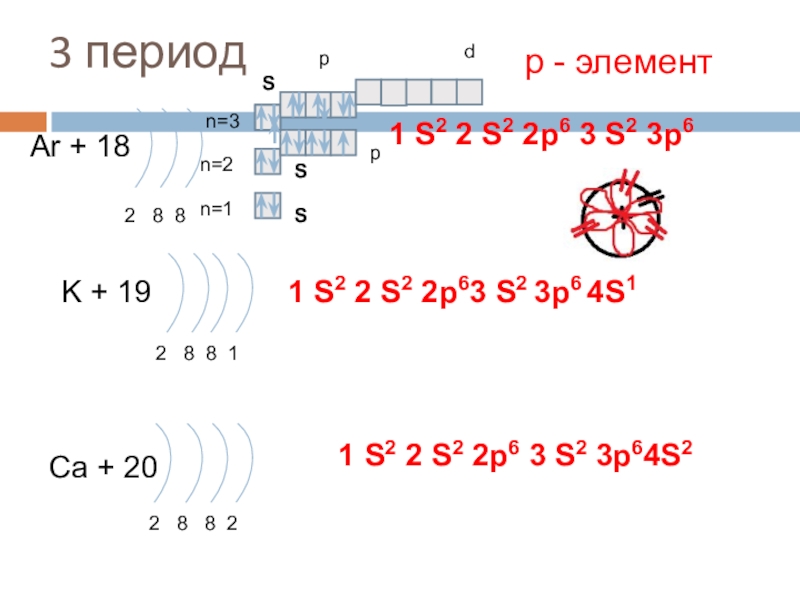
Слайд 203 период
Ar + 18
2 8 8
n=1
n=2
K + 19
2 8
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2
р - элемент
1 S2 2 S2 2p6 3 S2 3p6
1 S2 2 S2 2p63 S2
S
S
p
n=3
S
p
d
3p6 4S1
Слайд 21Выводы
Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней
Одинаковое строение внешних энергетических уровней периодически (т.е. через определенные промежутки - периоды) повторяется, поэтому периодически повторяются и свойства химических элементов