- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атома (8 класс)
Содержание
- 1. Презентация по химии на тему Строение атома (8 класс)
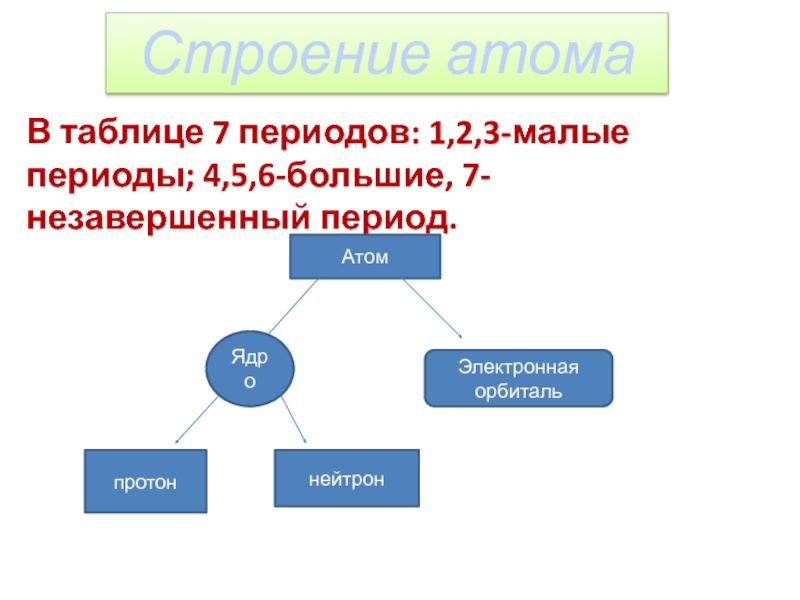
- 2. Строение атомаВ таблице 7 периодов: 1,2,3-малые периоды; 4,5,6-большие, 7-незавершенный период.АтомЯдроЭлектронная орбитальпротоннейтрон
- 3. Период - горизонтальные ряды элементов, которые начинаются
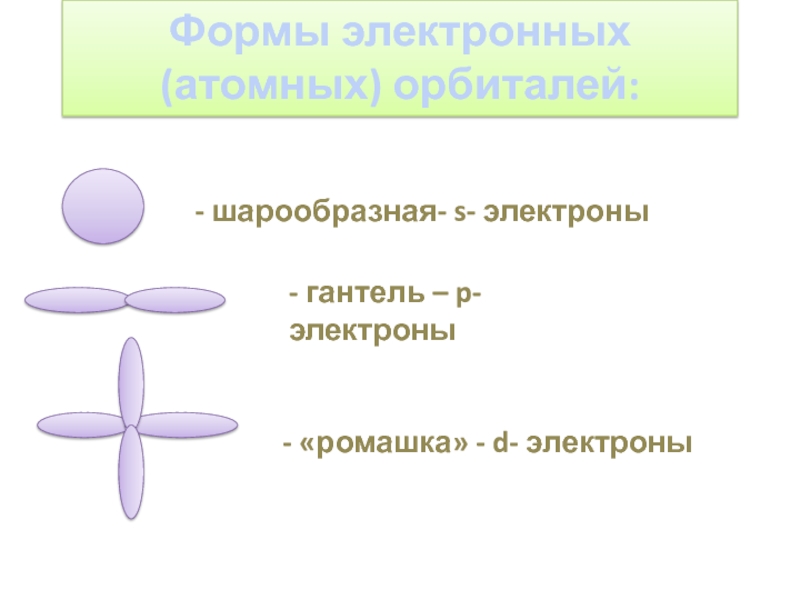
- 4. Формы электронных (атомных) орбиталей:- шарообразная- s- электроны- гантель – p- электроны- «ромашка» - d- электроны
- 5. Разновидности атомов одного и того же элемента
- 6. CL CL35171737N=35-17=18 75%N=37-17=20
- 7. Методика написания электронных и графических формулN=2n2N –
- 8. Принцип Паули – в атоме не может
- 9. Спасибо за внимание!
Строение атомаВ таблице 7 периодов: 1,2,3-малые периоды; 4,5,6-большие, 7-незавершенный период.АтомЯдроЭлектронная орбитальпротоннейтрон
Слайд 2Строение атома
В таблице 7 периодов: 1,2,3-малые периоды; 4,5,6-большие, 7-незавершенный период.
Атом
Ядро
Электронная орбиталь
протон
нейтрон
Слайд 3Период - горизонтальные ряды элементов, которые начинаются активным металлом и заканчиваются
инертным газом.
В периоде металлические свойства ослабевают, неметаллические усиливаются.
Группа – вертикальные столбики элементов
состоящие из главной и побочной подгрупп.
Элементы главной подгруппы входят в большие и малые периоды, а побочной – только в большие.
В периоде металлические свойства ослабевают, неметаллические усиливаются.
Группа – вертикальные столбики элементов
состоящие из главной и побочной подгрупп.
Элементы главной подгруппы входят в большие и малые периоды, а побочной – только в большие.
Слайд 4Формы электронных
(атомных) орбиталей:
- шарообразная- s- электроны
- гантель – p- электроны
-
«ромашка» - d- электроны
Слайд 5Разновидности атомов одного и того же элемента с одинаковым числом протонов,
но разным числом нейтронов.
A=Z+N N=A-Z
A- массовое число,
Z- заряд ядра (порядковый номер элемента)
N- число нейтронов
A=Z+N N=A-Z
A- массовое число,
Z- заряд ядра (порядковый номер элемента)
N- число нейтронов
Изотопы
Слайд 6 CL
CL
35
17
17
37
N=35-17=18
75%
N=37-17=20
25%
35
* 0,75 + 37 * 0,25 = 35,5
Атомная масса химического элемента есть алгебраическая сумма массовых чисел всех его изотопов, взятых в процентном отношении согласно их распространенности в природе.
Слайд 7Методика написания электронных и графических формул
N=2n
2
N – максимальное количество электронов в
периоде,
n – номер периода ( главное квантовое число)
n – номер периода ( главное квантовое число)
n=1 N=2 *1 = 2 ( 1- электронная ячейка)
n =2 N=2*2 = 8 (4-электронные ячейки) и т.д.
2
2
Слайд 8Принцип Паули – в атоме не может быть двух электронов, обладающих
одинаковыми свойствами.
Правило Гунда – в p – ячейках электроны располагаются каждый в отдельной ячейке по одному с одинаковым спином.
Правило Гунда – в p – ячейках электроны располагаются каждый в отдельной ячейке по одному с одинаковым спином.
N
+7
2
5
1 s 2 s p
2
2
3