- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Спирты.Классификация. Строение, свойства .Применение (10 класс)
Содержание
- 1. Презентация по химии на тему Спирты.Классификация. Строение, свойства .Применение (10 класс)
- 2. СnH2n+1OH или
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Общая формула предельного одноатомного спирта ОдноатомныеспиртыCnH2n+1OHR – OHR – алкильная группаCnH2n+2O
- 11. Строение спиртов- содержат функциональную группу «ОН»СН3ОНМетанолR –
- 12. Спирты классифицируются по числу ОН -
- 13. спирты классифицируются по положению ОН-группСпирт первичныйСН3—СН2-СН2
- 14. Гомологический ряд предельных одноатомных спиртовОбщая формула CnH2n+1
- 15. Номенклатура спиртовНумерацию углеродных атомов начинают с того
- 16. Назовём спирты 12342-метилбутанол-2123456
- 17. Изомерия спиртовС4Н10ОИзомерия углеродного скелета СН3 – СН2
- 18. спиртыСвойства, получение
- 19. СпиртыФизические свойства сспиртов:первые представители – жидкости; C12
- 20. 1) На физические свойства спиртов оказывает влияние
- 21. Водородная связьОбразованием межмолекулярных связей между молекулами спиртов
- 22. На физические свойства спиртов оказывает влияние
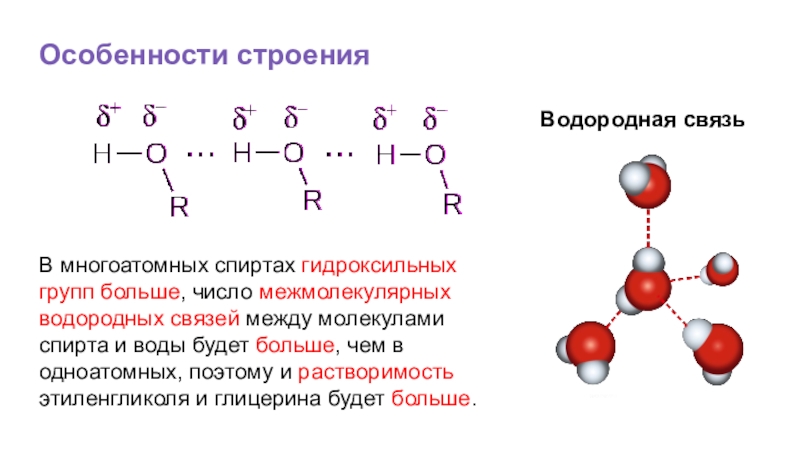
- 23. Особенности строенияВодородная связьВ многоатомных спиртах гидроксильных групп
- 24. химические свойства спиртов. Кислотно-основные свойства спиртов
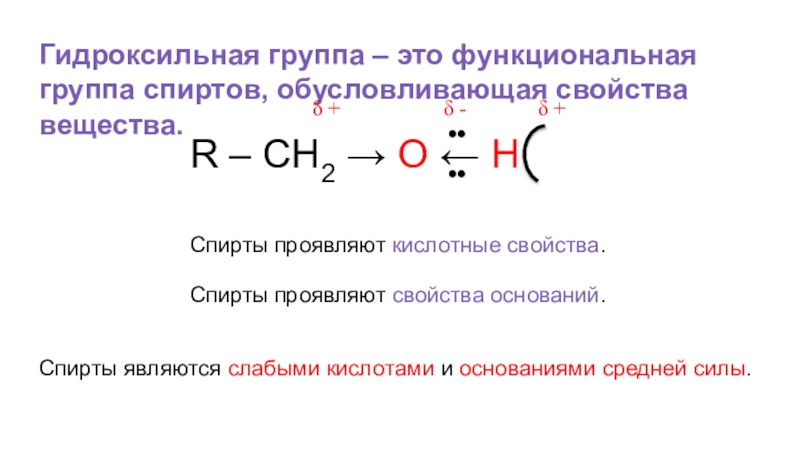
- 25. Гидроксильная группа – это функциональная группа спиртов,
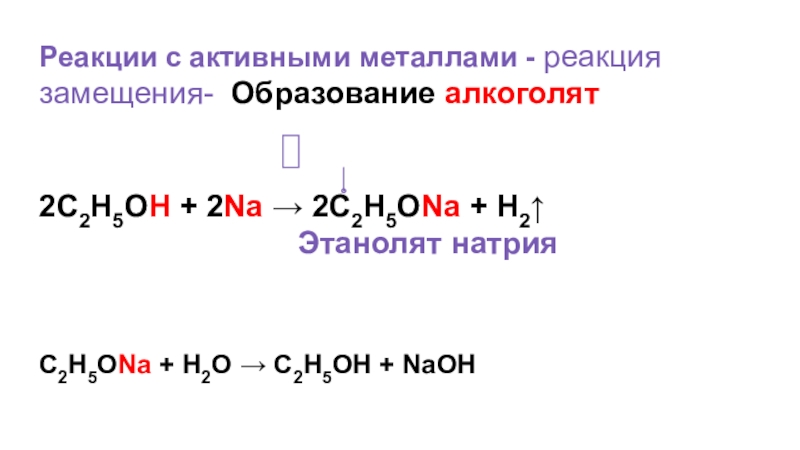
- 26. Реакции с активными металлами - реакция замещения-
- 27. Слайд 27
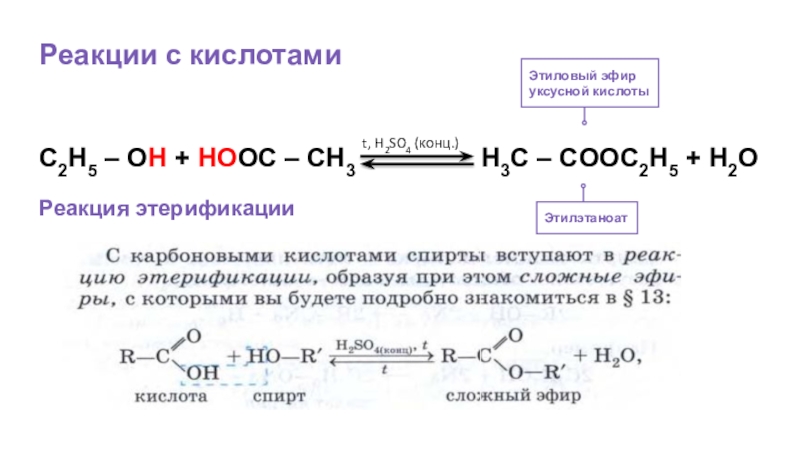
- 28. Реакции с кислотамиЭтилэтаноатЭтиловый эфируксусной кислотыC2H5 – OH
- 29. Слайд 29
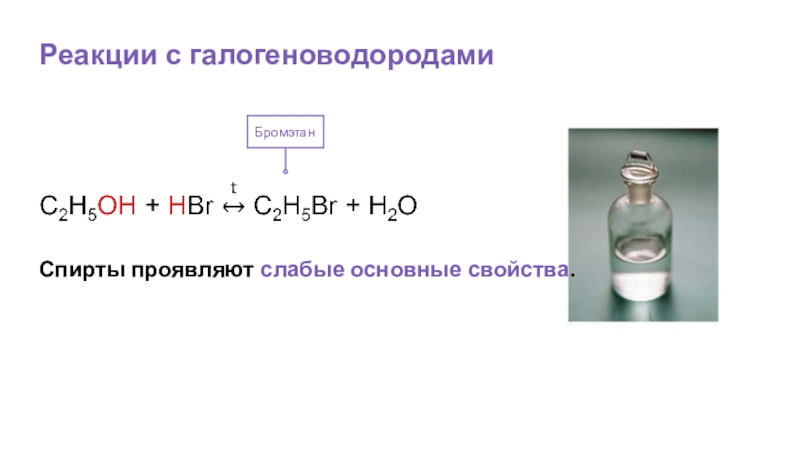
- 30. Реакции с галогеноводородамиБромэтан Спирты проявляют слабые основные свойства.
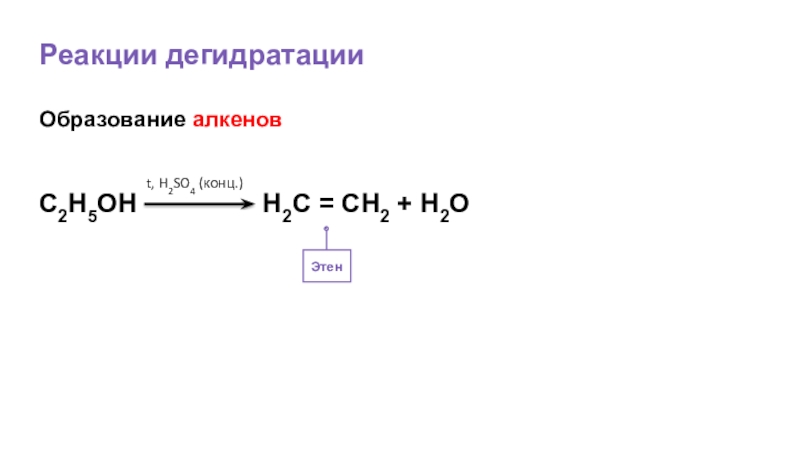
- 31. Реакции дегидратацииОбразование алкенов
- 32. Реакции дегидратацииЭтенОбразование алкеновС2Н5OH
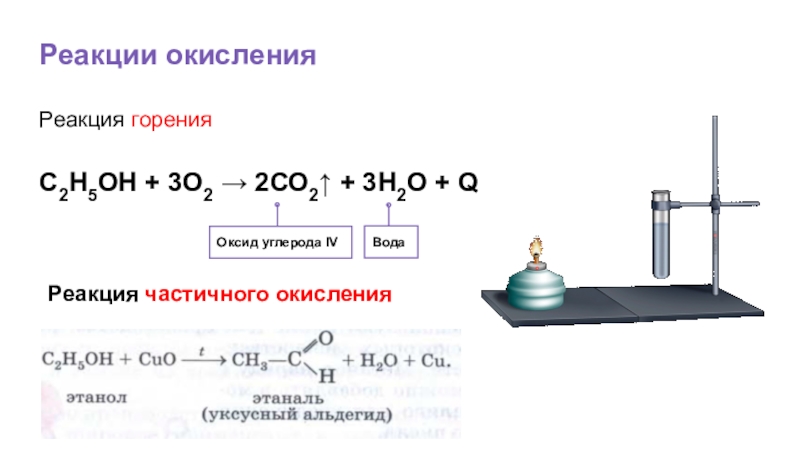
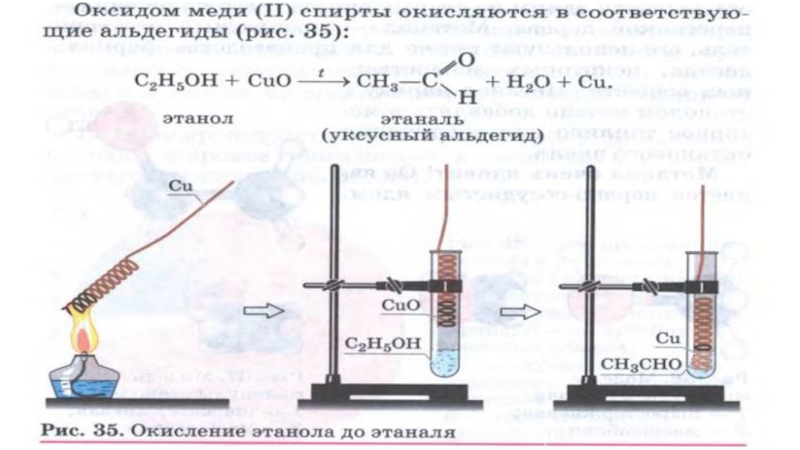
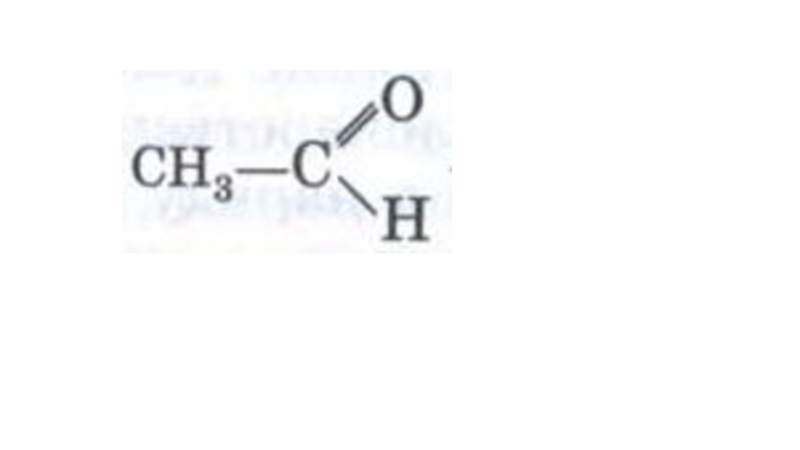
- 33. Реакции окисленияОксид углерода IV Реакция горенияС2Н5ОН + 3О2 → 2СО2↑ + 3Н2О + QВода
- 34. Слайд 34
- 35. Реакции окисленияОксид углерода IV Реакция горенияС2Н5ОН +
- 36. Слайд 36
- 37. Слайд 37
- 38. Особые Химические свойства многоатомных спиртов-Реакции с
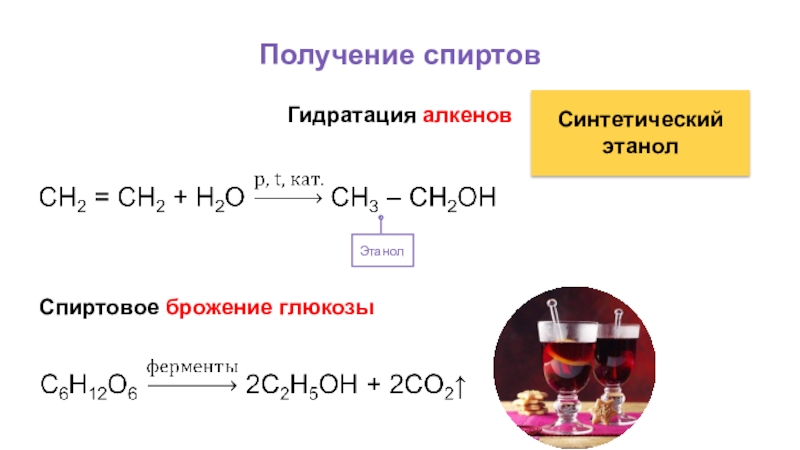
- 39. Получение спиртовГидратация алкеновЭтанол Синтетический этанолСпиртовое брожение глюкозы
- 40. Из целлюлозы получают гидролизный спирт.
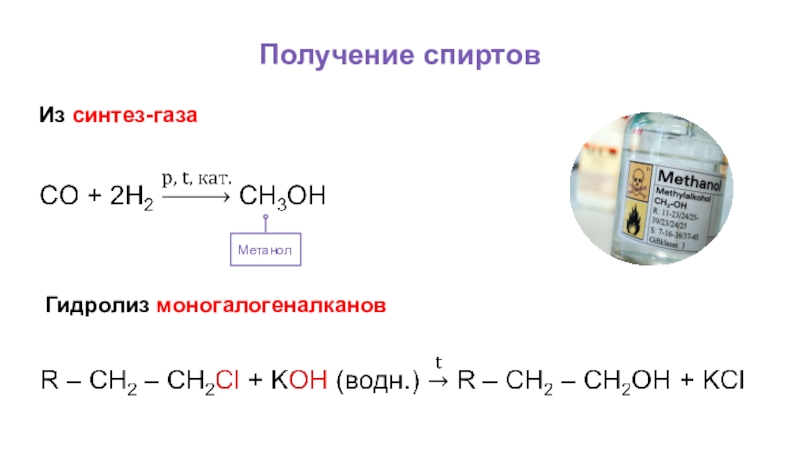
- 41. Получение спиртовИз синтез-газа Метанол Гидролиз моногалогеналканов
- 42. Слайд 42
- 43. Применение метанолаПроизводствоформальдегидаПолучение пластмассСинтезлекарственных веществ
- 44. Метанол являетсяхорошим растворителем.
- 45. Метанол являетсясильным ядом.
- 46. Слайд 46
- 47. Применение этанолаПроизводствоэтилацетатаПолучениеуксусной кислоты
- 48. СпиртыСпиртыСпирт-ректификат – это смесь этанола и воды,
- 49. Этанол оказывает негативное влияние на организм и является наркотиком.
- 50. Длительное употребление этанола приводит к тяжёлым заболеваниями смерти.
- 51. Многоатомныеспирты
- 52. Многоатомные спирты —Многоатомные спиртыэто производные углеводородов, в
- 53. Представители многоатомных спиртовДвухатомные спирты (гликоли) HO –
- 54. Слайд 54
- 55. Слайд 55
- 56. Химические свойства многоатомных спиртовРеакции с нерастворимыми гидроксидамиКачественная
- 57. Химические свойства многоатомных спиртовГлицеринтринитрат,или нитроглицеринРеакции с кислородсодержащими
- 58. Химические свойства многоатомных спиртовТристеаратРеакции с кислородсодержащими минеральными
- 59. Получение многоатомных спиртовВ промышленностиГидролиз жировГлицеринCH2 – O
- 60. Многоатомные спирты являются производными углеводородов, в которых
- 61. Применение этиленгликоляСинтез полимерных материаловПолучение волокна лавсанаВ качестве антифриза
- 62. Применение этиленгликоляПолучение пластификаторовВ лакокрасочной промышленности
- 63. Применение глицеринаПриготовление мазейВ кожевенной промышленностиВ текстильной промышленности
- 64. Применение глицеринаВ косметических средствахКак добавка в зубных пастахИзготовления клея
- 65. Применение глицеринаПолучение антифризовПолучение нитроглицерина
- 66. Применение нитроглицеринаПолучение бездымного порохаПолучение динамитаКак лечебное средство
- 67. Альфред БернхардНобель(1833–1896 гг.)А. Нобель изобрёл динамит, он
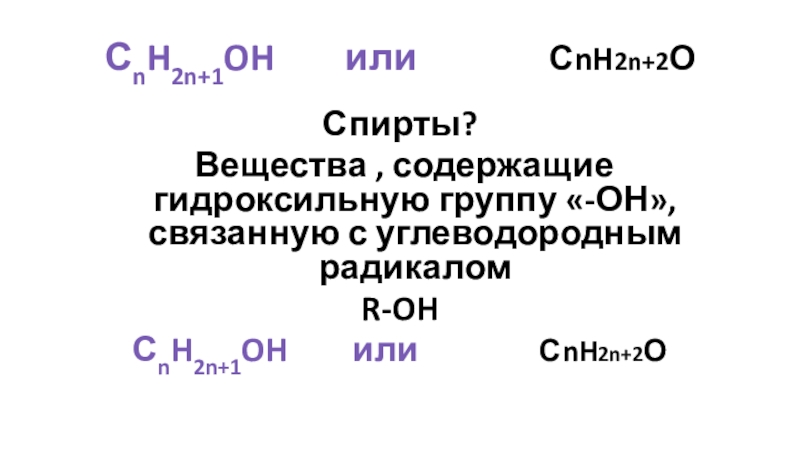
Слайд 2СnH2n+1OH или
Спирты?
Вещества , содержащие гидроксильную группу «-ОН», связанную с углеводородным радикалом
R-OH
СnH2n+1OH или СnH2n+2О
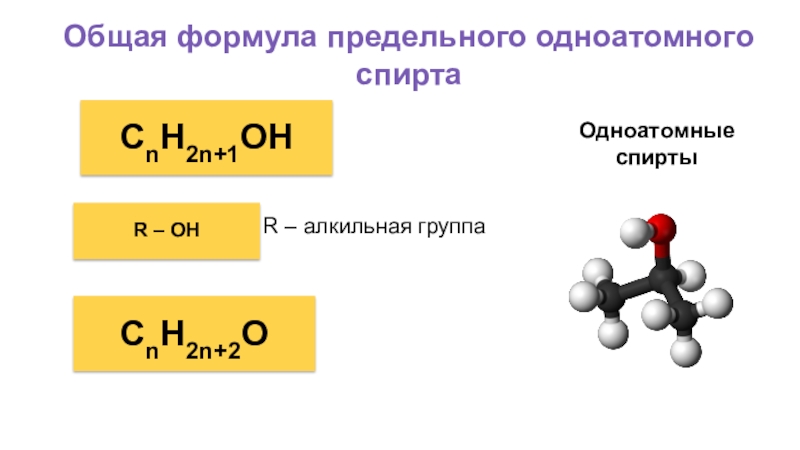
Слайд 10Общая формула предельного одноатомного спирта
Одноатомные
спирты
CnH2n+1OH
R – OH
R – алкильная группа
CnH2n+2O
Слайд 11Строение спиртов- содержат функциональную группу «ОН»
СН3ОН
Метанол
R – CH2 → O ←
• •
• •
δ +
δ +
δ -
Связи О – Н и С – O являются полярными.
Одноатомные
спирты
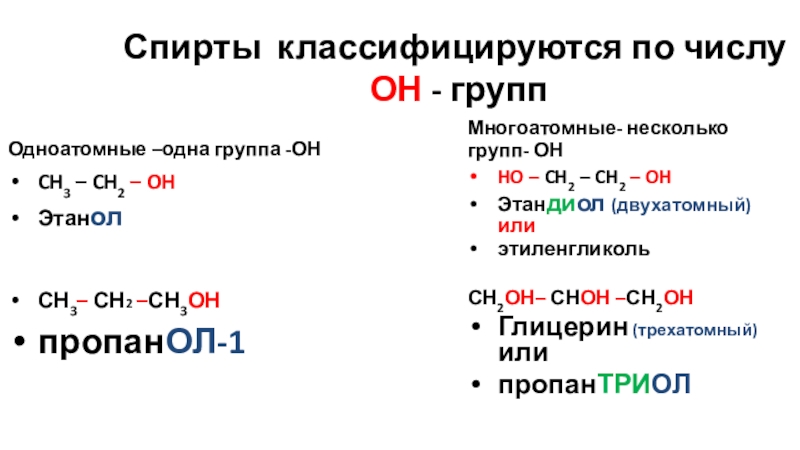
Слайд 12Спирты классифицируются по числу
ОН - групп
Одноатомные –одна группа -ОН
CH3 –
Этанол
СН3– СН2 –СН3ОН
пропанОЛ-1
Многоатомные- несколько групп- ОН
HO – CH2 – CH2 – OH
Этандиол (двухатомный) или
этиленгликоль
СН2ОН– СНОН –СН2ОН
Глицерин (трехатомный) или
пропанТРИОЛ
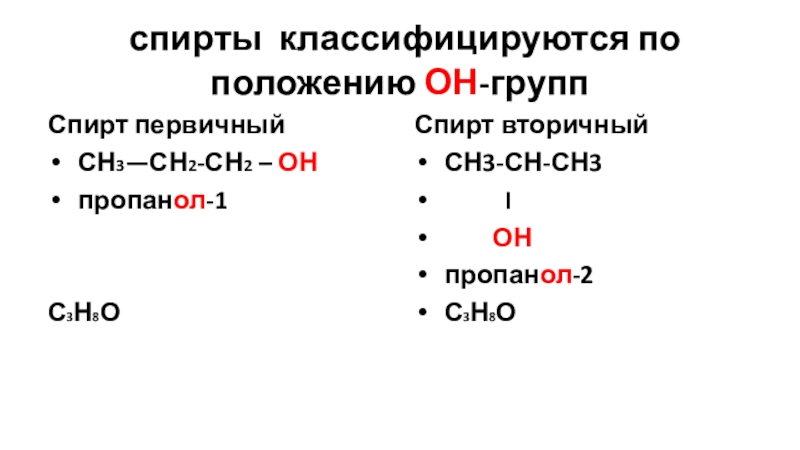
Слайд 13 спирты классифицируются по положению ОН-групп
Спирт первичный
СН3—СН2-СН2 – ОН
пропанол-1
С3Н8О
Спирт вторичный
СН3-СН-СН3
ОН
пропанол-2
С3Н8О
Слайд 14Гомологический ряд предельных одноатомных спиртов
Общая формула CnH2n+1 OH
Одноатомный спирт
Название спирта
СН3СН2СН2OH
CH3OH
Метанол
(метиловый спирт)
С2Н5OH
Этанол
(этиловый спирт)
Пропанол-1
(пропиловый спирт)
Названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов с добавлением суффикса -ол-.
Слайд 15Номенклатура спиртов
Нумерацию углеродных атомов начинают с того конца, ближе к которому
Названия спиртов образуются добавлением суффикса -ол- к
названию соответствующего алкана.
Затем цифрой указывают положение гидроксильной группы
СН3 – СН2 – СН – СН3 Бутанол-2
|
ОН
СН3 – СН2 – СН2 – СН2ОН бутанол-1
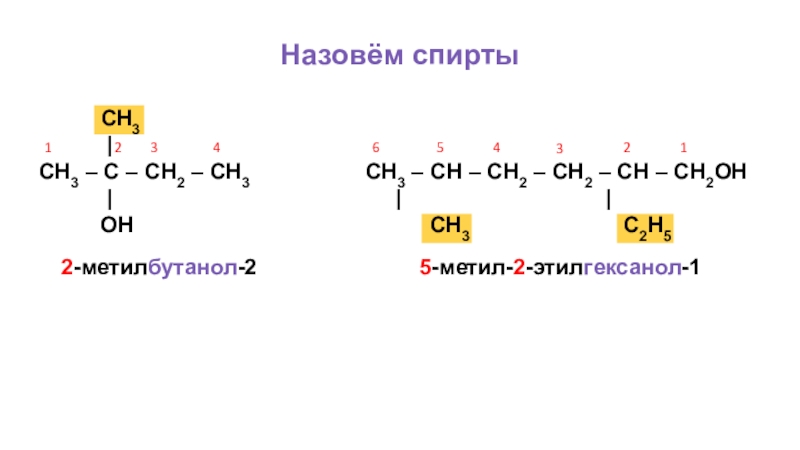
Слайд 16Назовём спирты
1
2
3
4
2-метилбутанол-2
1
2
3
4
5
6
СН3
СН3 – С – СН2 – СН3 СН3 – СН – СН2 – СН2 – СН – СН2ОН
| | |
ОН СН3 С2Н5
5-метил-2-этилгексанол-1
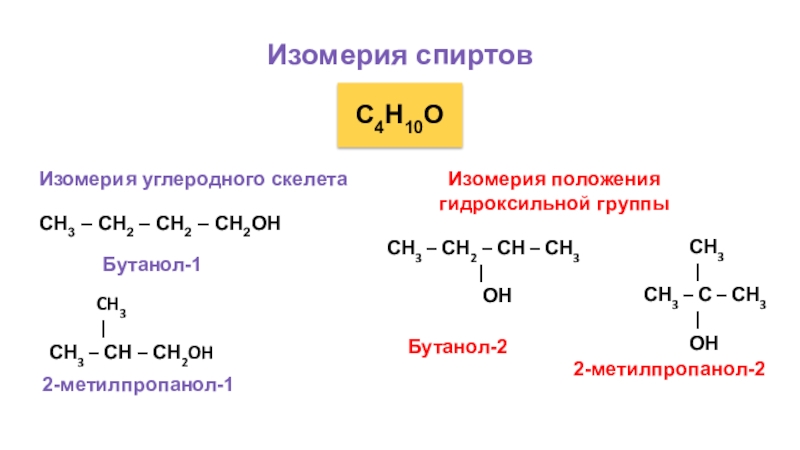
Слайд 17Изомерия спиртов
С4Н10О
Изомерия углеродного скелета
СН3 – СН2 – СН2 – СН2ОН
|
СН3 – СН – СН2OH
Бутанол-1
2-метилпропанол-1
Изомерия положения
гидроксильной группы
СН3 – СН2 – СН – СН3
|
ОН
СН3
| СН3 – С – СН3
|
ОН
Бутанол-2
2-метилпропанол-2
Слайд 19Спирты
Физические свойства сспиртов:
первые представители – жидкости; C12 и больше атомов углерода
газы среди спиртов отсутствуют.
Низшие спирты обладают
характерным алкогольным запахом
Спирты, стоящие в середине гомологического ряда, имеют сильный и неприятный запах
Смешиваются С
Смешиваются с водой в любых соотношениях. Средние спирты ограниченно растворимы в воде.
С возрастанием молекулярной массы растворимость спиртов в воде уменьшается
;
Слайд 201) На физические свойства спиртов оказывает влияние водородная связь.
2) Кислотно-основные
Спирты взаимодействуют со
А) щелочными металлами,
Б) галогеноводородами,
В) кислотами,
вступают в реакции
Г) дегидратации
Д) окисления.
В промышленных масштабах этанол получают
гидратацией этена, в процессе спиртового брожения глюкозы.
Метанол получают из синтез-газа.
В лаборатории спирты получают в процессе щелочного гидролиза моногалогеналканов
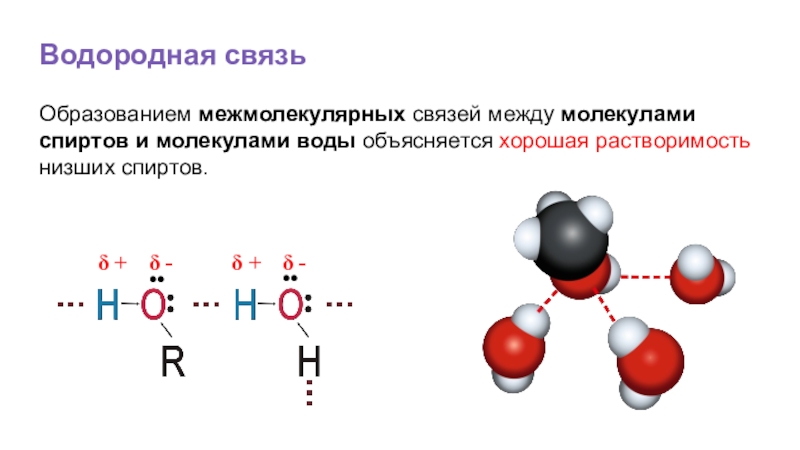
Слайд 21Водородная связь
Образованием межмолекулярных связей между молекулами спиртов и молекулами воды объясняется
δ +
δ +
δ -
δ -
••
••
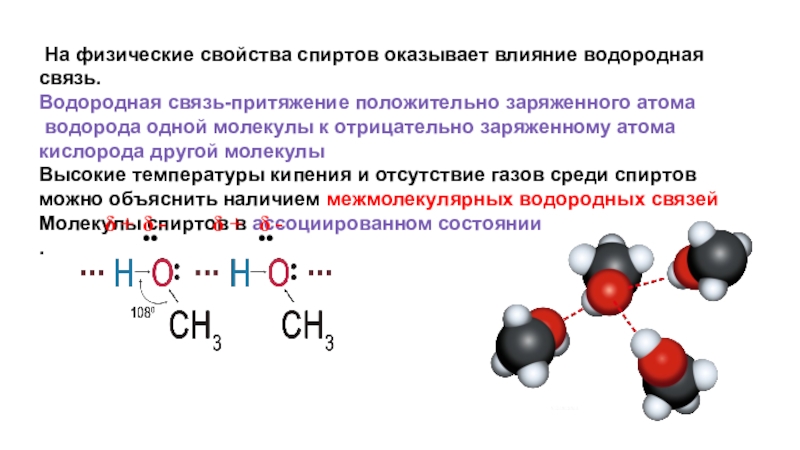
Слайд 22 На физические свойства спиртов оказывает влияние водородная связь.
Водородная связь-притяжение положительно
водорода одной молекулы к отрицательно заряженному атома кислорода другой молекулы
Высокие температуры кипения и отсутствие газов среди спиртов можно объяснить наличием межмолекулярных водородных связей
Молекулы спиртов в ассоциированном состоянии
.
δ +
δ +
δ -
δ -
••
••
Слайд 23Особенности строения
Водородная связь
В многоатомных спиртах гидроксильных групп больше, число межмолекулярных водородных
Слайд 24 химические свойства спиртов.
Кислотно-основные свойства спиртов обусловлены наличием функциональной группы.
Спирты взаимодействуют со
А) щелочными металлами: Na, K
Б) галогеноводородами: HCl, HBr, HI
В) кислотами:CH3COOH, HNO3
вступают в реакции
Г)дегидратации:отщепление воды - H2O(в присутствии концентр.H2SO4, t0)
Д) окисления: +CuO, Cu (t0),
В промышленных масштабах этанол получают
гидратацией этена, в процессе спиртового брожения глюкозы.
Метанол получают из синтез-газа.
В лаборатории спирты получают в процессе щелочного гидролиза моногалогеналканов
Слайд 25Гидроксильная группа – это функциональная группа спиртов, обусловливающая свойства вещества.
R –
δ +
δ +
δ -
Спирты проявляют кислотные свойства.
••
••
Спирты проявляют свойства оснований.
Спирты являются слабыми кислотами и основаниями средней силы.
Слайд 26Реакции с активными металлами - реакция замещения- Образование алкоголят
2C2H5OH +
Этанолят натрия
C2H5ONa + H2O → C2H5OH + NaOH
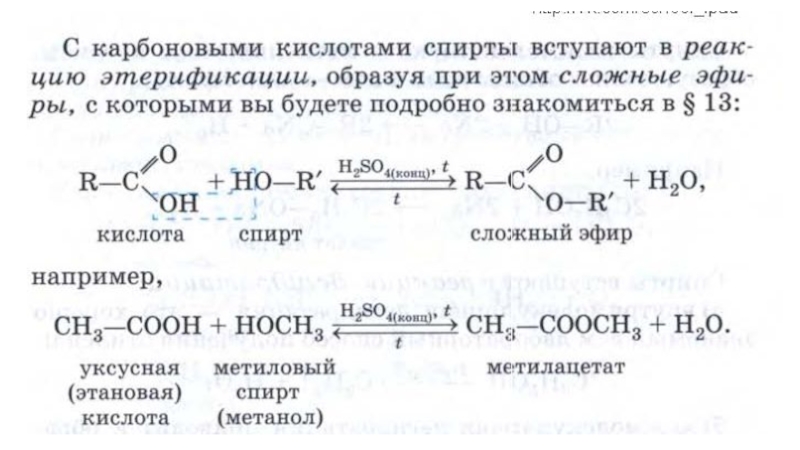
Слайд 28Реакции с кислотами
Этилэтаноат
Этиловый эфир
уксусной кислоты
C2H5 – OH + HOOC – CH3
t, H2SO4 (конц.)
Реакция этерификации
║
O
Слайд 35Реакции окисления
Оксид углерода IV
Реакция горения
С2Н5ОН + 3О2 → 2СО2↑ +
Вода
Реакция частичного окисления
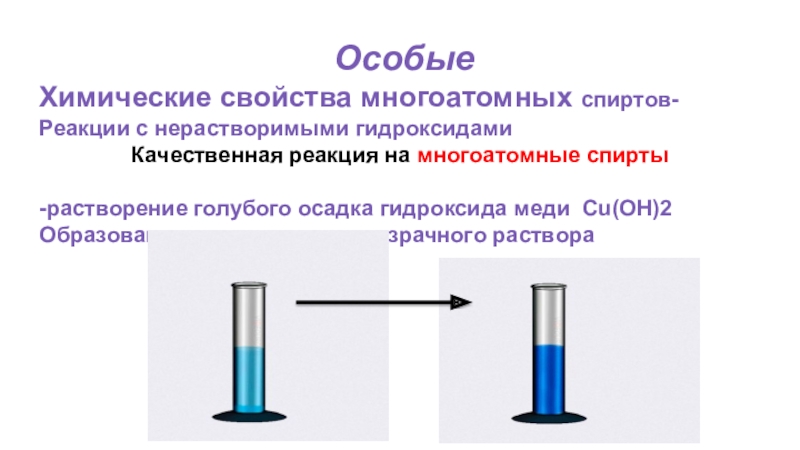
Слайд 38 Особые
Химические свойства многоатомных спиртов-
Реакции с нерастворимыми гидроксидами
Качественная реакция на
-растворение голубого осадка гидроксида меди Cu(OH)2
Образование ярко – синего прозрачного раствора
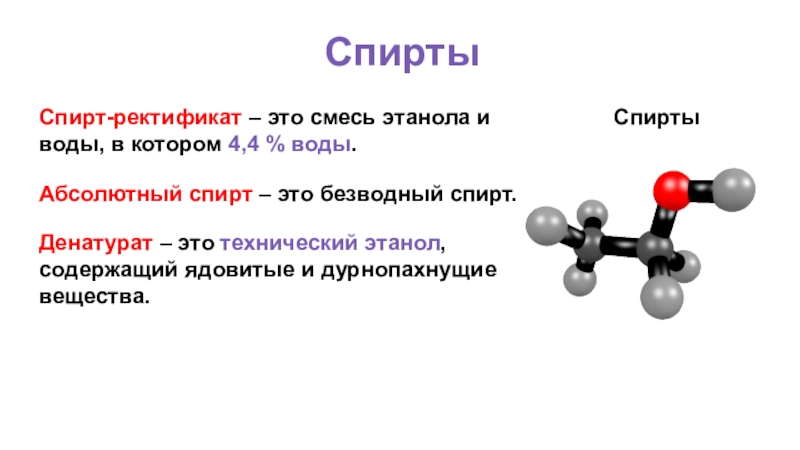
Слайд 48Спирты
Спирты
Спирт-ректификат – это смесь этанола и воды, в котором 4,4 %
Абсолютный спирт – это безводный спирт.
Денатурат – это технический этанол, содержащий ядовитые и дурнопахнущие вещества.
Слайд 52Многоатомные спирты —
Многоатомные спирты
это производные углеводородов, в молекулах которых два и
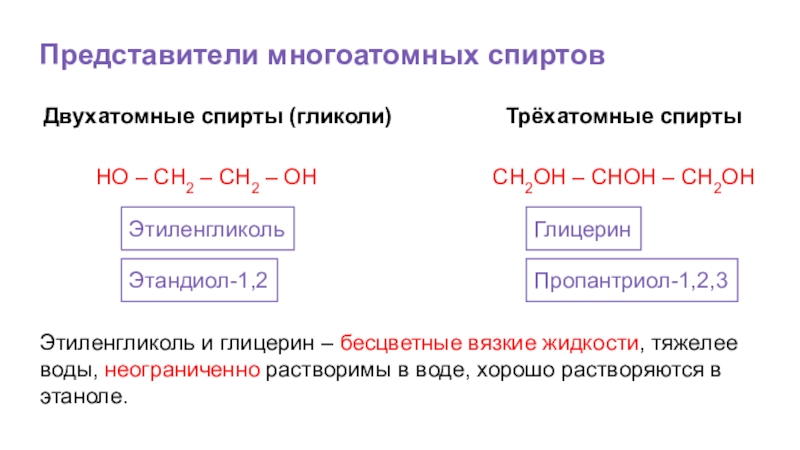
Слайд 53Представители многоатомных спиртов
Двухатомные спирты (гликоли)
HO – CH2 – CH2 –
Этиленгликоль
Этандиол-1,2
Трёхатомные спирты
СН2ОН – СНОН – СН2ОН
Глицерин
Пропантриол-1,2,3
Этиленгликоль и глицерин – бесцветные вязкие жидкости, тяжелее воды, неограниченно растворимы в воде, хорошо растворяются в этаноле.
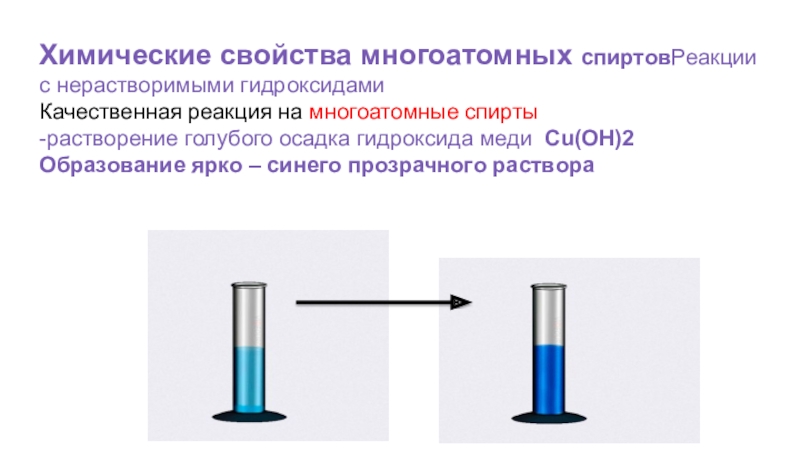
Слайд 56Химические свойства многоатомных спиртовРеакции с нерастворимыми гидроксидами
Качественная реакция на многоатомные спирты
-растворение
Образование ярко – синего прозрачного раствора
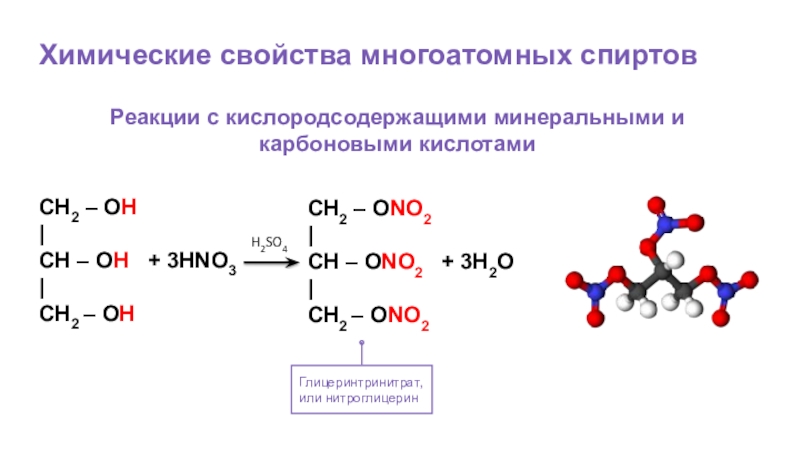
Слайд 57Химические свойства многоатомных спиртов
Глицеринтринитрат,
или нитроглицерин
Реакции с кислородсодержащими минеральными и карбоновыми кислотами
CH2
|
CH – OH + 3HNO3
|
CH2 – OH
CH2 – ONO2
|
CH – ONO2 + 3H2O
|
CH2 – ONO2
H2SO4
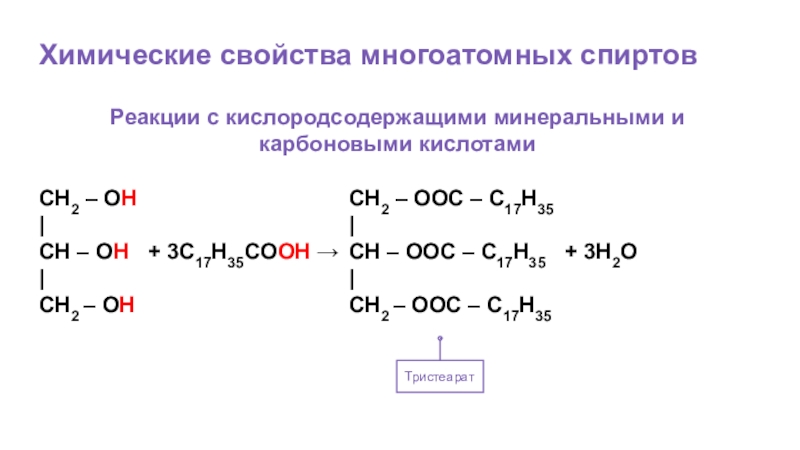
Слайд 58Химические свойства многоатомных спиртов
Тристеарат
Реакции с кислородсодержащими минеральными и карбоновыми кислотами
CH2 –
|
CH – OH + 3C17H35COOH →
|
CH2 – OH
CH2 – OOC – C17H35
|
CH – OOC – C17H35 + 3H2O
|
CH2 – OOC – C17H35
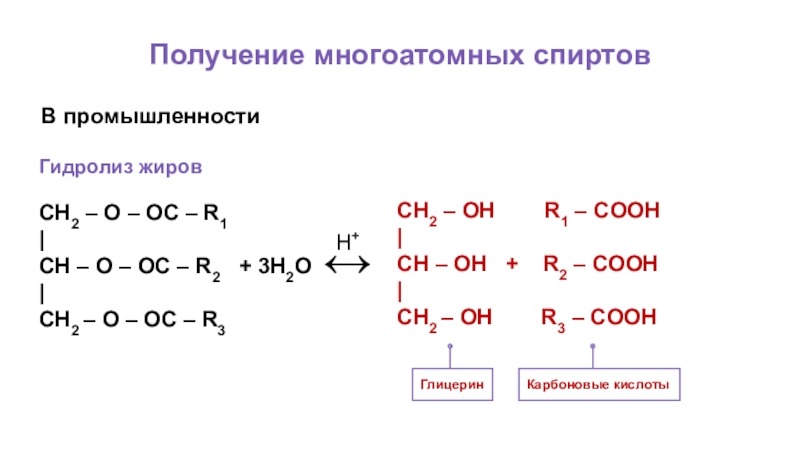
Слайд 59Получение многоатомных спиртов
В промышленности
Гидролиз жиров
Глицерин
CH2 – O – OC – R1
|
CH
|
CH2 – O – OC – R3
↔
H+
CH2 – OH R1 – COOH
|
CH – OH + R2 – COOH
|
CH2 – OH R3 – COOH
Карбоновые кислоты
Слайд 60Многоатомные спирты являются производными углеводородов, в которых содержится несколько гидроксильных групп.
Многоатомные спирты взаимодействуют с активными металлами, гидроксидами тяжёлых металлов, кислотами.
Многоатомные спирты имеют широкое применение во многих областях народного хозяйства.
Качественной реакцией на многоатомные спирты является реакция с гидроксидом меди (II).