- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Спирты- кислородосодержащие органические соединения
Содержание
- 1. Презентация по химии на тему Спирты- кислородосодержащие органические соединения
- 2. Спирты –
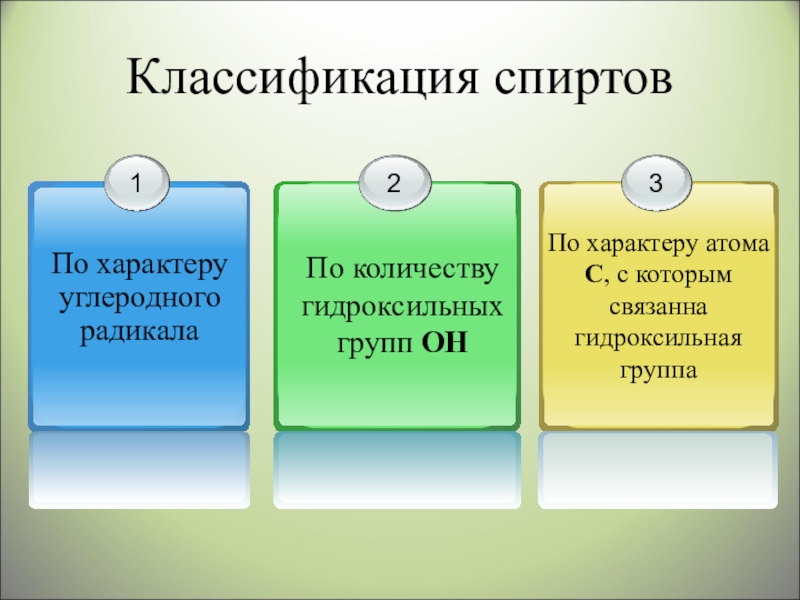
- 3. Классификация спиртов
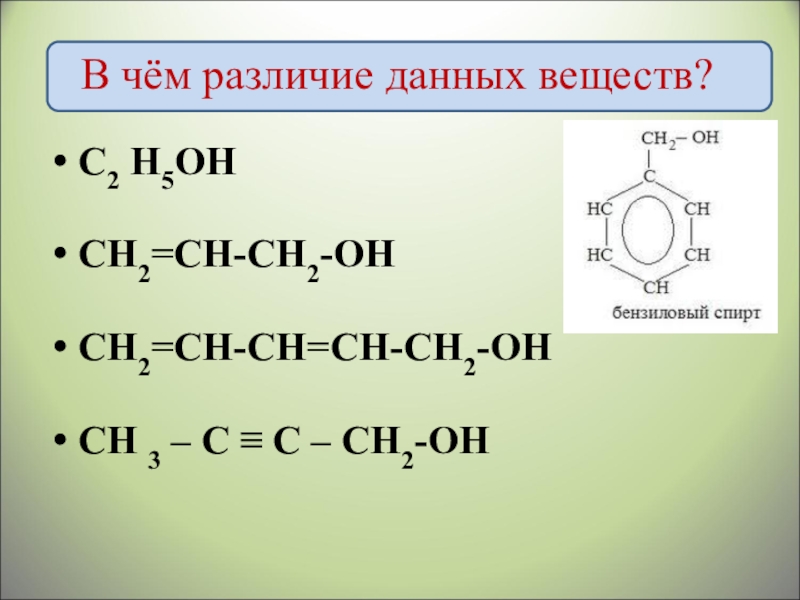
- 4. В чём различие данных веществ?С2 Н5ОНCH2=CH-CH2-OHCH2=CH-CH=CH-CH2-OH
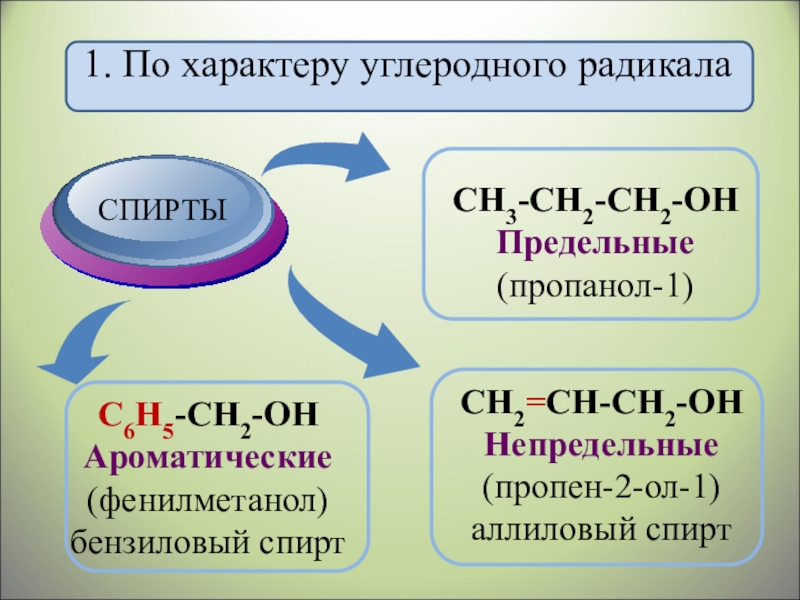
- 5. 1. По характеру углеродного радикала
- 6. В чём различие данных веществ?С2 Н5ОНС Н2ОН
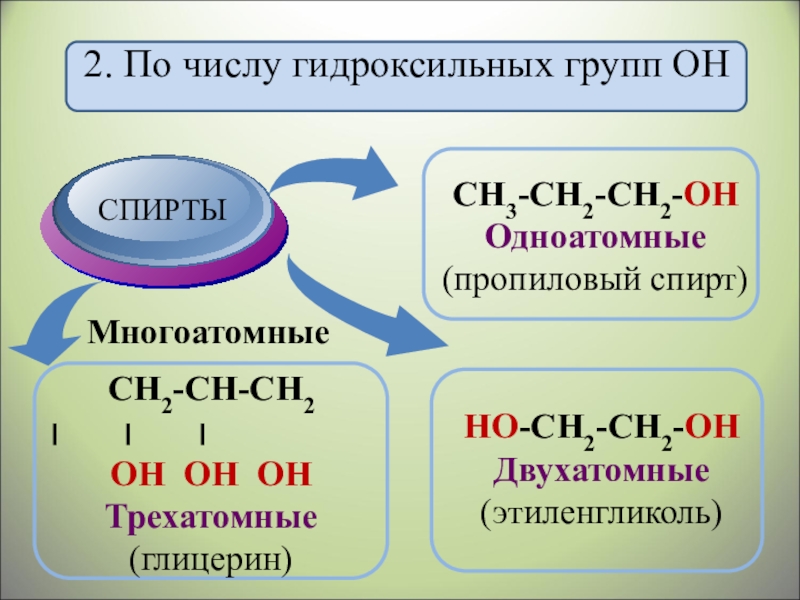
- 7. 2. По числу гидроксильных групп ОН Многоатомные
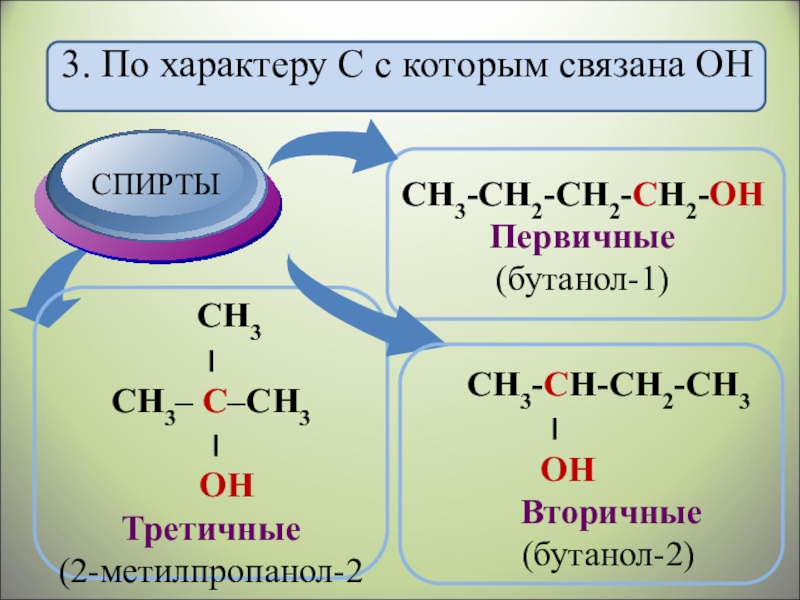
- 8. 3. По характеру С с которым связана ОН
- 9. Предельные одноатомные cпирты (Алканолы) Общая формулаC n
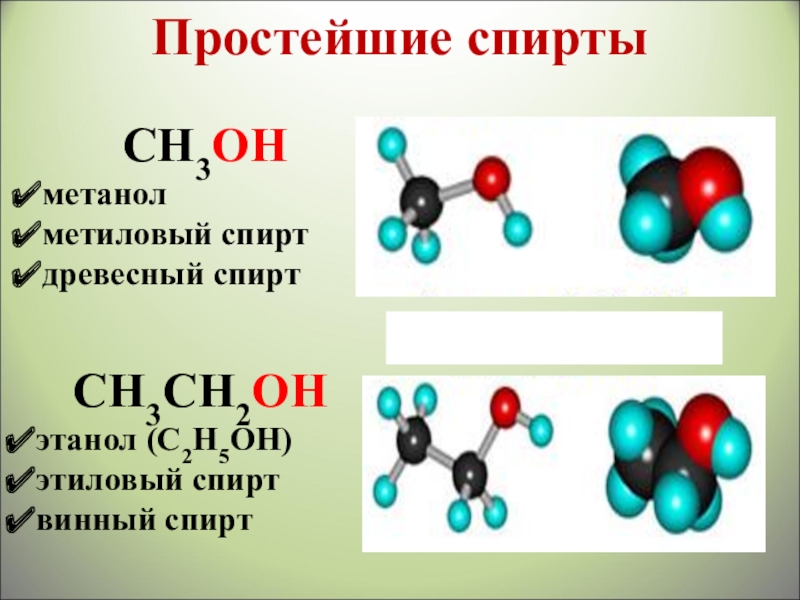
- 10. СН3ОН метанол метиловый спиртдревесный спиртСН3СН2ОН этанол (С2Н5ОН)этиловый спиртвинный спиртПростейшие cпирты
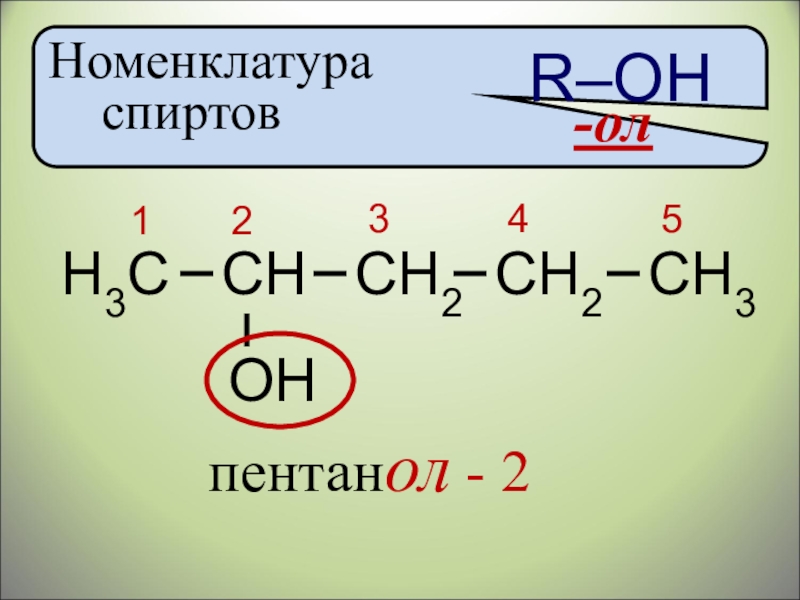
- 11. Номенклатура спиртовR–ОН-олН3ССНСН2СН3ОН12345СН2пентанол - 2
- 12. СH3 – C = CH – CH
- 13. СН3-СН2-СН2-СН2 -ОНСН3 – СН – СН2 -ОНБутанол
- 14. Предельные одноатомные cпирты СН3 - СН2 -
- 15. СН3СН2 – О - СН2СН3Бутанол-1
- 16. Предельные одноатомные cпирты СН3 - СН2 -
- 17. Предельные одноатомные cпирты
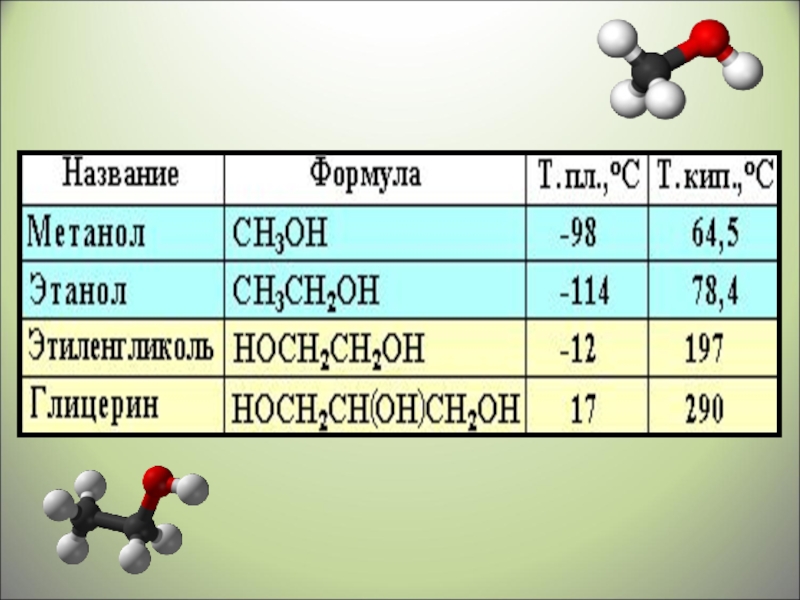
- 18. Физические свойства спиртовАлканолы - бесцветные жидкости (С1-С11) или кристаллические твердые вещества (С12-С…) с характерным запахом.
- 19. Предельные одноатомные cпирты …О - Н…О -
- 20. Слайд 20
- 21. Бесцветная жидкость с температурой кипения 64,5 0С,
- 22. Этанол С2Н5ОНБесцветная жидкость с температурой кипения
- 23. Функциональная группа спиртовПри смещении электронной плотности от
- 24. Химические свойства алканолов1. Взаимодействие с актив. МеI.
- 25. R – C
- 26. 3. Взаимодействие с галогеноводородами(НСl, HBr, HI)R-ОН +
- 27. II. Реакции отщепления (элиминирования)4. Межмолекулярная дегидратацияR-ОН +
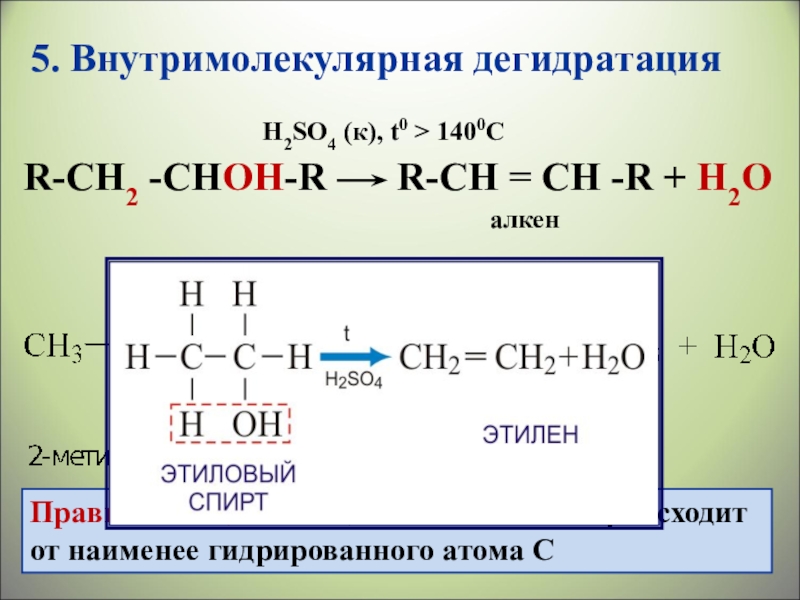
- 28. 5. Внутримолекулярная дегидратацияR-СН2 -СHОН-R
- 29. 6. Дегидратация и дегидрирование этанола(реакция Лебедева →
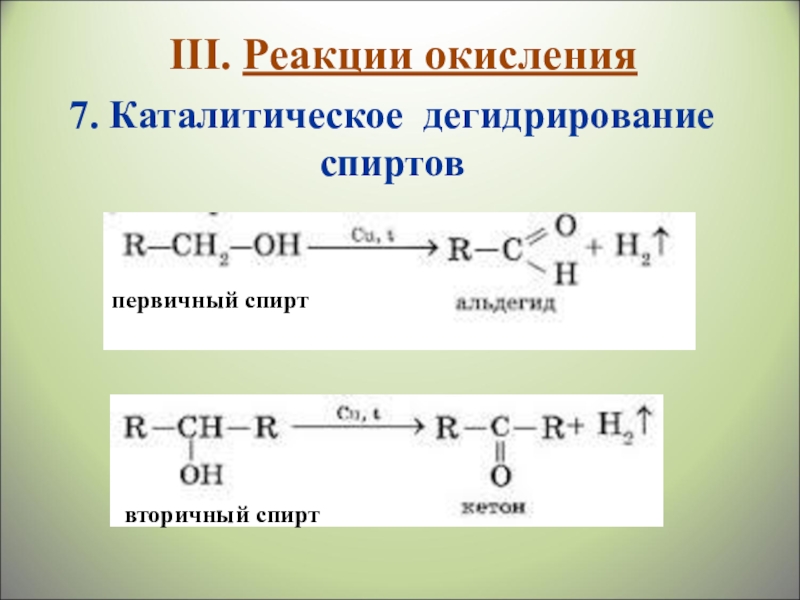
- 30. 7. Каталитическое дегидрирование спиртовпервичный спиртвторичный спиртIII. Реакции окисления
- 31. 8. Реакция горенияГорят не коптящим светящимся пламенем.
- 32. CH3 – CH2 – OH + CuO
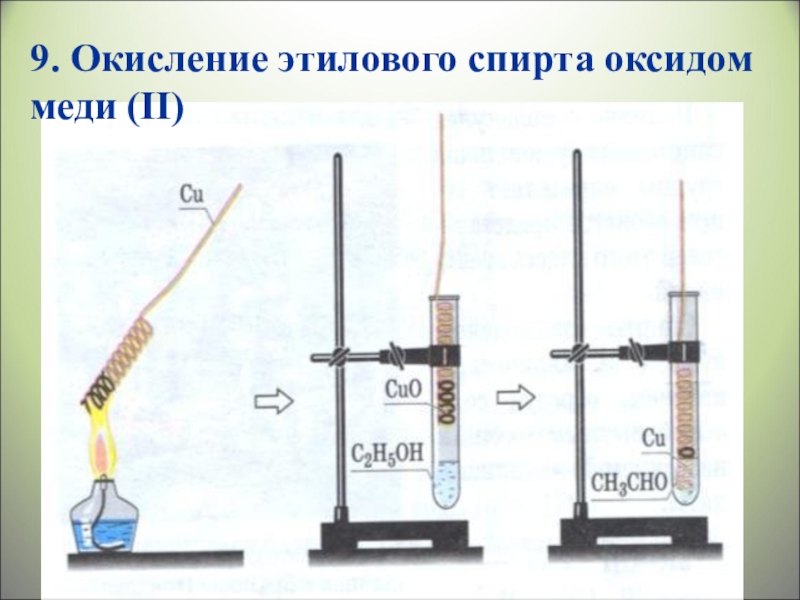
- 33. 9. Окисление этилового спирта оксидом меди (II)
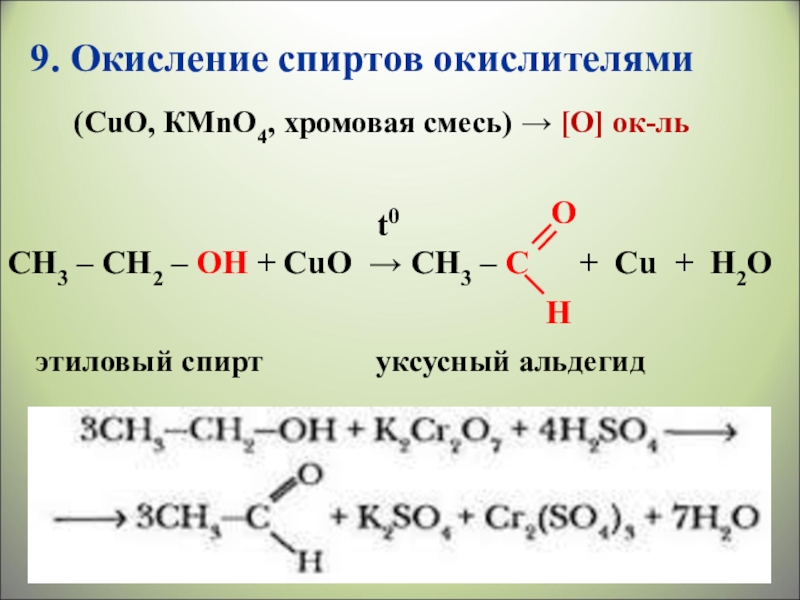
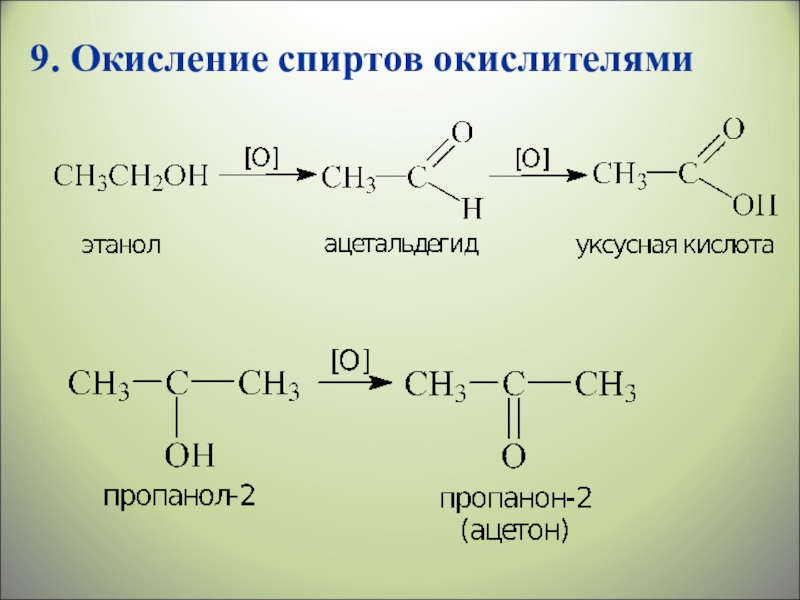
- 34. 9. Окисление спиртов окислителями
- 35. Способы получения (общие) 1. Гидролиз галогеналканов2. Гидратация алкенов (правило Марковникова!)3. Гидрирование альдегидов и кетонов (реакция восстановления)
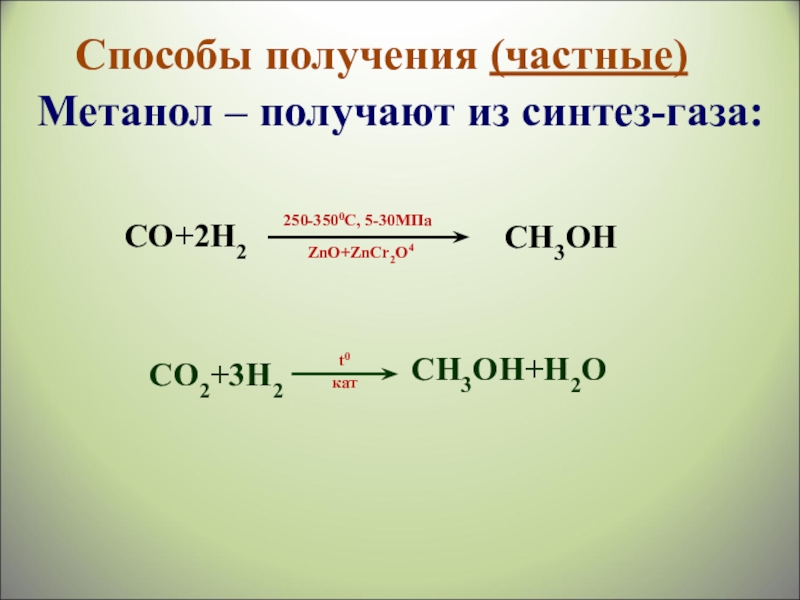
- 36. Способы получения (частные) Метанол – получают из синтез-газа:
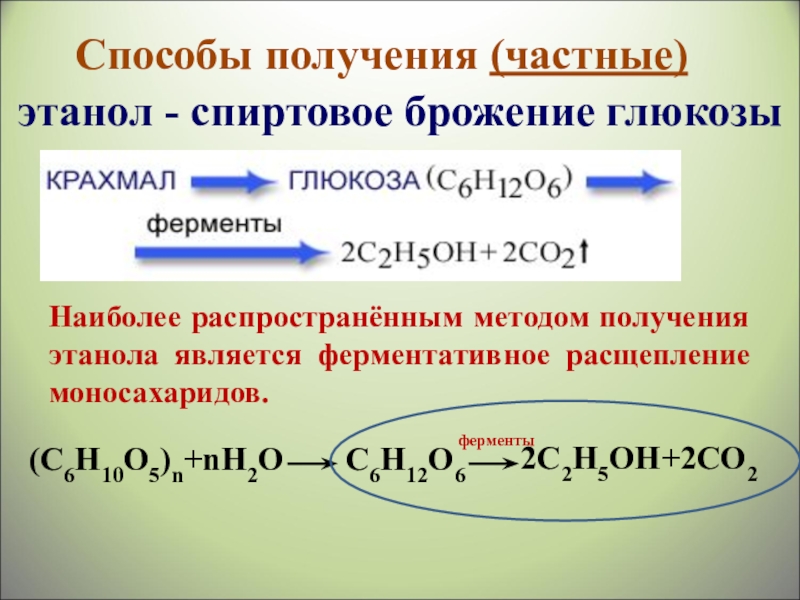
- 37. Наиболее распространённым методом получения этанола является ферментативное
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Задумайся над кадром!
- 43. Домашнее задание:§ 17 № 1, 2, 9, 10Удачи!
Слайд 1
Кислородсодержащие органические
вещества
(Спирты)
Бутырева Галина Юрьевна, учитель химии
МКОУ «СОШ №2
Слайд 2
Спирты – это производные углеводородов, содержащие
n
Слайд 6
В чём различие данных веществ?
С2 Н5ОН
С Н2ОН - СН2ОН
С Н2ОН -
|
ОН
СН 2 - СН - С Н – СН - СН – СН2
| | | | | |
ОН ОН ОН ОН ОН ОН
Слайд 9Предельные одноатомные cпирты (Алканолы)
Общая формула
C n H 2n + 1
где R- предельный углеводородный радикал
метанол
этанол
пропанол
бутанол-1
СН3ОН
С2Н5ОН
С3Н7ОН
С4Н9ОН
Слайд 10
СН3ОН
метанол
метиловый спирт
древесный спирт
СН3СН2ОН
этанол (С2Н5ОН)
этиловый спирт
винный спирт
Простейшие cпирты
Слайд 12СH3 – C = CH – CH – СН2─ОH
CH3 ОH
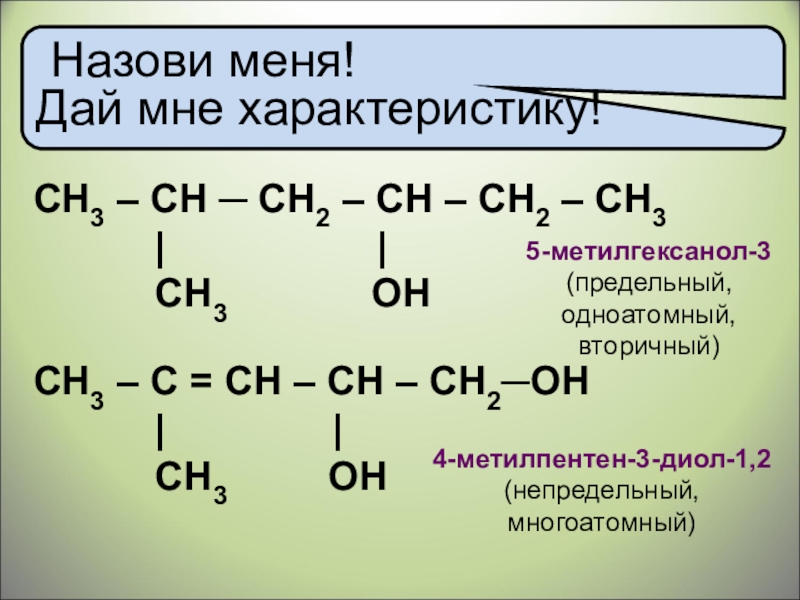
Назови меня!
Дай мне характеристику!
СH3 – CН ─ CH2 – CH – CH2 – СН3
| |
CH3 ОH
5-метилгексанол-3
(предельный, одноатомный, вторичный)
4-метилпентен-3-диол-1,2
(непредельный, многоатомный)
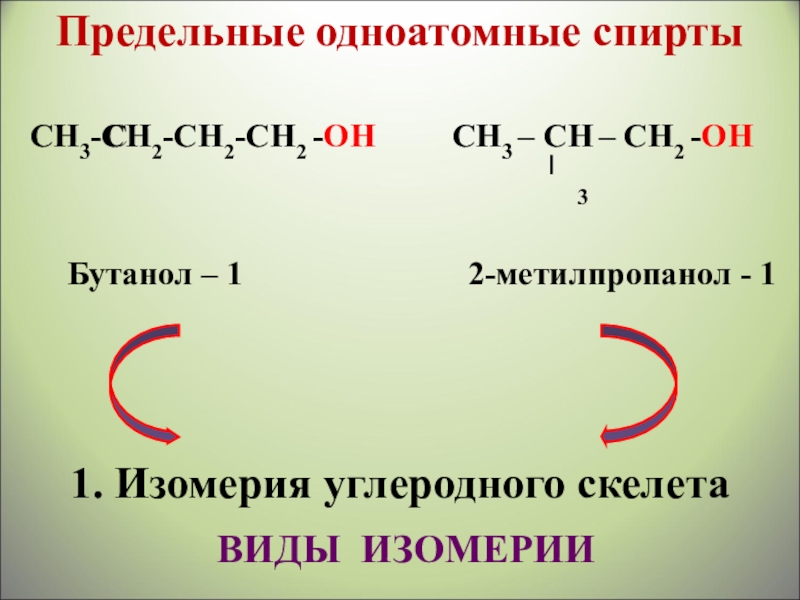
Слайд 13СН3-СН2-СН2-СН2 -ОН
СН3 – СН – СН2 -ОН
Бутанол – 1
1. Изомерия углеродного скелета
СН
3
ВИДЫ ИЗОМЕРИИ
Предельные одноатомные cпирты
Слайд 14Предельные одноатомные cпирты
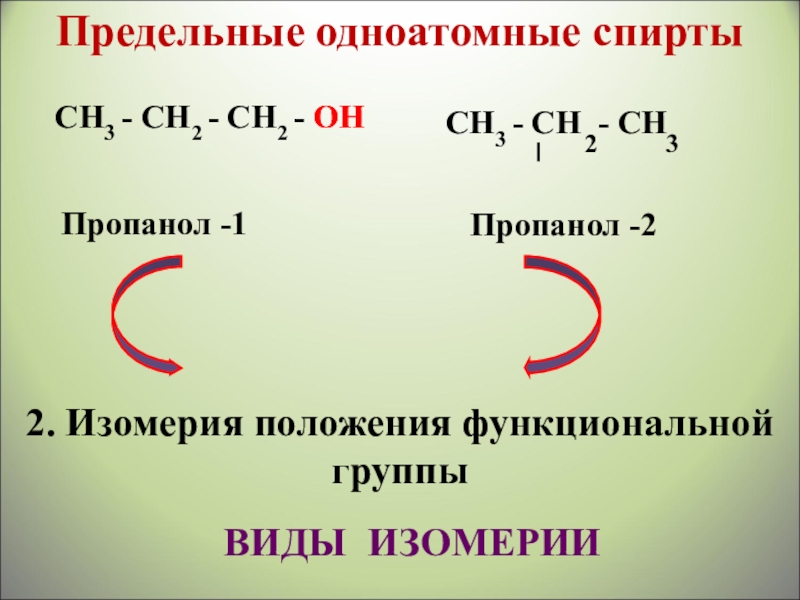
СН3 - СН2 - СН2 - ОН
СН3 -
2
3
ОН
Пропанол -1
Пропанол -2
2. Изомерия положения функциональной группы
ВИДЫ ИЗОМЕРИИ
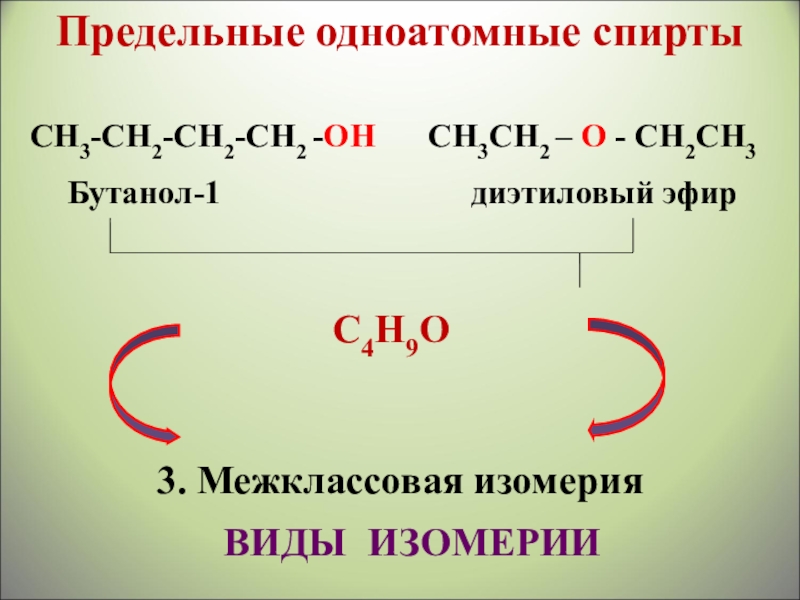
Слайд 15СН3СН2 – О - СН2СН3
Бутанол-1
СН3-СН2-СН2-СН2 -ОН
С4Н9О
3. Межклассовая изомерия
ВИДЫ ИЗОМЕРИИ
Предельные одноатомные cпирты
Слайд 16Предельные одноатомные cпирты
СН3 - СН2 - СН2 - СН2 -
СН3 - СН2 - СН – СН3
ОН
Бутанол – 1 Бутанол - 2
СН3 - СН - СН2 - ОН
СН3
СН3 - С – СН3
ОН
СН3
2 метилпропанол – 1 2 метилпропанол - 2
СН3СН2 – О - СН2СН3 диэтиловый эфир
Составить формулы изомеров С4Н9ОН
Слайд 18
Физические свойства спиртов
Алканолы - бесцветные жидкости (С1-С11) или кристаллические твердые вещества
Слайд 19Предельные одноатомные cпирты
…О - Н
…О - Н
…О - Н
…О - Н
…О – Н …
R
R
R
С2Н5
С2Н5
С2Н5
Первые члены гомологического ряда спиртов по сравнению с соответствующими алканами являются жидкостями.
Это объясняется наличием водородных связей между молекулами спиртов
Связь между атомом Н одной молекулы и атомом сильно электроотрицательного элемента (F, О, N) другой молекулы называют водородной
Слайд 21
Бесцветная жидкость
с температурой кипения 64,5 0С,
с характерным запахом.
голубоватым пламенем.
Хороший растворитель,
его используют для
производства формальдегида, некоторых лекарственных веществ.
Добавляют в моторное топливо для увеличения октанового числа.
Ядовит! Вызывает поражение нервной и сосудистой систем. Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению и слепоте, часто – летальный исход.
Метанол СН3ОН
Слайд 22
Этанол С2Н5ОН
Бесцветная жидкость с температурой кипения
78,4 0С, с характерным
Легче воды. Смешивается с ней в любых соотношениях.
Легко воспламеняется, горит слабо светящимся голубоватым
пламенем.
Слайд 23Функциональная группа спиртов
При смещении электронной плотности от водорода
к кислороду, возможна
атома водорода, что приводит к появлению слабых
кислотных свойств.
Слайд 24Химические свойства алканолов
1. Взаимодействие с актив. Ме
I. Реакции замещения
2С2Н5ОН + 2Na
C2H5ONa + H2O → C2H5OH + NaOH
2R-ОН + 2Na → 2R-ONa + H2 ↑
R-ONa + H2O → R-OH + NaOH
алкоголят
(алкилат Na)
Алкоголяты не устойчивы, легко гидролизуются Н2О
этилат Na
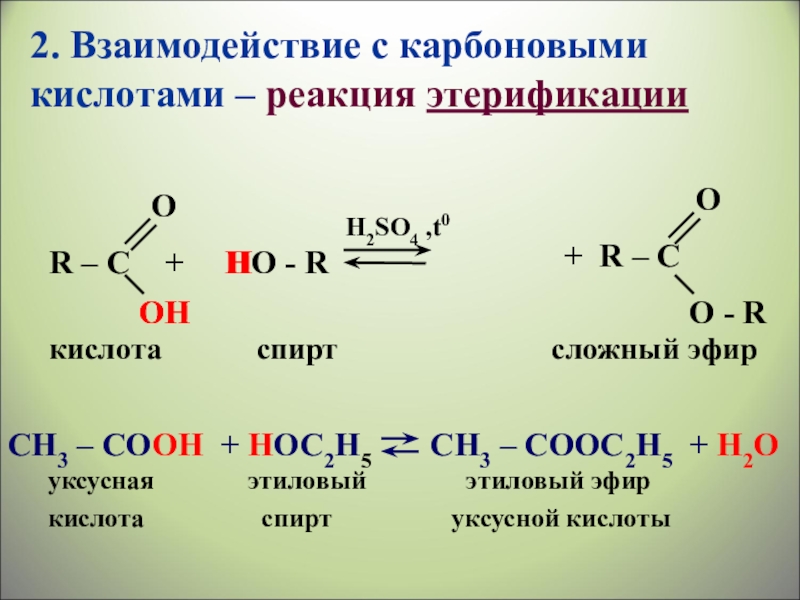
Слайд 25 R – C + HO
H2SO4 ,t0
O
ОH
OH
H
кислота
спирт
сложный эфир
CH3 – CОOH + HОC2H5 CH3 – СООC2H5 + H2О
уксусная этиловый этиловый эфир
кислота спирт уксусной кислоты
+ R – C
О - R
O
2. Взаимодействие с карбоновыми кислотами – реакция этерификации
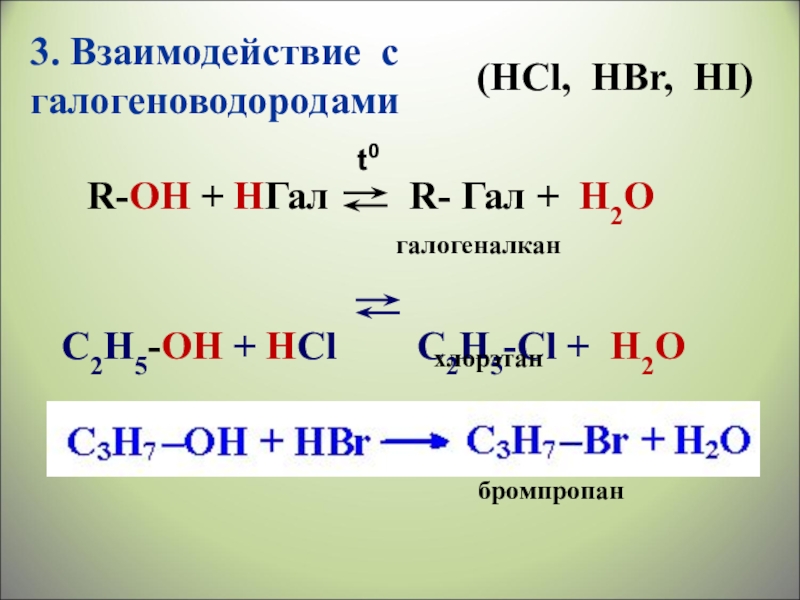
Слайд 263. Взаимодействие с галогеноводородами
(НСl, HBr, HI)
R-ОН + HГал
С2Н5-ОН + HСl С2Н5-Cl + H2О
галогеналкан
хлорэтан
бромпропан
t0
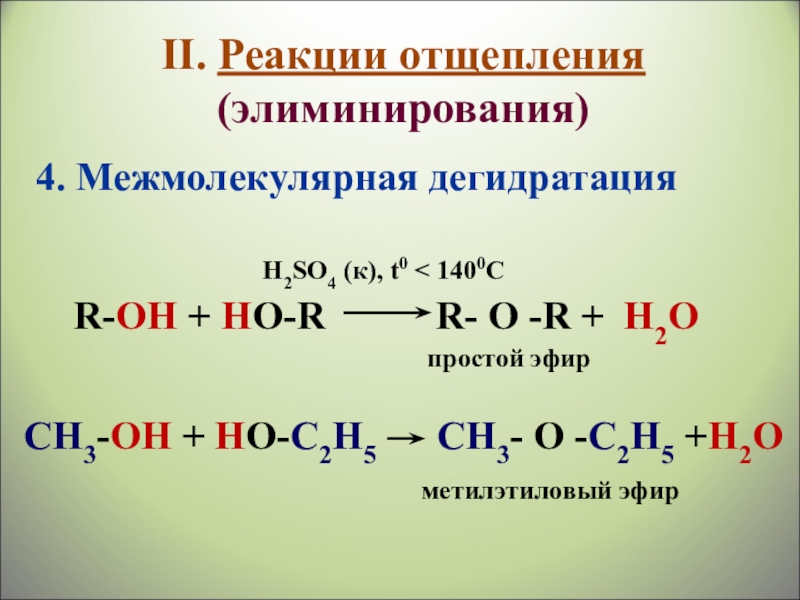
Слайд 27II. Реакции отщепления (элиминирования)
4. Межмолекулярная дегидратация
R-ОН + HО-R
простой эфир
H2SO4 (к), t0 < 1400C
СН3-ОН + HО-С2Н5 СН3- О -С2Н5 +H2О
метилэтиловый эфир
Слайд 285. Внутримолекулярная дегидратация
R-СН2 -СHОН-R R-СН = СH -R
алкен
Правило Зайцева: отщепление Н легче происходит от наименее гидрированного атома С
H2SO4 (к), t0 > 1400C
Слайд 296. Дегидратация и дегидрирование этанола
(реакция Лебедева → получение бутадиена-1,3
(kat: Al2O3, ZnO, t0 )
2С2Н5ОН → СН2=СН-СН=СН2 + 2Н2О + Н2
бутадиена-1,3
Слайд 307. Каталитическое дегидрирование спиртов
первичный спирт
вторичный спирт
III. Реакции окисления
Слайд 318. Реакция горения
Горят не коптящим светящимся пламенем. Реакция сильно экзотермическая, поэтому
С2Н5ОН + 3О2 → 2CO2 + 3H2О
2C3H7OН + 9О2 → 6CO2 + 8H2О
Общий вид:
Слайд 32CH3 – CH2 – OH + CuO → CH3 – C
t0
O
H
уксусный альдегид
этиловый спирт
9. Окисление спиртов окислителями
(CuO, КMnO4, хромовая смесь) → [O] ок-ль
Слайд 35Способы получения (общие)
1. Гидролиз галогеналканов
2. Гидратация алкенов
(правило Марковникова!)
3. Гидрирование
(реакция восстановления)
Слайд 37Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
этанол -
Способы получения (частные)