- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Спирты, строение, изомерия, физические и химические свойства, получение, применение
Содержание
- 1. Презентация по химии на тему: Спирты, строение, изомерия, физические и химические свойства, получение, применение
- 2. Цели урока: Изучить: Состав, строение, классификацию, номенклатуру и изомерию спиртов.
- 3. Научиться: Составлять структурную и брутто-формулу, определять изомеры, классифицировать и давать названия предельных одноатомных спиртов
- 4. Определение Спирты (алканолы) – органические вещества, молекулы
- 5. Слайд 5
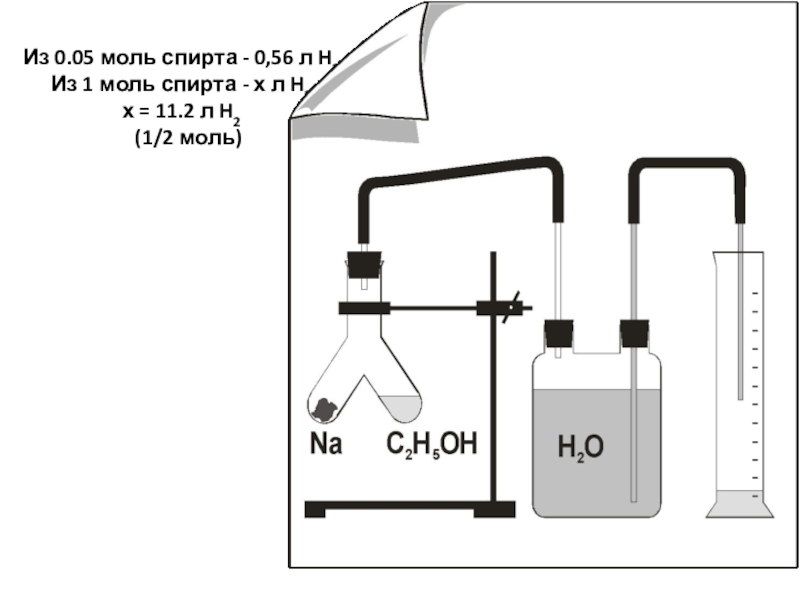
- 6. Из 0.05 моль спирта - 0,56 л
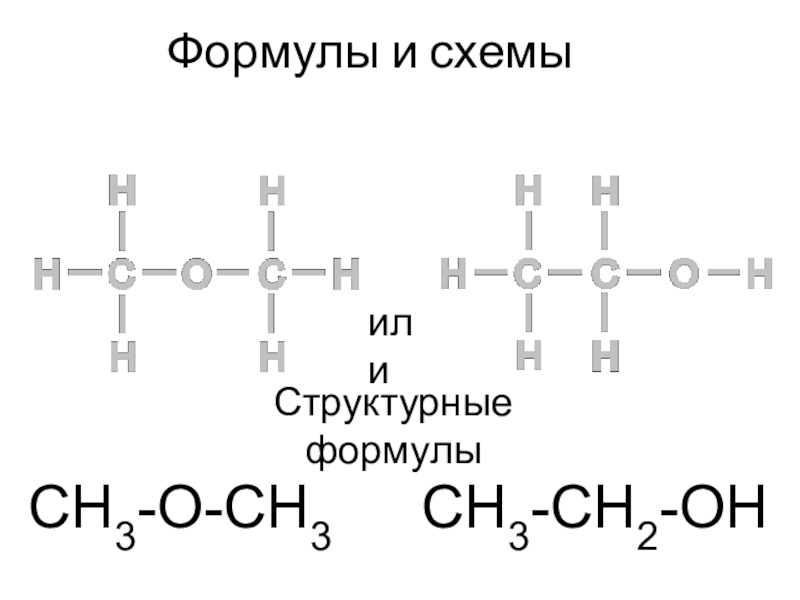
- 7. Формулы и схемыилиСтруктурные формулыCH3-O-CH3CH3-CH2-OH
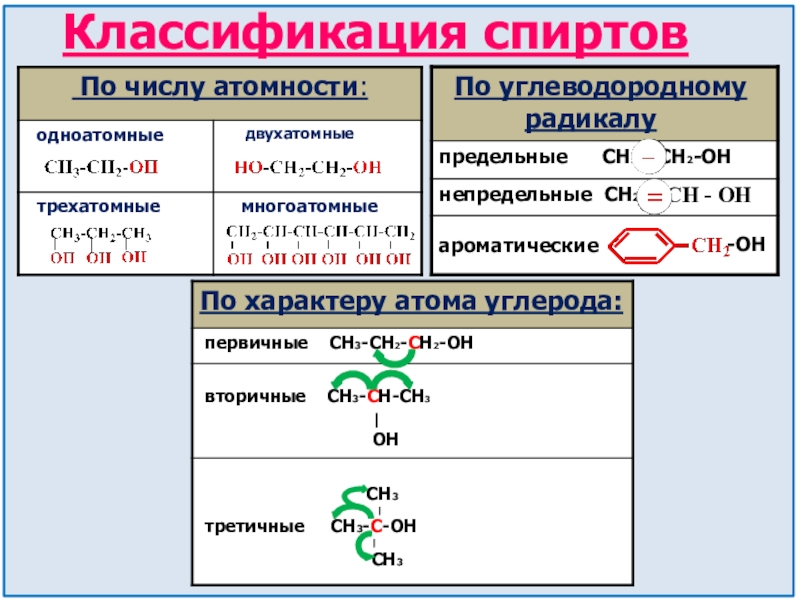
- 8. Классификация спиртовароматическиеCH - OH-ОНПо углеводородному радикалу
- 9. НОМЕНКЛАТУРА СПИРТОВПри образовании названий спиртов к названию
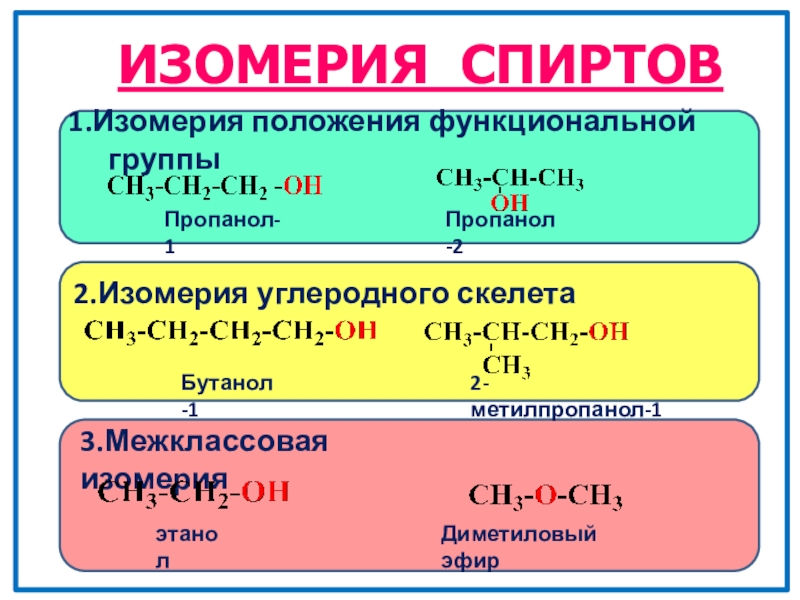
- 10. ИЗОМЕРИЯ СПИРТОВ1.Изомерия положения функциональной группы 2.Изомерия углеродного скелета Бутанол-12-метилпропанол-13.Межклассовая изомерияэтанолДиметиловый эфирПропанол-1Пропанол-2
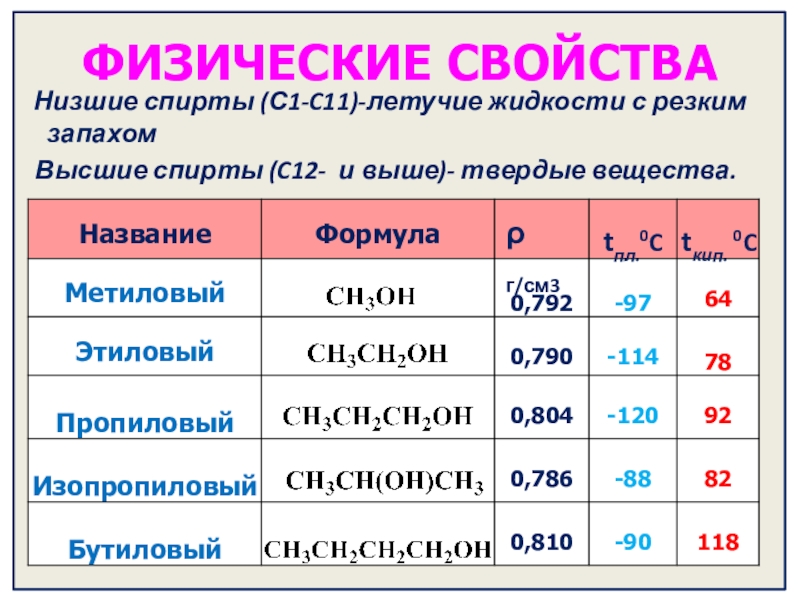
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Низшие спирты (С1-C11)-летучие жидкости
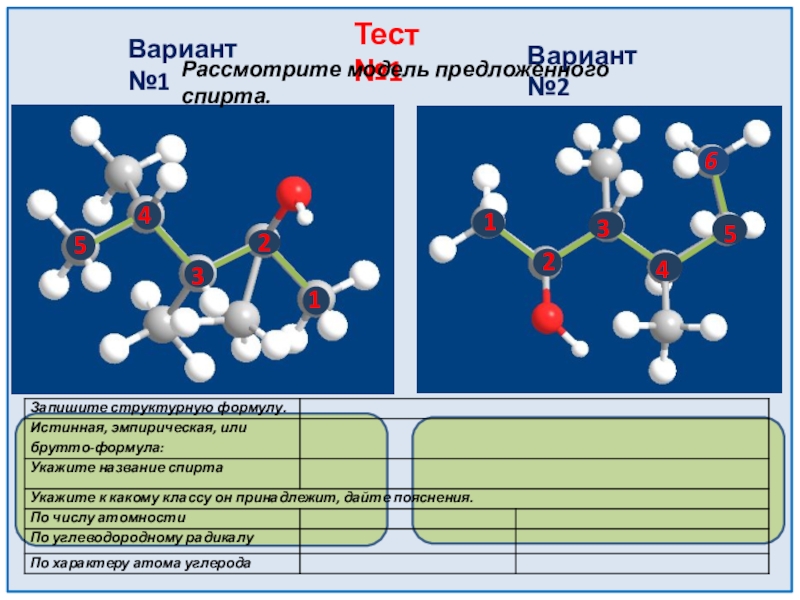
- 12. 12345123456Вариант №1Вариант №2Тест №1Рассмотрите модель предложенного спирта.
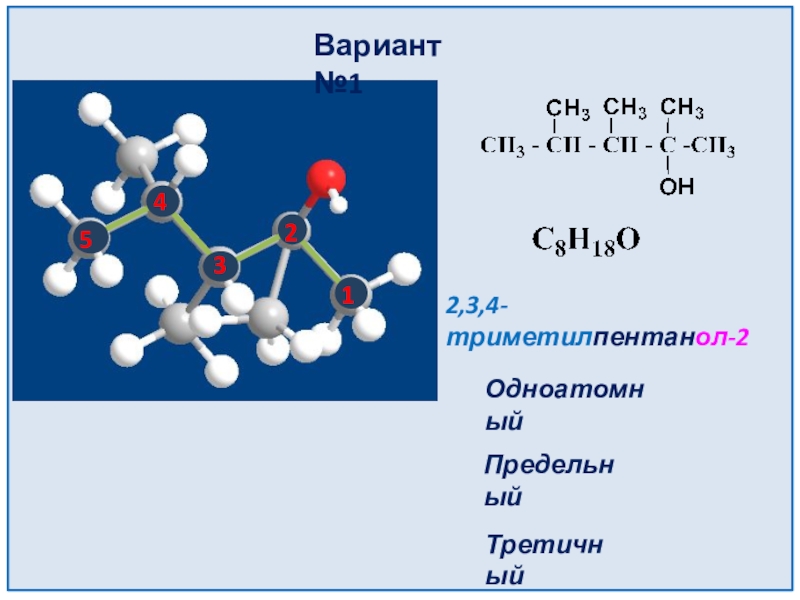
- 13. 2,3,4-триметилпентанол-2Вариант №112345ОдноатомныйПредельныйТретичный
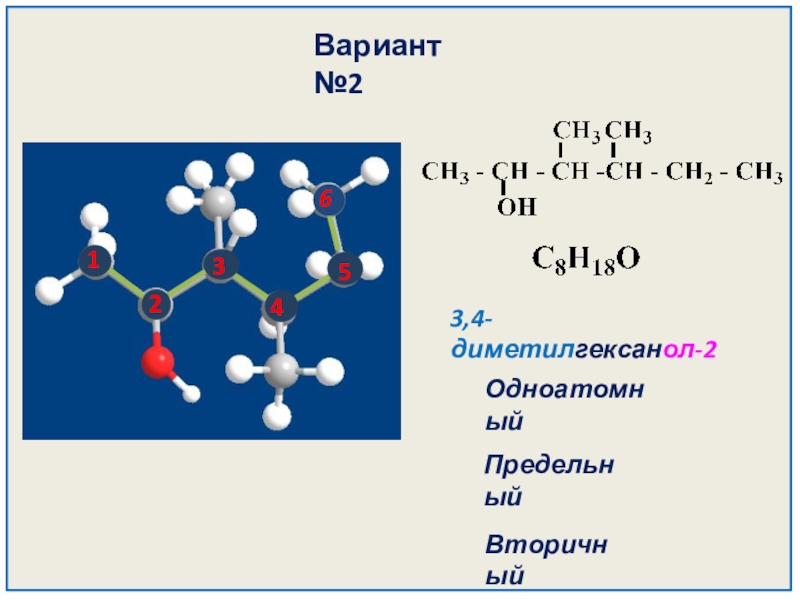
- 14. 3,4-диметилгексанол-2Вариант №212345ОдноатомныйПредельныйВторичный6
- 15. СПИРТЫ одноатомные предельныеСпособы получения, химические свойства и применение
- 16. Цели урока: Изучить: Способы получения и химические свойства предельных одноатомных спиртов
- 17. Научиться: Составлять уравнения химических реакций, характеризующих свойства предельных одноатомных спиртов
- 18. Способы получения спиртов Гидратация алкенов:
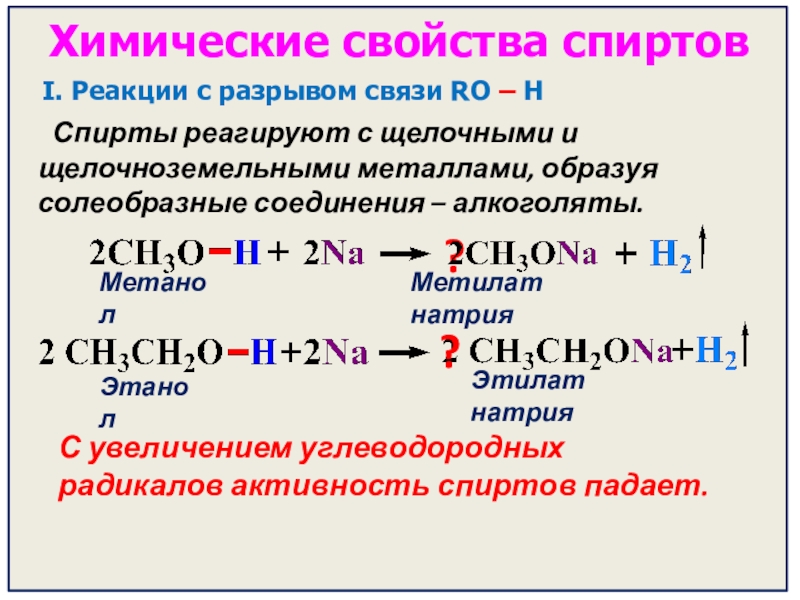
- 19. Химические свойства спиртовI. Реакции с разрывом связи
- 20. Взаимодействие спиртов с органическими
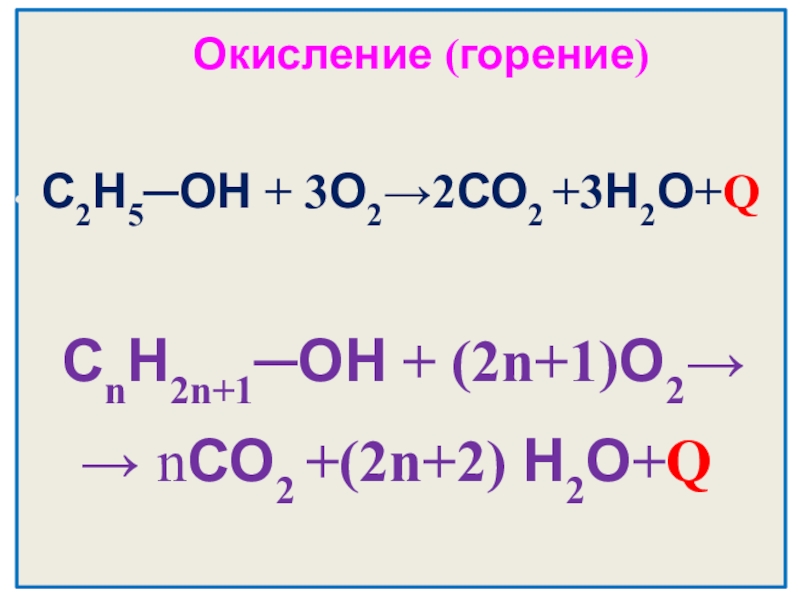
- 21. Окисление (горение)С2Н5─ОН + 3О2→2СО2 +3Н2О+QСnН2n+1─ОН + (2n+1)О2→→ nСО2 +(2n+2) Н2О+Q
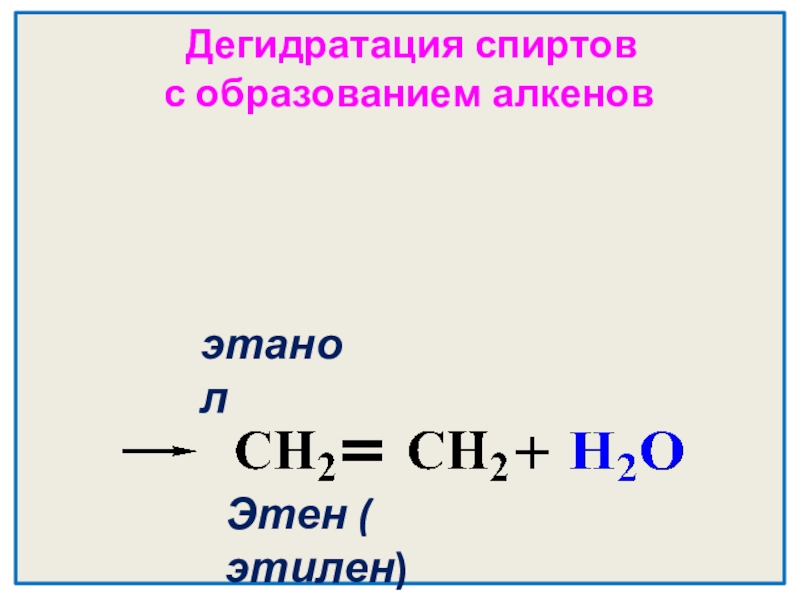
- 22. H2SO4 конц. Дегидратация спиртов с образованием алкеновt0C 1400 С >этанолЭтен ( этилен)
- 23. 2. Окисление спиртов оксидом меди (II) H+CuOO__C___HCHHto C2+_=3этанолэтаналь?_При действии окислителей первичные спирты превращаются в альдегиды
- 24. t0=400-5000 С AI2O3, ZnOС2Н5 ─ О ─
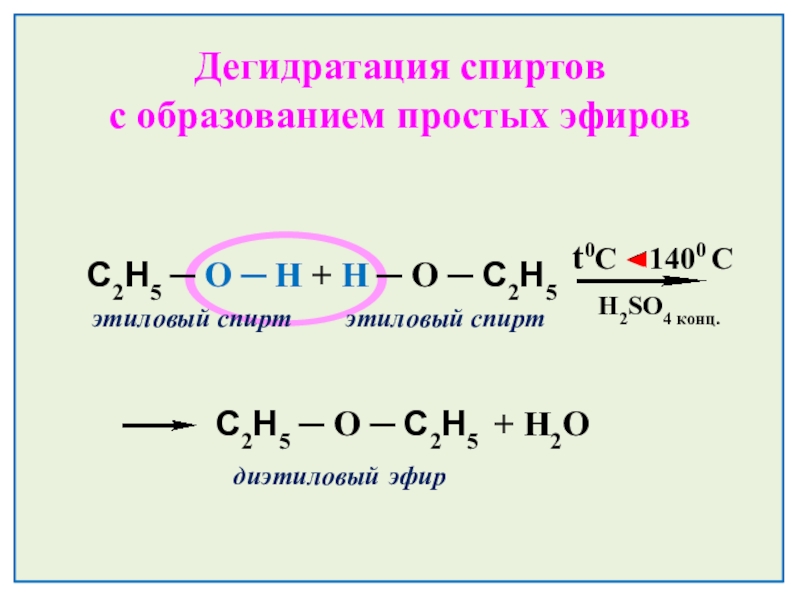
- 25. Дегидратация спиртов с образованием простых эфировH2SO4 конц. t0C 1400 С
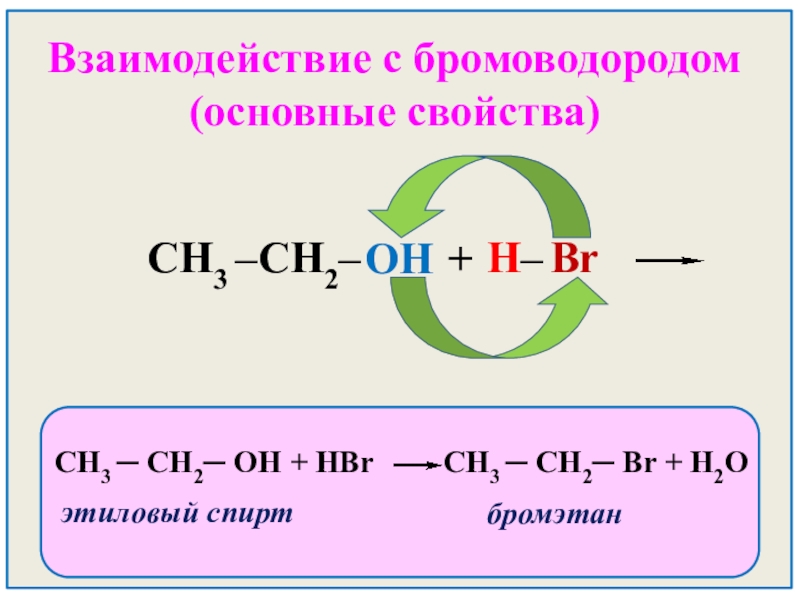
- 26. Взаимодействие с бромоводородом (основные свойства)
- 27. H2SO4 конц.
- 28. 1- растворитель2 – получение
- 29. Спасибо за внимание!
Слайд 3Научиться: Составлять структурную и брутто-формулу, определять изомеры, классифицировать и давать названия предельных
Слайд 4Определение
Спирты (алканолы) – органические вещества, молекулы которых содержат одну или
Общая формула одноатомных предельных спиртов СnН2n+1ОН
Слайд 6Из 0.05 моль спирта - 0,56 л H2 Из 1 моль спирта
Из 0,05 моль спирта – 0,56 л H2,
Из 1 моль спирта – Х литров H2.
X = 11,2 литра H2 ( ½ моль )
Слайд 9НОМЕНКЛАТУРА СПИРТОВ
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют
– ОЛ.
М е т а н ОЛ
П р о п а н ОЛ - 1
1
2
3
3
2
1
П р о п а н ОЛ - 2
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи:
Слайд 10ИЗОМЕРИЯ СПИРТОВ
1.Изомерия положения функциональной группы
2.Изомерия углеродного скелета
Бутанол-1
2-метилпропанол-1
3.Межклассовая изомерия
этанол
Диметиловый эфир
Пропанол-1
Пропанол-2
Слайд 11ФИЗИЧЕСКИЕ СВОЙСТВА
Низшие спирты (С1-C11)-летучие жидкости с резким запахом
tкип. 0C
ρ г/см3
Слайд 17Научиться: Составлять уравнения химических реакций, характеризующих свойства предельных одноатомных спиртов
Слайд 18Способы получения спиртов
Гидратация алкенов:
C2H5OH
CH2=CH2+ HOH
R-Cl+HOH
Гидролиз
R-OH+HCl
R-
Cl
+
H
OH
Брожение глюкозы:
(при повышенном давлении, высокой температуре и катализатора оксида цинка)
Синтез метанола из синтез-газа
Лабораторные:
Промышленные:
NaOH
Гидратация алкенов
Слайд 19Химические свойства спиртов
I. Реакции с разрывом связи RO – H
?
Этилат натрия
Этанол
С увеличением углеводородных радикалов активность спиртов падает.
?
Метанол
Метилат натрия
Слайд 20
Взаимодействие спиртов с органическими
кислотами (реакция этерификации)
приводит
уксусноэтиловый эфир (этилацетат)
Уксусная кислота
этанол
уксусноэтиловый эфир
( этилацетат)
Слайд 232. Окисление спиртов оксидом меди (II)
H
+
Cu
O
O
_
_
C
_
_
_
H
CH
H
to C
2
+
_
=
3
этанол
этаналь
?
_
При действии окислителей первичные
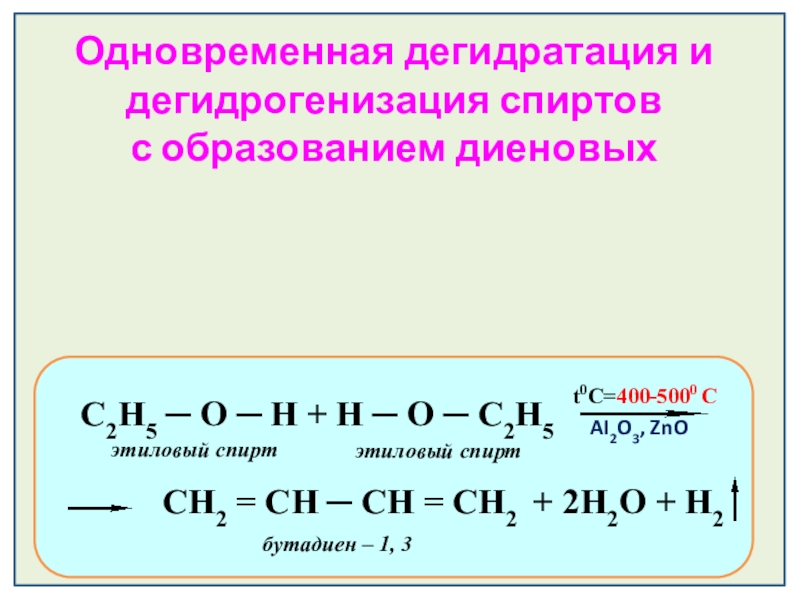
Слайд 24t0=400-5000 С
AI2O3, ZnO
С2Н5 ─ О ─ Н + Н ─
t0C=400-5000 С
AI2O3, ZnO
СН2 = СН ─ СН = СН2 + 2H2O + H2
этиловый спирт
бутадиен – 1, 3
этиловый спирт
Одновременная дегидратация и дегидрогенизация спиртов
с образованием диеновых углеводородов
Слайд 25Дегидратация спиртов
с образованием простых эфиров
H2SO4 конц.
t0C 1400 С
С2Н5 ─ О ─ Н + Н ─ О ─ С2Н5
этиловый спирт этиловый спирт
С2Н5 ─ О ─ С2Н5 + H2O
диэтиловый эфир
Слайд 26Взаимодействие с бромоводородом (основные свойства)
CH3
OH
H–
Br
+
СН3 ─ СН2─ ОН + HBr СН3 ─ СН2─ Br + H2O
этиловый спирт
бромэтан
Слайд 27
H2SO4 конц.
t0C 1400 С
H2SO4 конц
>
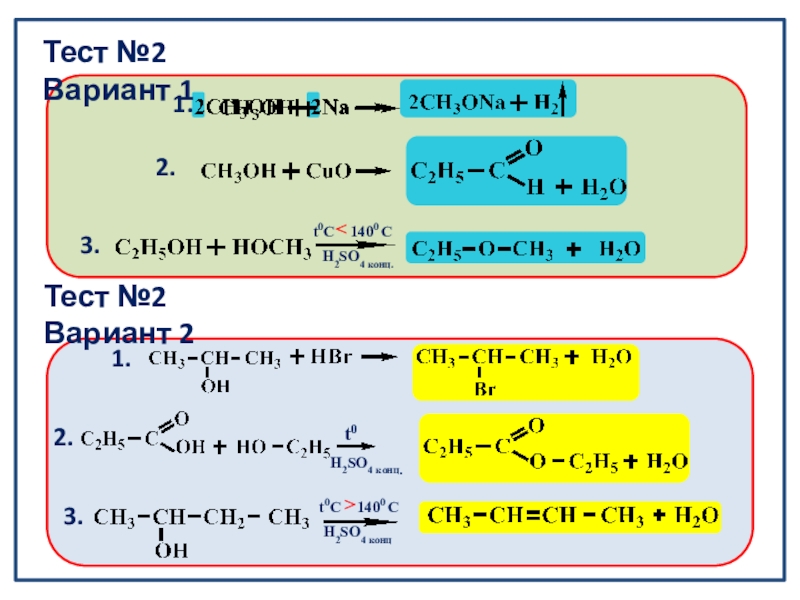
Тест №2 Вариант 1
Тест №2 Вариант 2
t0
H2SO4 конц.
1.
1.
2.
2.
3.
3.
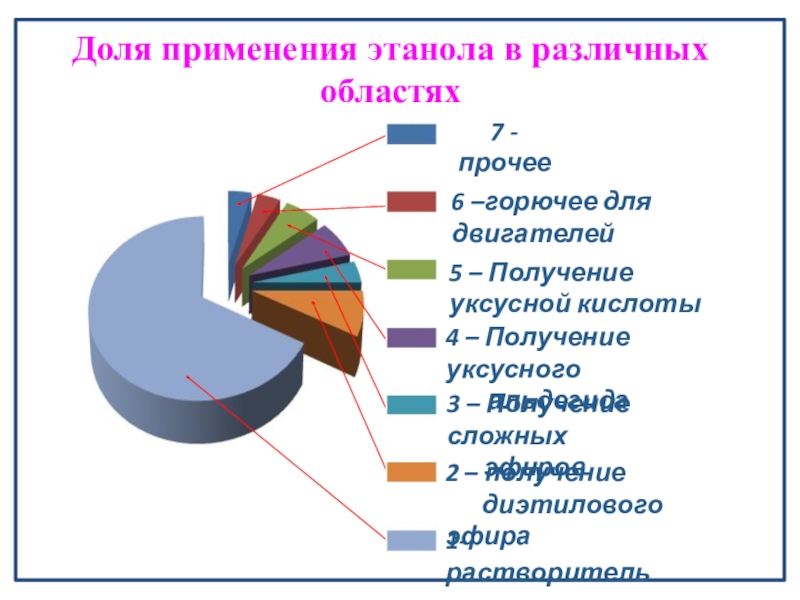
Слайд 281- растворитель
2 – получение
диэтилового эфира
3 – Получение
эфиров
4 – Получение уксусного
альдегида
5 – Получение уксусной кислоты
6 –горючее для двигателей
7 - прочее
Доля применения этанола в различных областях