- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соли
Содержание
- 1. Презентация по химии на тему Соли
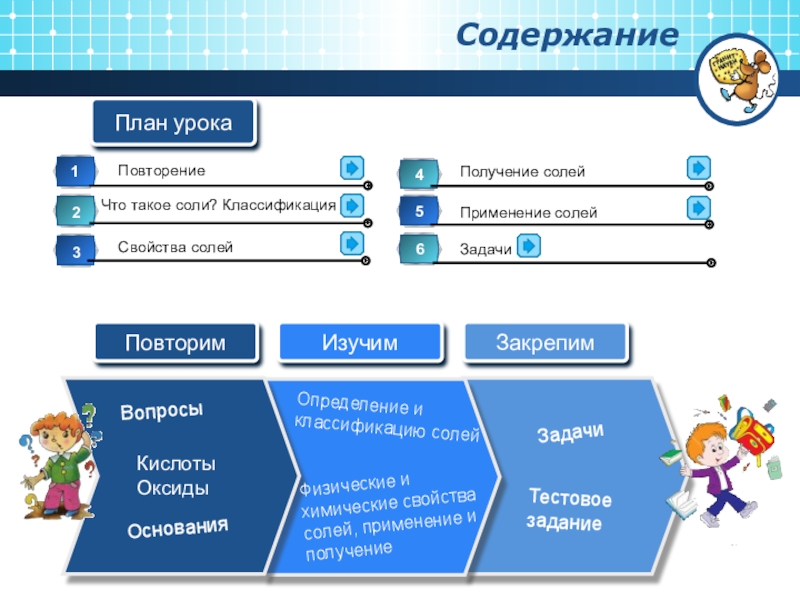
- 2. ВопросыКислоты ОксидыФизические и химические свойства солей, применение и получение ОснованияОпределение и классификацию солейЗадачиТестовое заданиеСодержание План урока
- 3. Повторим
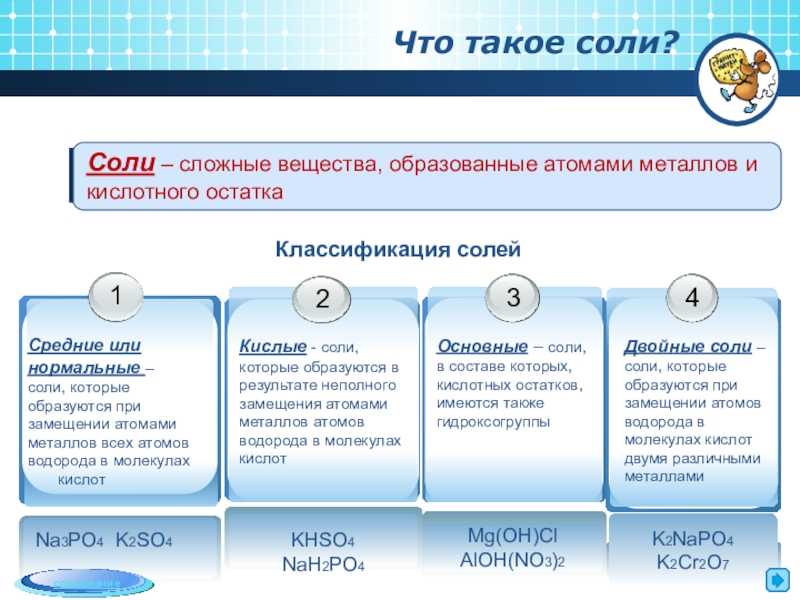
- 4. Соли – сложные вещества, образованные атомами металлов
- 5. Свойства солейФизические свойстваСоли - твердые вещества разного
- 6. Химические свойства Соли реагируют с металлами
- 7. Соли реагируют с
- 8. Получение солей Взаимодействие металлов и неметаллов:
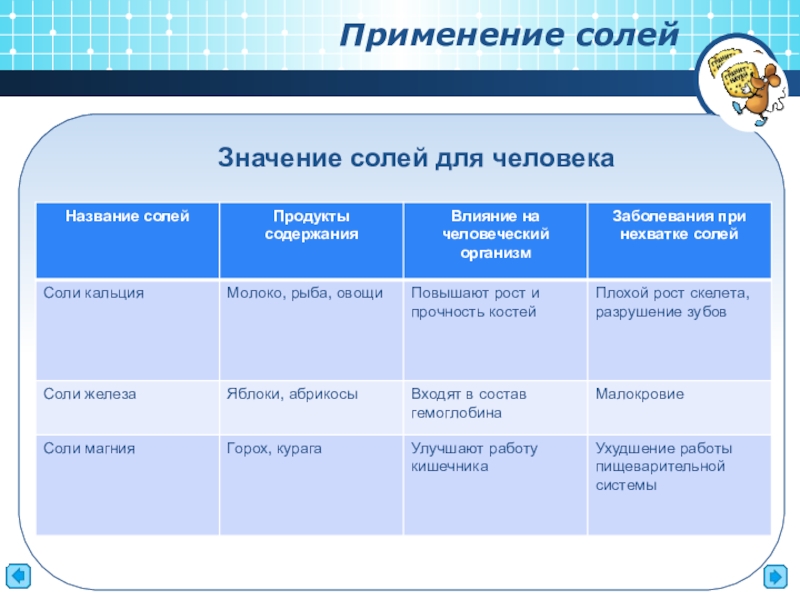
- 9. Применение солей Значение солей для человека
- 10. m =m = 18,8 гm = 18,8
- 11. Дано:
- 12. СaCO3 = CaO + CO2 CaO
- 13. Список литературыРудзитис Г. Е., Фельдман Ф. Г.
Слайд 1Соли.
Презентация для учащихся 8 класса
Гаджиева К.Н.
Учитель химии МКОУ «Гимназии №2 имени
Слайд 2Вопросы
Кислоты Оксиды
Физические и химические свойства солей, применение и получение
Основания
Определение и
Задачи
Тестовое задание
Содержание
План урока
Слайд 3Повторим
щелочи
голубую
двухосновная, кислородсодержащая, сильная кислота
содержание
Слайд 4
Соли – сложные вещества, образованные атомами металлов и кислотного остатка
Что такое
Классификация солей
Na3PO4 K2SO4
содержание
Слайд 5
Свойства солей
Физические свойства
Соли - твердые вещества разного цвета.
Растворимость их различна.
Некоторые хорошо растворимы, например все нитраты.
Другие же, например: CaCO3, BaSO4 - практически нерастворимы.
Нитраты – все растворимы
Сульфаты – все, кроме CaSO4, SrSO4, BaSO4, PbSO4, Ag2SO4
Хлориды – все, кроме AgCl, PbCl2
Сульфиды, карбонаты, силикаты, фосфаты – все соли нерастворимые, кроме солей K, Na и групп NH4
содержание
Слайд 6
Химические свойства
Соли реагируют с металлами ( исключения активные металлы:
Fe + CuSO4 = FeSO4 + Cu
Соли реагируют с кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Карбонаты, сульфиты разлагаются при нагревании:
СaCO3 = CaO + CO2
Некоторые соли способны реагировать с водой с образованием кристаллогидратов:
CuSO4 + 5H2O = CuSO4 5H2O + Q
Слайд 7
Соли реагируют с некоторыми кислотными оксидами:
Соли реагируют с неметаллами, стоящими в ряду, составленным Н. Н. Бекетовым правее, чем неметалл входящий в состав соли:
2NaBr + Cl2 = 2NaCl + Br2
Соли реагируют с другими солями с образованием новых нерастворимых солей:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Соли реагируют с растворимыми основаниями с образованием нерастворимого основания:
AlCl3 + 3KOH = Al(OH)3 + 3KCl
Слайд 8Получение солей
Взаимодействие металлов и неметаллов:
Взаимодействие кислотных оксидов с основными и амфотерными оксидами:
CaO + CO2 = CaCO3
ZnO + SiO2 = ZnSiO3
Взаимодействие двух разных солей с образованием новой
нерастворимой соли:
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Взаимодействие оснований и кислот:
NaOH + HCl = NaCl + H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 +6H2O
Ca(OH)2 + CO2 = CaCO3 + CO2
Взаимодействие более активного металла с солями:
FeCl2 + Zn = ZnCl2 + Fe
Действие кислот - неокислителей на металлы, стоящие в ряду напряжений металлов до водорода:
Zn + 2HCl = ZnCl2 + H2
содержание
Слайд 10
m =m = 18,8 гm = 18,8 г nm = 18,8
Задачи
содержание
ответ
Слайд 11 Дано:
n (CuO) = 0,1 моль CuO + 2HNO3 = Cu(NO3)2 + H2O
HNO3 n = 1 моль n = 1 моль
_________________________
m (Cu(NO3)2) - ? n (CuO) = n (Cu(NO3)2 = 0,1 моль
n (Cu(NO3)2) - ?
m = n Х M
M (Cu(NO3)2 = 64 + 2(14 + 3 Х16) = 188 (г/моль)
m (Cu(NO3)2 = 0,1 моль Х 188 г/моль = 18,8 (г)
Ответ: масса нитрата меди (II) равна 18,8 грамм, а его количество вещества – 0,1 моль.
Решение задачи
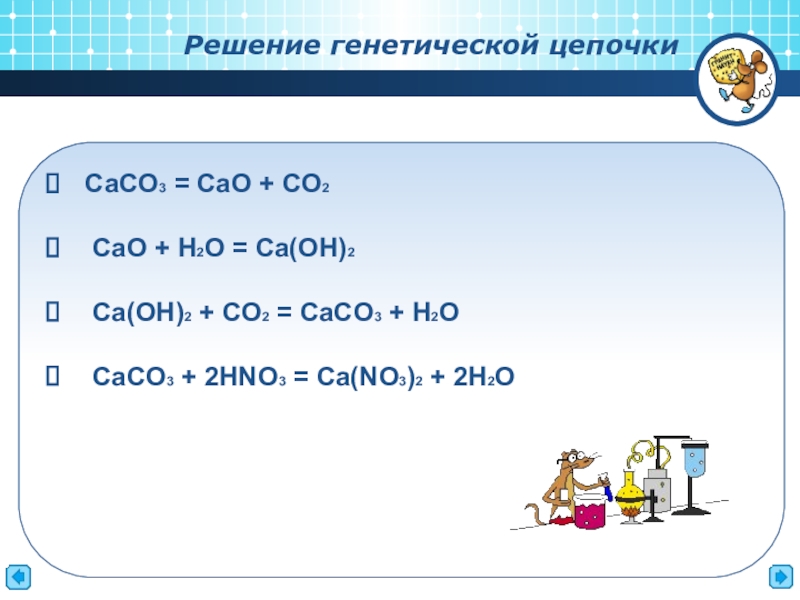
Слайд 12 СaCO3 = CaO + CO2
CaO + H2O = Ca(OH)2
CaCO3 + 2HNO3 = Ca(NO3)2 + 2H2O
Решение генетической цепочки
Слайд 13Список литературы
Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. 8
Презентация «Полупроводники» – Жуков В.В., учитель Новлянской СШ Заволжского района Ивановской области.