- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соли
Содержание
- 1. Презентация по химии на тему Соли
- 2. NOHNONaOHHNO2 3 К какому классу соединений относятся вещества, дать им названия
- 3. Задание1На какие группы и по каким признакам
- 4. ВеществаПростыеСложныеМеталлы Аl, Ca, Na НеметаллыS,
- 5. Задание 2Вставьте пропущенный фрагмент.S------ SО2 ----- H2SO3
- 6. проверкаS------ SО2 ----- H2SO3 Na----Na2O ----- NaОН
- 7. Слайд 7
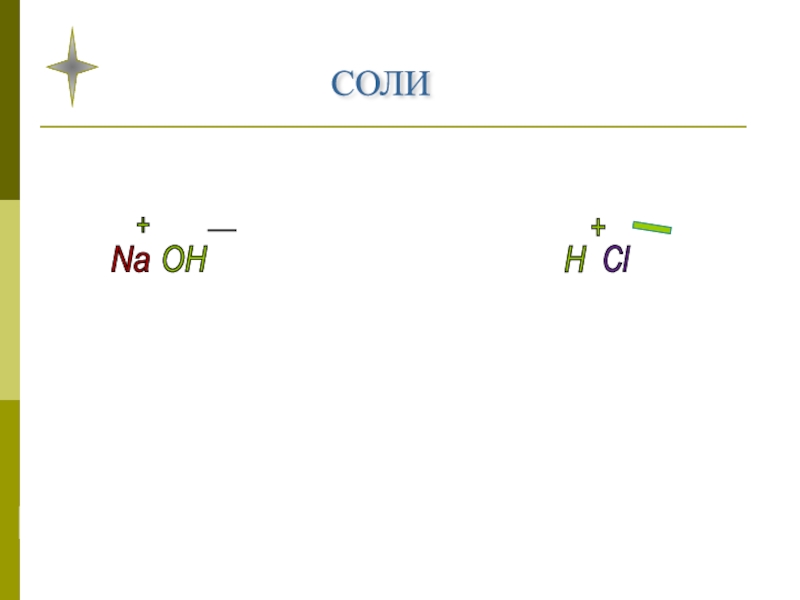
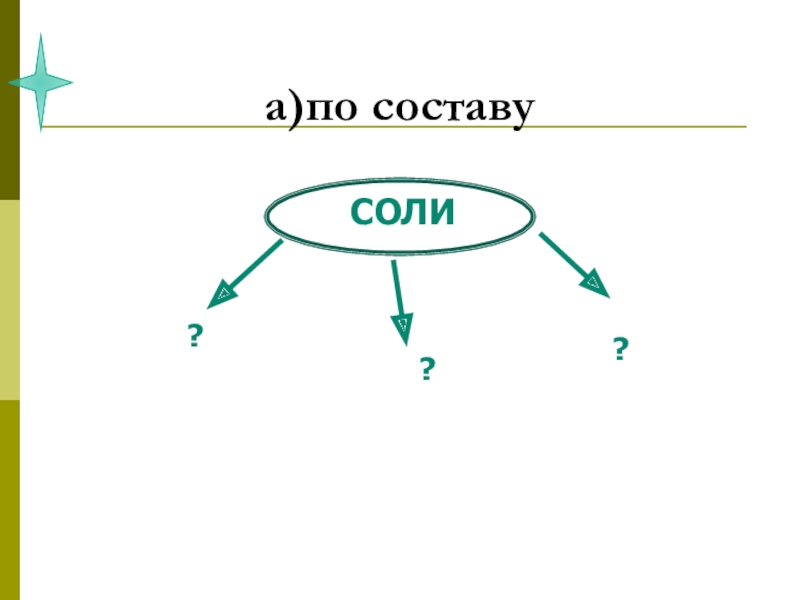
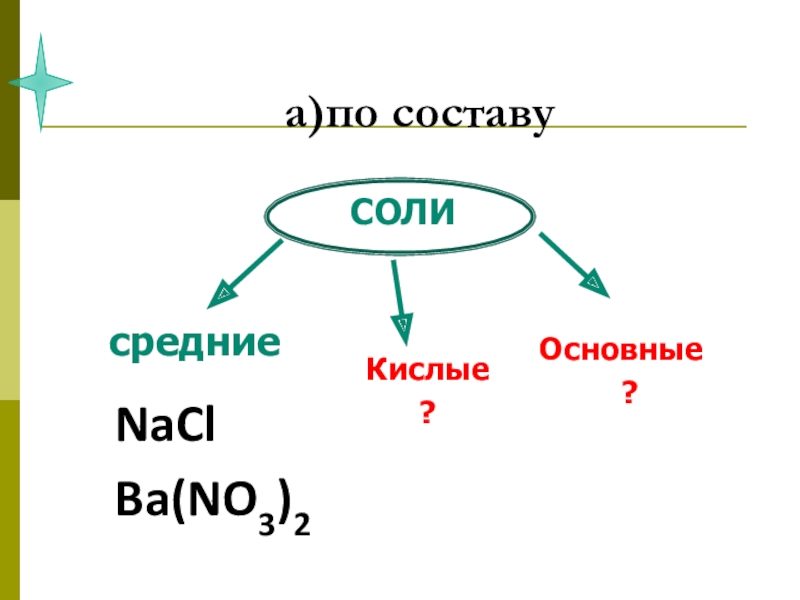
- 8. СОЛИ , как производные кислот и оснований.
- 9. Цель
- 10. 1. Соли. Их состав и номенклатура (название).
- 11. СОЛИ Na OH H Cl NaCl+ - + _
- 12. Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
- 13. 3 задание.Определить : почему у
- 14. 3 задание.Na+1
- 15. задание 4.Определить : почему у солей
- 16. Так как кислотные остатки имеют свою степень
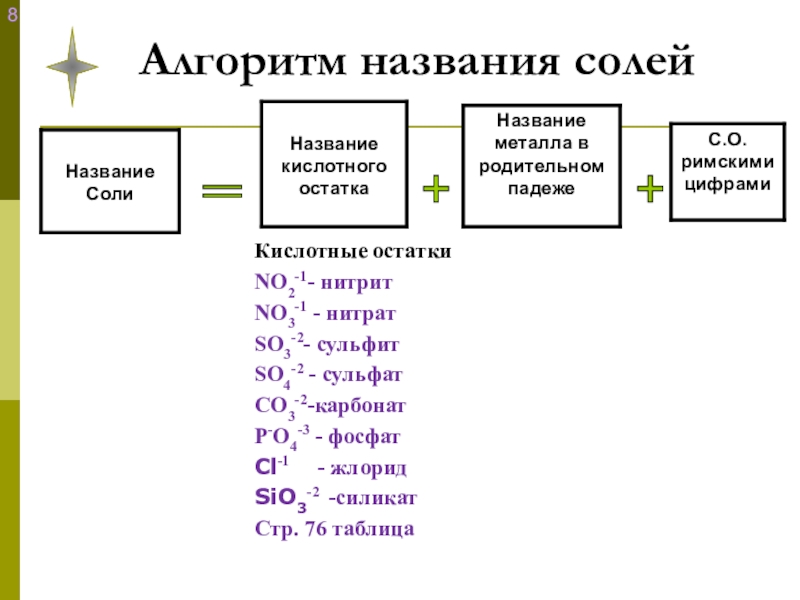
- 17. Алгоритм названия солей+ + =
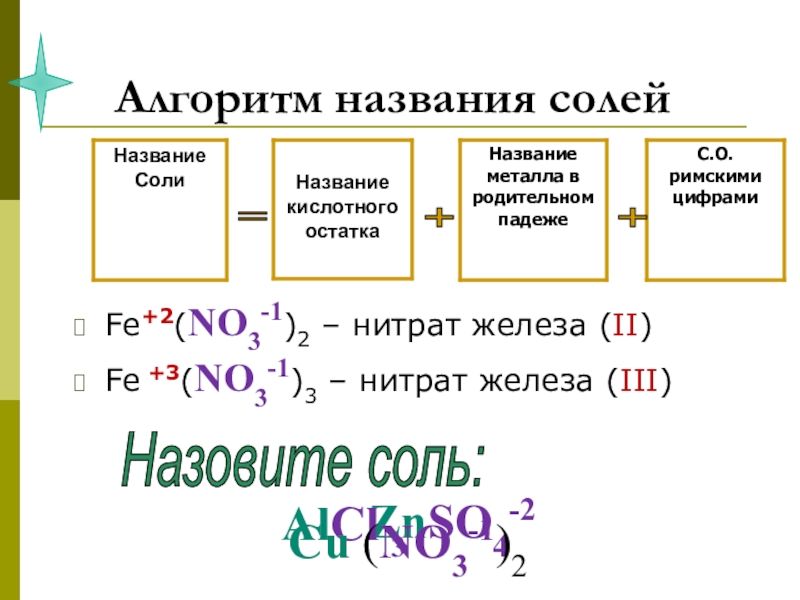
- 18. Алгоритм названия солейFe+2(NO3-1)2 – нитрат железа (II)Fe
- 19. задание 5. НАЗОВИТЕ СОЛИNaCl Fe +2SO4
- 20. Слайд 20
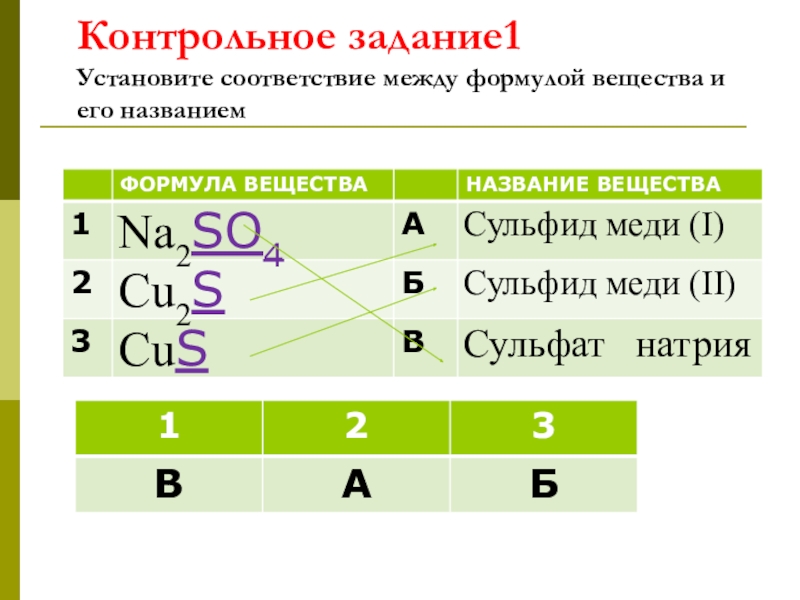
- 21. Контрольное задание1 Установите соответствие между формулой вещества и его названием
- 22. 2. Составление формул солей по их названиям.
- 23. 1. Запиши рядом знаки химических элементов, которые
- 24. 2. Над знаками химических элементов поставь их степень окисления.Пример:FeSO4+3-2Второй пункт выполнили переходим к третьему
- 25. 3. Определи Н.О.К. чисел выражающих степень окисления
- 26. 4. Раздели Н.О.К. на степень окисления каждого
- 27. Составить формулу сульфата алюминия: (второй способ)Составьте формулы:
- 28. Составьте формулу хлорида кальцияСаCl2Составьте формулу нитрата натрияNaNO3Zn(SO4)2Cu
- 29. 3. Отдельные Представители стр.77 в таблицу 2 хлорид натрия
- 30. NaCl
- 31. "Среди всех природных минеральных солей, самая главная
- 32. За
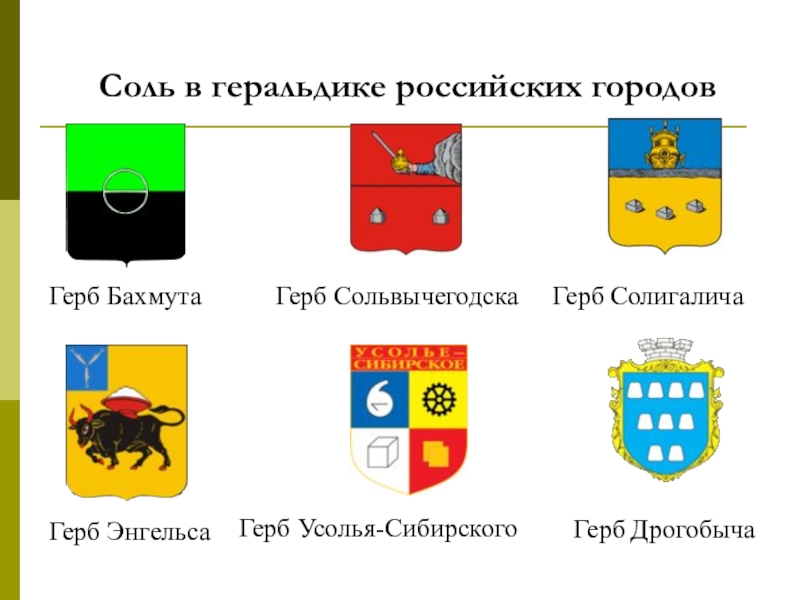
- 33. Соль в геральдике российских городовГерб Бахмута Герб Солигалича Герб Сольвычегодска Герб ЭнгельсаГерб Усолья-СибирскогоГерб Дрогобыча
- 34. Добыча солииз соляных шахтиз соленых озер
- 35. На озере Баскунчак ежегодно добывается около 5 млн. тонн соли
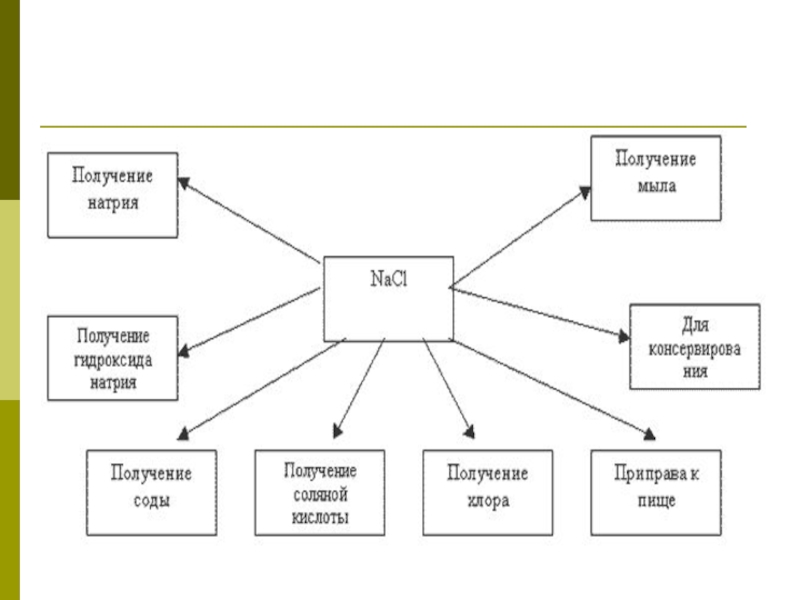
- 36. Применение NaCl
- 37. Слайд 37
- 38. Моллюски, раки, радиолярии, кораллы – все имеют известковый скелет
- 39. Большой Барьерный риф
- 40. Меловые горы
- 41. Минералы карбоната кальция находятся в горных породах:Известняк МелМрамор Мрамор Мрамор МраморТравертин
- 42. Мрамор – строительный материалЕдинственное в России здание,
- 43. Д/З: Фосфат кальция
- 44. Слайд 44
- 45. Лабораторный опыт. №1Определите растворимость солей Для этого:
- 46. Слайд 46
- 47. Слайд 47
- 48. Лабораторный опыт. №2Определите в какой из трех
- 49. Изменение окраски индикатора Для
- 50. Контрольное задание3 Ответте на вопросы:1.Какая окраска индикатора
- 51. Слайд 51
- 52. Подведем итоги?
- 53. Контрольное задание - итоговоеЧасть А (задания
- 54. Контрольное задание - итоговоеЧасть В Выбери
- 55. Контрольное задание - итоговоеЧасть А ГАЧасть В
- 56. Домашнее задание§,21 упр.3 стр. 78Составить презентацию фосфата кальция или опорный конспект в форме таблицы
- 57. Рефлексия1. Сегодня я узнал…2. Было интересно…3. Было
Слайд 3
Задание1
На какие группы и по каким признакам можно разделить вещества ,
Na2O ; H2CO3; ; H2SiO3
Ca(NO3)2 CaCO3 NaCl Cr2S3
NaOH ; О2; Al2O3 ; Ca (OH)2 ; С
СаO ; Аl; N2 ; Al(OH)3 ; S ; СО2 ;
H2SO3 ; SO2 ; Ca; Na
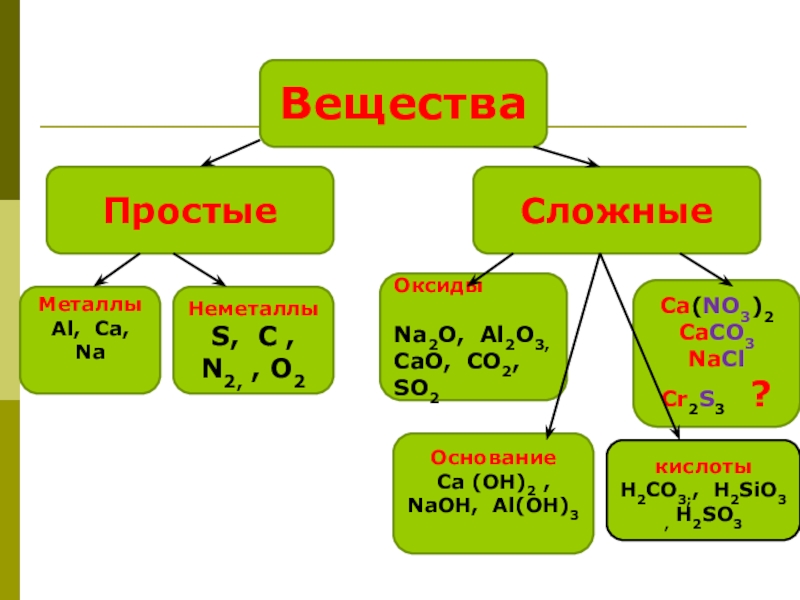
Слайд 4Вещества
Простые
Сложные
Металлы Аl, Ca, Na
Неметаллы
S, С ,
N2, , О2
Оксиды
Na2O, Al2O3,
СаO, СО2, SO2
Основание
Ca (OH)2 , NaOH, Al(OH)3
Ca(NO3)2 CaCO3 NaCl Cr2S3 ?
кислоты H2CO3;, H2SiO3 , H2SO3
Слайд 5Задание 2
Вставьте пропущенный фрагмент.
S------ SО2 ----- H2SO3
Na----Х----- NaОН
С------- Х
Ca----- CaO ----- Ca (OH)2
Х
ХХ
CaCO3
Слайд 6
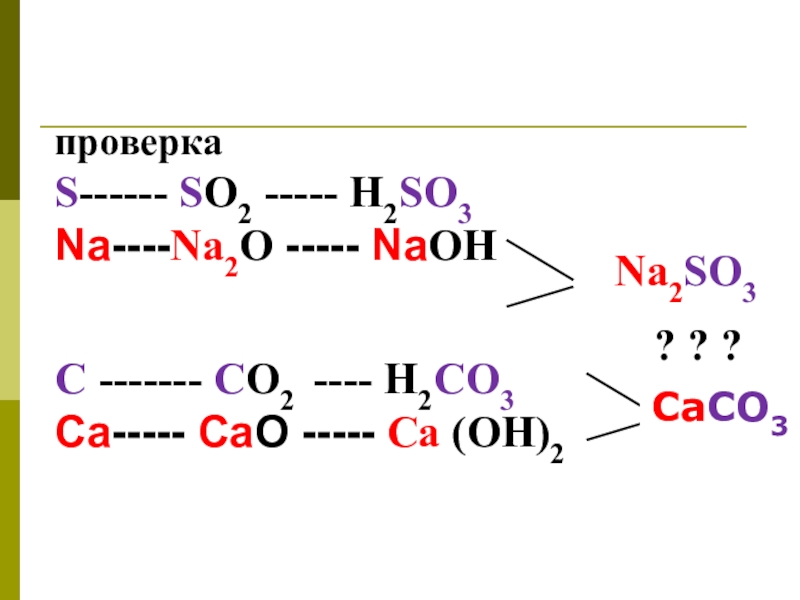
проверка
S------ SО2 ----- H2SO3
Na----Na2O ----- NaОН
С ------- СО2 ---- H2CO3
Ca----- CaO ----- Ca (OH)2
Na2SO3
CaCO3
Слайд 9 Цель урока: Изучить состав, названия солей, классификацию, свойства и
План
1.Соли. Их состав и номенклатура (название).
2. Составление формул солей по их названиям.
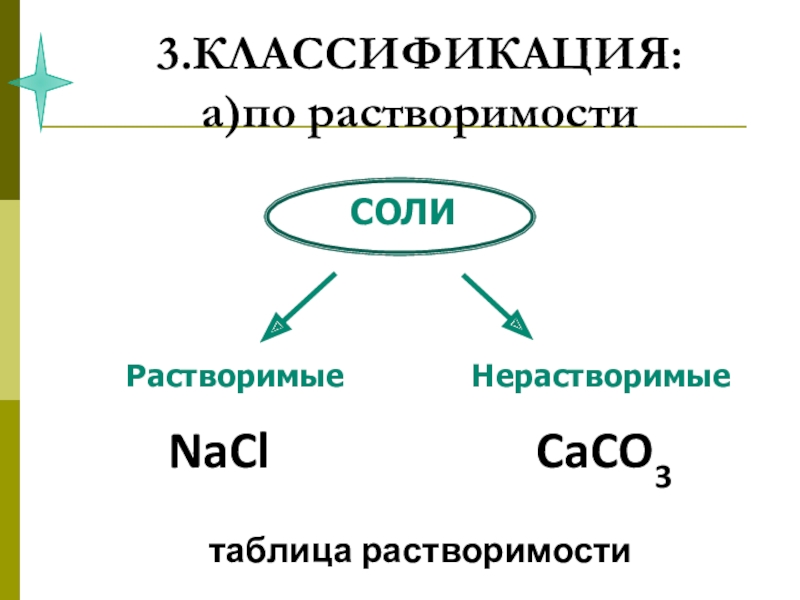
3. Классификация.
4. Представители данного класса.
5. Проверка знаний.
6. Подведение итогов урока.
7. Домашнее задание.
Слайд 13
3 задание.
Определить : почему у солей разное количество кислотных
NaNO3 Ca (NO3 )2 Al (NO3 )3
Слайд 15
задание 4.
Определить : почему у солей разное количество ионов металла?
NaNO3 Na 2СO3 Na 3 Р-O4
Слайд 16
Так как кислотные остатки имеют свою степень окисления:
(см. таблицу растворимости)
NO2-1- нитрит
NO3-1 - нитрат
SO3-2- сульфит
SO4-2 - сульфат
СO3-2-карбонат
Р-O4-3 - фосфат
Cl-1 - хлорид
SiO3-2 -силикат
Слайд 18Алгоритм названия солей
Fe+2(NO3-1)2 – нитрат железа (II)
Fe +3(NO3-1)3 – нитрат железа
=
+
+
Назовите соль:
ZnSO4-2
AlCl 3
Cu (NO3-1)2
Слайд 20
задание 5.
НАЗОВИТЕ СОЛИ
NaCl - хлорид натрия
Fe +2SO4 - сульфат железа
Al3(PO4)3 – фосфат алюминия
Ca(NO3)2 - нитрат кальция
Cu+2CO3 – карбонат меди (II)
Cr2+3S3 – сульфид хрома (III)
Na2SO4 – сульфат натрия
Ba(NO3 )2 - нитрат бария
Слайд 231. Запиши рядом знаки химических элементов, которые входят в состав вещества.
Алгоритм
сульфата железа (III ) (первый способ)
Fe
SO4
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Первый пункт выполнили переходим ко второму
Слайд 242. Над знаками химических элементов поставь их степень окисления.
Пример:
Fe
SO4
+3
-2
Второй пункт выполнили
Слайд 253. Определи Н.О.К. чисел выражающих степень окисления этих элементов. Запиши Н.О.К. в
Пример: Составить химическую формулу сульфата железа (III).
Fe
SO4
+3
-2
6
Третий пункт выполнили переходим ко четвертому
Н.О.К. (наименьшее общее кратное) – это число, которое делится на исходные числа без остатка.
Слайд 264. Раздели Н.О.К. на степень окисления каждого элемента.
Запиши полученный индекс.
Пример: Составить
Fe
(SO4)
+3
-2
2
3
6
2
3
Формула составлена
6
6
3
2
:
:
=
=
Слайд 27Составить формулу сульфата алюминия:
(второй способ)
Составьте формулы:
Упр. 3 стр. 78
Al
2
+
SO
4
3
( )
3
2
Слайд 28Составьте формулу
хлорида кальция
СаCl2
Составьте формулу
нитрата натрия
NaNO3
Zn(SO4)2
Cu NO3
Составьте формулу
сульфата цинка
Составьте
хлорида свинца (II)
Составьте формулу
нитрата меди (I)
PbCl2
Контрольное задание 2
Слайд 31"Среди всех природных минеральных солей, самая главная та, которую мы называем
Слайд 33Соль в геральдике российских городов
Герб Бахмута
Герб Солигалича
Герб Сольвычегодска
Герб
Герб Усолья-Сибирского
Герб Дрогобыча
Слайд 41Минералы карбоната кальция находятся в горных породах:
Известняк
Мел
Мрамор Мрамор Мрамор
Мрамор
Травертин
Слайд 42Мрамор – строительный материал
Единственное в России здание, полностью построенное из
нешлифованного
Слайд 45Лабораторный опыт. №1
Определите растворимость солей
Для этого:
-прибавьте в первую пробирку
натрия 5-10 мл воды ;
прибавьте во вторую пробирку к карбонату кальция
5-10 мл воды
Что произошло?
Вывод:
Слайд 48
Лабораторный опыт. №2
Определите в какой из трех пробирок находятся кислота, в
прибавьте в пробирку №1 универсальный лакмус
прибавьте в пробирку №2 универсальный лакмус
прибавьте в пробирку №3
универсальный лакмус
Что произошло?
Результаты опыта оформите в таблицу:
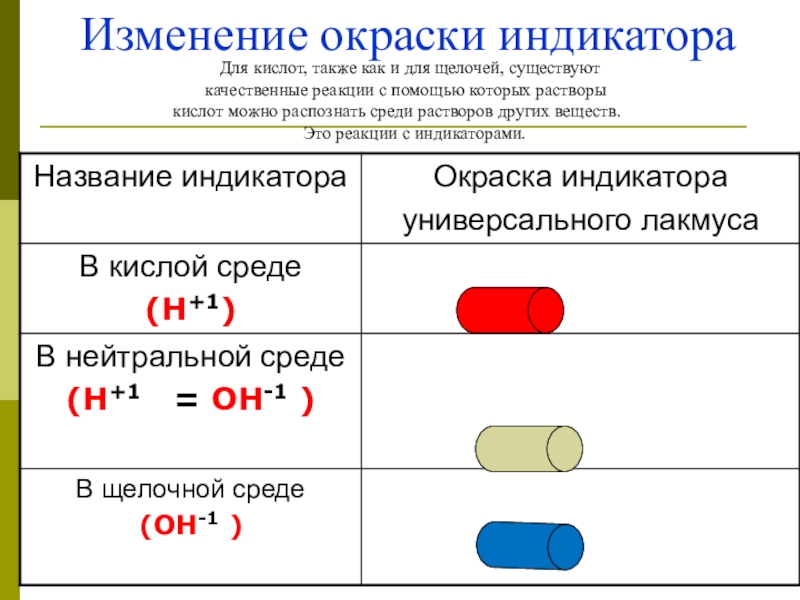
Слайд 49 Изменение окраски индикатора
Для кислот, также как и
качественные реакции с помощью которых растворы
кислот можно распознать среди растворов других веществ.
Это реакции с индикаторами.
Слайд 50Контрольное задание3
Ответте на вопросы:
1.Какая окраска индикатора в растворе хлорида натрия.
2.Раствор хлорида натрия. является : кислым, щелочным или нейтральным?
3. Следовательно соль хлорид натрия какая?
Слайд 53
Контрольное задание - итоговое
Часть А (задания с выбором ответа)
1. Соли
А) состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид- ионов.
Б) состоящие из ионов металлов и кислотных остатков;
В) состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2;
Г) молекулы, которых состоят из ионов водорода и кислотных остатков.
2. Хлорид железа (III) имеет формулу:
А) FeCl3; B) Fe2O3;
Б) FeCl2; Г) FeO.
Слайд 54
Контрольное задание - итоговое
Часть В
Выбери лишнее вещество и объясни
Игра « Третий лишний»
1. BaSO4; CaCO3; NaCl.
2. NaCl, Na2SO4, NaOH 3Al2(SO4)3, H2SO4, CaSO4
4. Cu(NO3)2, CuO, CuCl2
5. CaCl2, PbS, BaSO4.
Слайд 55
Контрольное задание - итоговое
Часть А
Г
А
Часть В
1. NaCl. т.к…
2. NaOH т.к... 3 H2SO4, т.к…
4. CuO, т.к…
5. CaCl2 т.к…
Слайд 56Домашнее задание
§,21 упр.3 стр. 78
Составить презентацию фосфата кальция или опорный конспект
Слайд 57Рефлексия
1. Сегодня я узнал…
2. Было интересно…
3. Было трудно…
4. Я выполнял задания…
5.
6. Теперь я могу…
7. Я почувствовал, что…
8. Я приобрёл…
9. Я научился…
10. У меня получилось…
11. Я смог…
12. Попробую…
13. Меня удивило…
14.Урок мне дал для жизни…
15. Мне захотелось…