- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соли азотной кислоты
Содержание
- 1. Презентация по химии на тему Соли азотной кислоты
- 2. “Nitrogenium” – от лат. “рождающий селитру” Нитраты
- 3. пустыня Атакама (Чили)
- 4. Пустыня известна своими богатыми залежами селитры, которая
- 5. Стремясь захватить богатые месторождения селитры, в 1879
- 6. Синтетические нитраты, изобретенные в Германии в начале
- 7. Физические свойства нитратов твердые кристаллические вещества, тугоплавкие, хорошо растворимые в воде, сильные электролиты
- 8. Химические свойства нитратов(общие с другими солями) соль
- 9. Разлагаются при нагревании
- 10. Примеры реакций: 2NaNO3 = 2NaNO2+O2
- 11. Качественная реакция на ион NO3– NaNO3
- 12. Нитраты, пестициды и болезни людей Исследователями США,
- 13. Для взрослого человека смертельная доза нитратов составляет
- 14. Определение нитратов Помимо фактов, которые указывают на
- 15. Слайд 15
- 16. Слайд 16
- 17. Очистка от нитратов Для того, чтобы уберечь
- 18. В майонезе и сметане, которыми заправляются салаты,
- 19. Домашнее задание П.20 упр.4 стр.59
“Nitrogenium” – от лат. “рождающий селитру” Нитраты – соли азотной кислотыСелитры - нитраты активных металлов (Na, K, Ca, Bа и аммония)
Слайд 2“Nitrogenium” – от лат. “рождающий селитру”
Нитраты – соли азотной кислоты
Селитры
- нитраты активных металлов (Na, K, Ca, Bа и аммония)
Слайд 4
Пустыня известна своими богатыми залежами селитры, которая в прошлом служила сырьем
для производства взрывчатых веществ и минеральных удобрений. Это единственное место в мире, где накопились ее останки, потому что селитра легко растворяется при выпадении осадков, а сухой климат пустыни идеально подходил для ее сохранения.
В 19 веке пустыня находилась под контролем Боливии, Перу и Чили и вскоре стала зоной конфликта в связи с неопределенными границами и открытием больших месторождений нитрата натрия (селитры). Конфликт по поводу контроля над этими ресурсами между Чили с одной стороны, и Боливией и Перу с другой вылился в Тихоокеанскую войну (1879-1883) между этими странами.
В 19 веке пустыня находилась под контролем Боливии, Перу и Чили и вскоре стала зоной конфликта в связи с неопределенными границами и открытием больших месторождений нитрата натрия (селитры). Конфликт по поводу контроля над этими ресурсами между Чили с одной стороны, и Боливией и Перу с другой вылился в Тихоокеанскую войну (1879-1883) между этими странами.
Слайд 5
Стремясь захватить богатые месторождения селитры, в 1879 году Чили напала на
Боливию, а потом в войну вступила Перу, которая имела договор о взаимопомощи с Боливией.
В результате успешной для Чили войны, она присоединила к себе провинцию Антофагаста, из-за чего Боливия потеряла выход к морю, а Перу потеряла провинцию Тарапака. Расположенные в этих районах богатейшие запасы селитры оказались под контролем Чили.
В конце 1930-х бум добычи природной селитры в Чили подошел к внезапному окончанию
В результате успешной для Чили войны, она присоединила к себе провинцию Антофагаста, из-за чего Боливия потеряла выход к морю, а Перу потеряла провинцию Тарапака. Расположенные в этих районах богатейшие запасы селитры оказались под контролем Чили.
В конце 1930-х бум добычи природной селитры в Чили подошел к внезапному окончанию
Слайд 6
Синтетические нитраты, изобретенные в Германии в начале 20 века, существенно подорвали
добычу природной селитры в Чили в конце 1930-начале 1940-х.
Если раньше добыча нитратов составляла почти 50% от валового национального продукта в Чили, на протяжении нескольких десятилетий ее добыча практически свелась к нулю. В общей сложности 170 шахтерских поселков и городов в пустыне Атакама были закрыты, и только в некоторых из них все еще продолжается добыча селитры. Сейчас пустыня усеяна примерно 170 брошенными шахтерскими городками.
Если раньше добыча нитратов составляла почти 50% от валового национального продукта в Чили, на протяжении нескольких десятилетий ее добыча практически свелась к нулю. В общей сложности 170 шахтерских поселков и городов в пустыне Атакама были закрыты, и только в некоторых из них все еще продолжается добыча селитры. Сейчас пустыня усеяна примерно 170 брошенными шахтерскими городками.
Слайд 7Физические свойства нитратов
твердые кристаллические вещества,
тугоплавкие,
хорошо растворимые в воде,
сильные электролиты
Слайд 8Химические свойства нитратов
(общие с другими солями)
соль + Me = соль1
+ Me1
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu↓
Cu2+ + Fe0 = Fe2+ + Cu0↓
соль + кислота = соль1 + кислота1
Ba(NO3)2 + H2SO4 = BaSO4 ↓ + 2HNO3
Ba2+ + SO4 2–= BaSO4 ↓
соль + щелочь = нерастворимое основание + соль
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu2+ + 2OH– = Cu(OH)2↓
соль (р-мая) + соль1 (р-мая) = соль' + соль''↓
AgNO3 + KCl = KNO3 + AgCl↓
Ag+ + Cl– = AgCl↓
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu↓
Cu2+ + Fe0 = Fe2+ + Cu0↓
соль + кислота = соль1 + кислота1
Ba(NO3)2 + H2SO4 = BaSO4 ↓ + 2HNO3
Ba2+ + SO4 2–= BaSO4 ↓
соль + щелочь = нерастворимое основание + соль
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu2+ + 2OH– = Cu(OH)2↓
соль (р-мая) + соль1 (р-мая) = соль' + соль''↓
AgNO3 + KCl = KNO3 + AgCl↓
Ag+ + Cl– = AgCl↓
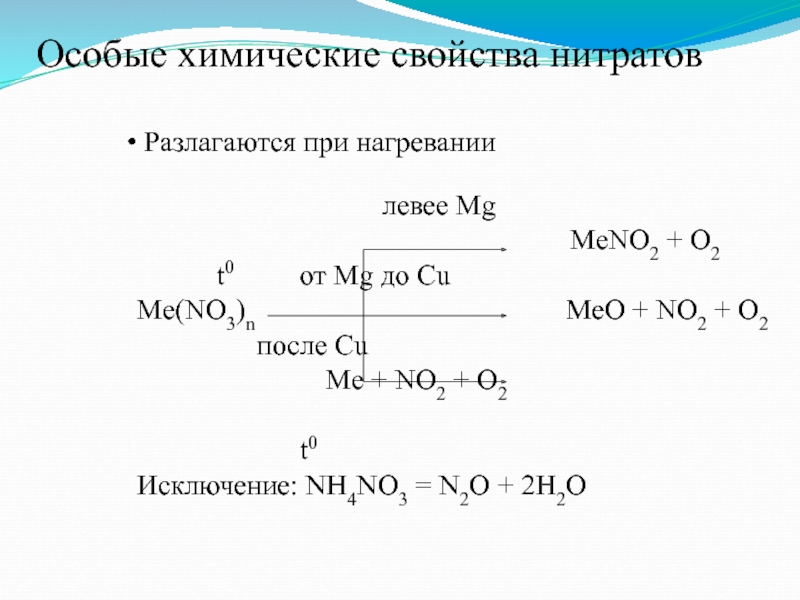
Слайд 9 Разлагаются при нагревании
левее Mg
МеNO2 + O2 t0 от Mg до Cu
Me(NO3)n MeO + NO2 + O2
после Cu Me + NO2 + O2
t0
Исключение: NH4NO3 = N2O + 2H2O
МеNO2 + O2 t0 от Mg до Cu
Me(NO3)n MeO + NO2 + O2
после Cu Me + NO2 + O2
t0
Исключение: NH4NO3 = N2O + 2H2O
Особые химические свойства нитратов
Слайд 10Примеры реакций:
2NaNO3 = 2NaNO2+O2
нитрит
натрия
2Cu(NO3)2 = 2CuO + 4NO2 +O2
2AgNO3 = 2Ag + 2NO2 + O2
натрия
2Cu(NO3)2 = 2CuO + 4NO2 +O2
2AgNO3 = 2Ag + 2NO2 + O2
Слайд 11 Качественная реакция на ион NO3–
NaNO3 + H2SO4конц = NaHSO4
+ HNO3
t0
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
t0
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
Особые химические свойства нитратов
Слайд 12Нитраты, пестициды и болезни людей
Исследователями США, Германии, Чехословакии, России установлено, что
нитраты и нитриты вызывают у человека метгемоглобинемию, рак желудка, отрицательно влияют на нервную и сердечно-сосудистую системы, на развитие эмбрионов.
Метгемоглобинемия — это кислородное голодание (гипоксия), вызванное переходом гемоглобина крови в метгемоглобин, не способный переносить кислород. Метгемоглобин образуется при поступлении нитритов в кровь. При содержании метгемоглобина в крови около 15% появляется вялость, сонливость, при содержании более 50% наступает смерть, похожая на смерть от удушья. Заболевание характеризуется одышкой, тахикардией, цианозом в тяжелых случаях — потерей сознания, судорогами, смертью
Отравления происходили при употреблении воды и продуктов растительного и животного происхождения с высоким содержанием нитратов или нитритов. Наиболее чувствительны к избытку нитратов дети первых месяцев жизни. Р. Д. Габович, ссылаясь на зарубежные источники, сообщает об отравлениях детей овощными соками и овощами с повышенным содержанием нитратов, в частности соком моркови. Источником отравления был сок, который пили через 1—2 суток после приготовления. В 1 л сока накапливалось до 770 мг нитритов.
Метгемоглобинемия — это кислородное голодание (гипоксия), вызванное переходом гемоглобина крови в метгемоглобин, не способный переносить кислород. Метгемоглобин образуется при поступлении нитритов в кровь. При содержании метгемоглобина в крови около 15% появляется вялость, сонливость, при содержании более 50% наступает смерть, похожая на смерть от удушья. Заболевание характеризуется одышкой, тахикардией, цианозом в тяжелых случаях — потерей сознания, судорогами, смертью
Отравления происходили при употреблении воды и продуктов растительного и животного происхождения с высоким содержанием нитратов или нитритов. Наиболее чувствительны к избытку нитратов дети первых месяцев жизни. Р. Д. Габович, ссылаясь на зарубежные источники, сообщает об отравлениях детей овощными соками и овощами с повышенным содержанием нитратов, в частности соком моркови. Источником отравления был сок, который пили через 1—2 суток после приготовления. В 1 л сока накапливалось до 770 мг нитритов.
Слайд 13
Для взрослого человека смертельная доза нитратов составляет от 8 до 14
г, острые отравления наступают при приеме от 1 до 4 г нитратов. Если до 60-х годов главной опасностью неумеренного использования нитратных удобрений считалась метгемоглобинемия, то сейчас большинство исследователей считают главной опасностью рак, в первую очередь рак желудочно-кишечного тракта.
В присутствии нитритов канцерогенные нитрозамиды и нитрозамины могут синтезироваться практически из любых продуктов как в желудке, так и в кишечнике.
В Колумбии обнаружена прямая взаимосвязь между частотой заболевания раком желудка, атрофическим гастритом и высоким содержанием нитратов в воде колодцев и моче жителей.
В различных областях Чили и Венгрии выявлена связь между количеством применяемых азотных удобрении и смертностью от рака желудка.
В Англии, в г. Уорксопе, врачи считают причиной высокой заболеваемости раком большое количество нитратов в питьевой воде—90 мг в литре.
В присутствии нитритов канцерогенные нитрозамиды и нитрозамины могут синтезироваться практически из любых продуктов как в желудке, так и в кишечнике.
В Колумбии обнаружена прямая взаимосвязь между частотой заболевания раком желудка, атрофическим гастритом и высоким содержанием нитратов в воде колодцев и моче жителей.
В различных областях Чили и Венгрии выявлена связь между количеством применяемых азотных удобрении и смертностью от рака желудка.
В Англии, в г. Уорксопе, врачи считают причиной высокой заболеваемости раком большое количество нитратов в питьевой воде—90 мг в литре.
Слайд 14Определение нитратов
Помимо фактов, которые указывают на наличие нитратов в том или
ином продукте, существует еще один способ определить количество ядовитых веществ - воспользоваться нитратомером. Данный прибор способен за несколько секунд показать уровень содержащихся нитратов. Самый распространенный нитратомер - нитрат тестер соэкс, его цена варьируется около 6000 рублей.
Определить наличие высокого содержания нитратов в арбузе, например, можно несколькими способами:
1. Если красная мякоть арбуза отдает фиолетовым оттенком, то этот арбуз нитратный.
2. Волокна, направляющиеся от сердцевины арбуза к корке, должны быть белые. Если же они желтые - это показатель высокого содержания нитратов.
3. Если вода, в которой была растерта мякоть арбуза, стала розовой или красной, то это, опять-таки, показатель нитратов, так как при такой процедуре вода должна просто помутнеть.
4. Срез арбуза не должен быть гладким и глянцевым, у хорошего арбуза он должен быть крупинчатым.
Слайд 16 Выводы
1.При остром отравлении нитраты
вызывают у человека метгемоглобинемию различной тяжести, вплоть до смертельного исхода; при хроническом отравлении — рак желудка, изменение функций центральной нервной системы и сердечной деятельности.
К избытку нитратов в воде и пище наиболее чувствительны дети, особенно первого года жизни. 2. Нитраты как социально - экологическая проблема
К избытку нитратов в воде и пище наиболее чувствительны дети, особенно первого года жизни. 2. Нитраты как социально - экологическая проблема
Слайд 17Очистка от нитратов
Для того, чтобы уберечь себя от отравления нитратами:
Храните овощи
и любые плоды в холодильнике, так как при низкой температуре нитраты не смогут превратится в нитриты.
Употребляйте в пищу только те части растений, в которых даже логически меньше нитратов.
Тщательно мойте овощи и очищайте их от кожуры - это снизит нитраты на 15%.
Если замочить зелень на 2 часа в воде, то из них вымоется 20% нитратов. То же самое касается моркови, свеклы, картофеля и капусты - час в воде и минус 25-30% нитратов.
Овощи следует варить. Картофель - минус 80% нитратов, капуста и морковь - 70%, свекла - 40%.
Все свежевыжатые соки из овощей и салаты употребляйте сразу, так как их хранение обеспечит рождение нитритов из нитратов.
Слайд 18
В майонезе и сметане, которыми заправляются салаты, стремительно развивается микрофлора, способствующая
образованию нитритов из нитратов.
При приготовлении овощного супа, вымочите овощи в воде, а потом уже забросьте в кипящую воду.
Если овощи тушить, то содержание нитратов снизится на 10%.
Если делаете овощные заготовки, то они должны будут находиться в прохладном и темном месте, к приходу весны нитраты в них снизятся на 20-30%.