- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соединения серы. Кислотные осадки. (9 класс)
Содержание
- 1. Презентация по химии на тему Соединения серы. Кислотные осадки. (9 класс)
- 2. Цели урока:Обучающие: изучить строение
- 3. Основные соединения серы: Н2S – сероводород;
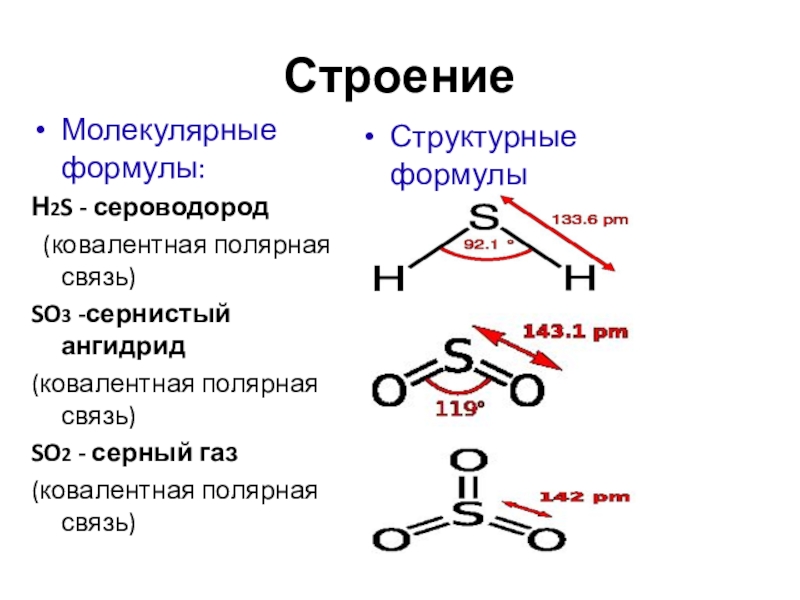
- 4. СтроениеМолекулярные формулы:Н2S - сероводород (ковалентная полярная связь)SO3 -сернистый ангидрид(ковалентная полярная связь)SO2 - серный газ (ковалентная полярная связь)Структурные формулы
- 5. Слайд 5
- 6. В природе H2S встречается гл.
- 7. Физические свойства. Сероводород Н2S — бесцветный газ с
- 8. Химические свойства
- 9. H2S является очень слабой кислотой:H2S →
- 10. 6) Качественная реакция на сероводород и растворимые сульфиды
- 11. Сернистый газ SO2 – сернистый газ.
- 12. SO3 — типичный кислотный оксид, ангидрид серной
- 13. Химические свойства1) Сернистый ангидрид - кислотный
- 14. Качественной реакцией на соли сернистой кислоты является взаимодействие
- 15. Основные соединения серы: Н2S – сероводород;
- 16. Вопросы для фронтальной беседы с классом:
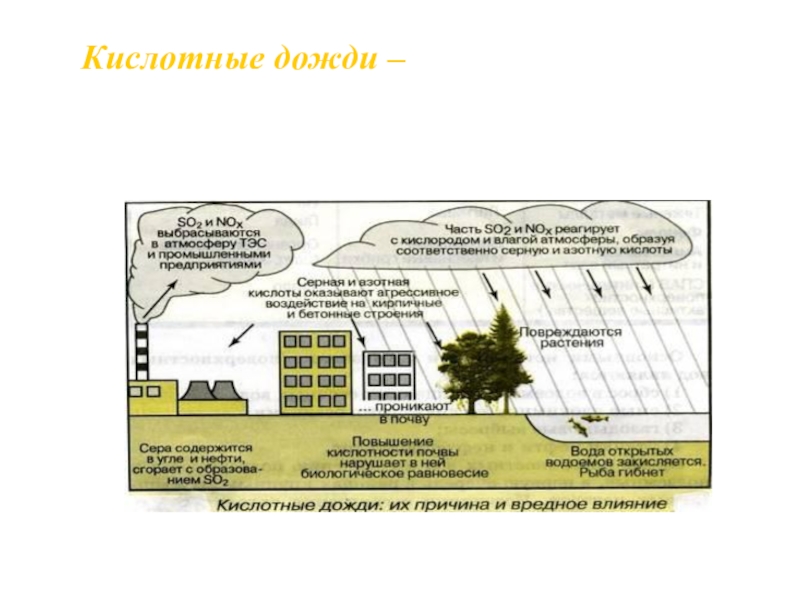
- 17. Производственная деятельность человека нанесла биосфере серьезный
- 18. Кислотные дожди – атмосферные осадки, имеющие кислую
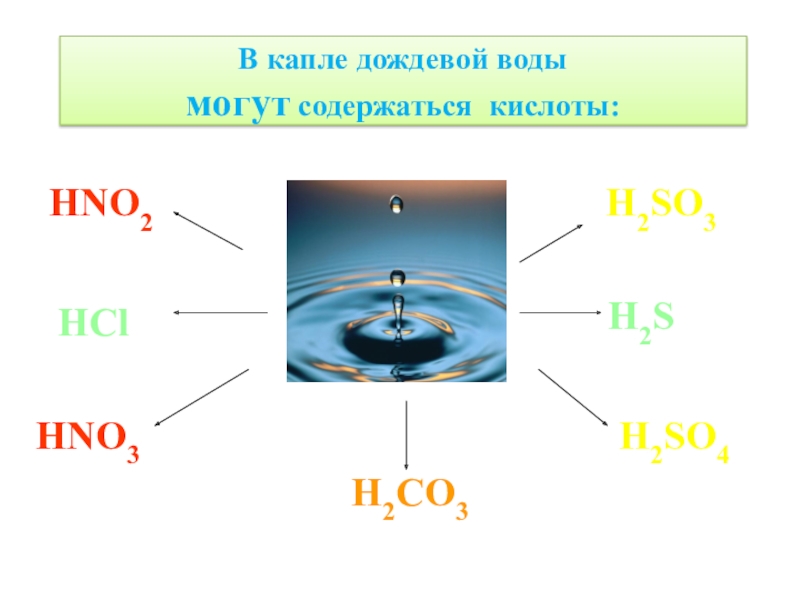
- 19. В капле дождевой воды
- 20. Природные источники кислотных дождейH2S→SO2→SO3→H2SO4CO→CO2→H2CO3
- 21. Причины образования кислотных дождейвулканыЕстественные причиныгроза
- 22. Природные источники кислотных дождей
- 23. Причины образования кислотных дождейИскусственные источникиминеральные удобрениясжигание топливатопливо самолетовнефтепереработкаавтотранспорт
- 24. Причины образования кислотных дождейЕжегодно в атмосферу Земли
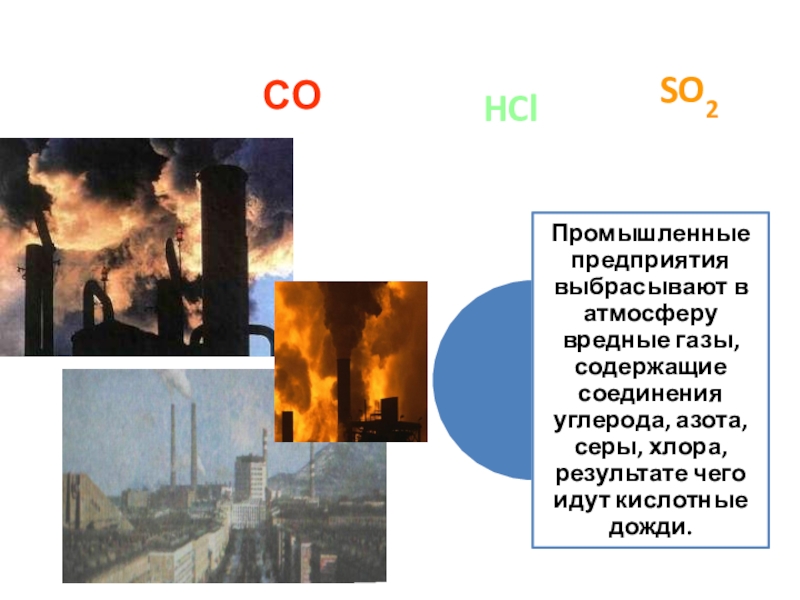
- 25. NO2SO2ИСТОЧНИКИ ЗАРГЯЗНЕНИЯ АТМОСФЕРЫСОHCl
- 26. СОСО2СОNО2ИСТОЧНИКИ ЗАРГЯЗНЕНИЯ АТМОСФЕРЫSO2
- 27. СераПри извержениях вулканов преобладает оксид серы (IV),
- 28. H2SSO2CO2NO2ИСТОЧНИКИ ЗАРГЯЗНЕНИЯ АТМОСФЕРЫNH3
- 29. Кислотные дожди губительно действуют на все живое
- 30. Последствия кислотных дождей в природеВ результате выпадения
- 31. Последствия кислотных дождей в архитектуреКислотные осадки разрушают
- 32. Последствия кислотных дождей в архитектуреТакая же судьба
- 33. Последствия кислотных дождей… в Санкт-Петербурге – Казанскому собору, Александро-Невской Лавре и др.
- 34. Последствия кислотных дождей в архитектуреНа соборе
- 35. Последствия кислотных дождейВ каждом регионе имеются здания,
- 36. При попадании в водоемы кислотные дожди вызывают гибель рыбы и других живых организмов.
- 37. Используемые ресурсыАликберова Л.Ю. Занимательная химия. М.: Изд-во
Цели урока:Обучающие: изучить строение основных соединений серы;
Слайд 1Муниципальное бюджетное общеобразовательное учреждение Носковская школа
Презентация
Урок химии
Соединения серы. Кислотные осадки.
Выполнила:
Коршунова Нина Владимировна
учитель химии
Слайд 2Цели урока:
Обучающие: изучить строение
основных соединений серы; изучить распространение соединений серы в природе, применение основных соединений серы и их воздействие на окружающую среду.
Развивающие: развить представление учащихся о важнейших соединениях серы.
Воспитательные: продемонстрировать практическую направленность знаний о соединениях серы.
Развивающие: развить представление учащихся о важнейших соединениях серы.
Воспитательные: продемонстрировать практическую направленность знаний о соединениях серы.
Слайд 3
Основные соединения серы:
Н2S – сероводород;
SO2 - серный газ;
SO3 -сернистый ангидрид;
Н2SO3 - сернистая
кислота;
Н2SO4 - серная кислота
Н2SO4 - серная кислота
Слайд 4Строение
Молекулярные формулы:
Н2S - сероводород
(ковалентная полярная связь)
SO3 -сернистый ангидрид
(ковалентная полярная связь)
SO2 - серный
газ
(ковалентная полярная связь)
(ковалентная полярная связь)
Структурные формулы
Слайд 5 СЕРОВОДОРОД
Бесцветный газ с
резким запахом тухлых яиц
Термически неустойчив, плохо растворим в воде. Лучше, чем в воде, сероводород растворим в органических растворителях; температура кипения - 60,35 °С, плотность 0,938 г/см3 (-81 °С)
Водный раствор – сероводородная кислота (слабая)
Термически неустойчив, плохо растворим в воде. Лучше, чем в воде, сероводород растворим в органических растворителях; температура кипения - 60,35 °С, плотность 0,938 г/см3 (-81 °С)
Водный раствор – сероводородная кислота (слабая)
Слайд 6 В природе H2S встречается гл. обр. в месторождениях нефти и прир. газа,
а также в вулканич. газах и водах минер. источников; он растворен в глубоких (ниже 150-200 м) слоях воды Черного моря (концентрация сероводорода у дна достигает 11-14 мл/л). Сероводород постоянно образуется белковых в-в. при разложении
Слайд 7Физические свойства.
Сероводород Н2S — бесцветный газ с запахом тухлых яиц, ядовит.
Один объем воды при обычных условиях растворяет 3 объема сероводорода. Сероводород — очень ядовитый газ, поражающий нервную систему. Поэтому работать с ним надо в вытяжных шкафах или с герметически закрывающимися приборами. Допустимое содержание H2S в производственных помещениях составляет 0,01 мг в 1 л воздуха.
Раствор сероводорода а воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой кислоты
Раствор сероводорода а воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой кислоты
Слайд 8 Химические свойства
1) Раствор H2S в воде –
слабая двухосновная кислота.
Диссоциация происходит в две ступени:
H2S → H+ + HS- (первая ступень, образуется гидросульфид - ион)
HS- → 2H+ + S2- (вторая ступень)
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды):
Na2S – сульфид натрия;
CaS – сульфид кальция;
NaHS – гидросульфид натрия;
Ca(HS)2 – гидросульфид кальция.
Диссоциация происходит в две ступени:
H2S → H+ + HS- (первая ступень, образуется гидросульфид - ион)
HS- → 2H+ + S2- (вторая ступень)
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды):
Na2S – сульфид натрия;
CaS – сульфид кальция;
NaHS – гидросульфид натрия;
Ca(HS)2 – гидросульфид кальция.
Слайд 9
H2S является очень слабой кислотой:
H2S → HS− + H+
Сероводород —
сильный восстановитель.
На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O (на этой реакции основан промышленный способ получения серы).
На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O (на этой реакции основан промышленный способ получения серы).
Химические свойства
Слайд 106) Качественная реакция на сероводород и растворимые сульфиды -образование темно-коричневого (почти черного)
осадка PbS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Pb2+ + S2- → PbS↓
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Pb2+ + S2- → PbS↓
Слайд 11Сернистый газ
SO2 – сернистый газ. Очень токсичен.
В нормальных условиях представляет
собой бесцветный газ с характерным резким запахом. Под давлением сжижается при комнатной температуре. Растворяется в воде - растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Слайд 12SO3 — типичный кислотный оксид, ангидрид серной кислоты
1. Кислотно-основные: При взаимодействии
с водой образует серную кислоту:
SO3 + H2O → H2SO4
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3
SO3 + H2O → H2SO4
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3
Слайд 13 Химические свойства
1) Сернистый ангидрид - кислотный оксид.
взаимодействие с водой
При растворении
в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)
Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион)
HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион)
HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Слайд 14Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой,
при этом выделяется газ SO2 с резким запахом:
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O
2H+ + SO32- → SO2 ↑+ H2O
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O
2H+ + SO32- → SO2 ↑+ H2O
Слайд 15
Основные соединения серы:
Н2S – сероводород;
SO2 - серный газ;
SO3 -сернистый ангидрид;
Н2SO3 - сернистая
кислота;
Н2SO4 - серная кислота
Н2SO4 - серная кислота
Слайд 16
Вопросы для фронтальной беседы с классом:
-Опишите физические свойства серы.
Сколько модификаций у серы? Какова причина аллотропии у серы?
-Как взаимодействует сера с металлами ? В каких случаях сера выступает как окислитель, и в каких – как восстановитель?
-Назовите важнейшие соединения минералы серы. Где применяются соединения серы.
-Как взаимодействует сера с металлами ? В каких случаях сера выступает как окислитель, и в каких – как восстановитель?
-Назовите важнейшие соединения минералы серы. Где применяются соединения серы.
Слайд 17 Производственная деятельность человека нанесла биосфере серьезный урон. Загрязнение окружающей среды в
нашем сознании
связывается с отравлением воды,
воздуха, земли, которое может влиять
на здоровье и самочувствие человека.
Однако химическое загрязнение чревато и косвенными эффектами.
В наши дни проблема охраны окружающей среды чрезвычайно возросла в связи с воздействием человека на природу.
Слайд 18Кислотные дожди – атмосферные осадки, имеющие кислую реакцию из-за содержания в
воздухе оксидов серы, азота и других веществ.
Слайд 23Причины образования кислотных дождей
Искусственные источники
минеральные удобрения
сжигание топлива
топливо самолетов
нефтепереработка
автотранспорт
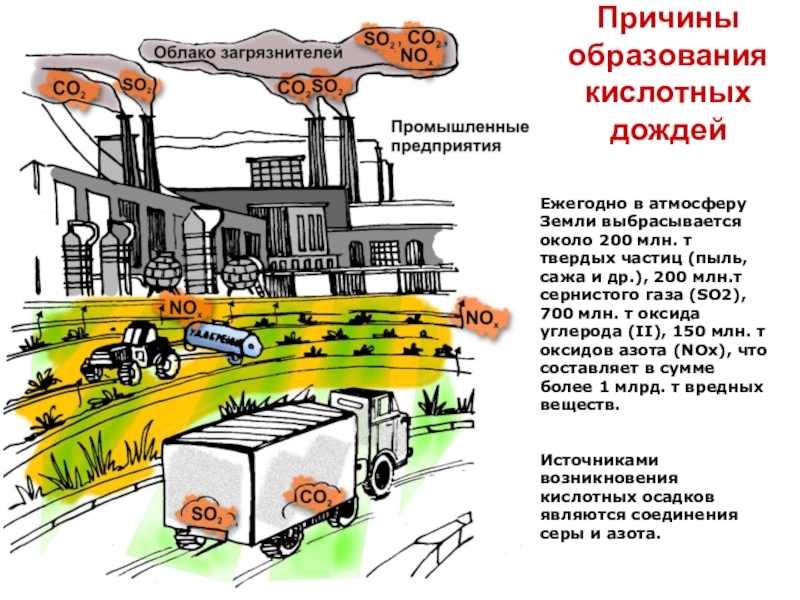
Слайд 24Причины образования кислотных дождей
Ежегодно в атмосферу Земли выбрасывается около 200 млн.
т твердых частиц (пыль, сажа и др.), 200 млн.т сернистого газа (SO2), 700 млн. т оксида углерода (II), 150 млн. т оксидов азота (NOx), что составляет в сумме более 1 млрд. т вредных веществ.
Источниками возникновения кислотных осадков являются соединения серы и азота.
Источниками возникновения кислотных осадков являются соединения серы и азота.
Слайд 27Сера
При извержениях вулканов преобладает оксид серы (IV), в меньшем количестве в
атмосферу поступает сероводород. Ежегодно во всем мире в результате вулканической деятельности выделяется 4-16 млн. т соединений серы.
Слайд 30Последствия кислотных дождей
в природе
В результате выпадения кислотных осадков нарушается равновесие в
экосистемах, ухудшается продуктивность сельскохозяйственных растений и питательные свойства почв.
Слайд 31Последствия кислотных дождей
в архитектуре
Кислотные осадки разрушают сооружения из мрамора и известняка.
Исторические памятники Греции и Рима, простояв тысячелетия, за последние годы разрушаются прямо на глазах.
Слайд 32Последствия
кислотных дождей
в архитектуре
Такая же судьба грозит
и Тадж-Махалу –
шедевру индийской
архитектуры
периода Великих моголов,
в Лондоне - Тауэру и
Вестминстерскому
аббатству…
Слайд 33Последствия
кислотных дождей
… в Санкт-Петербурге –
Казанскому собору,
Александро-Невской Лавре и др.
Слайд 34Последствия кислотных дождей
в архитектуре
На соборе Св. Павла слой портлендского известняка
изъеден на 2.5 см.
В Голландии статуи на соборе Св. Иоанна "тают, как леденцы".
Черными отложениями, этим "раком камня", изъеден королевский дворец на площади Дам в Амстердаме.
В Голландии статуи на соборе Св. Иоанна "тают, как леденцы".
Черными отложениями, этим "раком камня", изъеден королевский дворец на площади Дам в Амстердаме.
Слайд 35Последствия кислотных дождей
В каждом регионе имеются здания, подвергшиеся разрушению в результате
кислотных осадков. Перечислите сооружения и памятники архитектуры вашего региона, которые подверглись, с вашей точки зрения, воздействию кислотных осадков.
Слайд 37Используемые ресурсы
Аликберова Л.Ю. Занимательная химия. М.: Изд-во "АСТ - ПРЕСС", 1999
Гроссе
Э.. Химия для любознательных. Ленинград, 1995
CD/ издательство «Учитель» компакт-диск -2009 г.
Новый справочник по химии. М., «Большая медведица», 1999г.
Мультимедийное приложение к УМК «Химия» 9 класс. Электронное учебное издание. Дрофа.
Энциклопедический словарь юного химика., М., Педагогика, 2005 г
http://schoolchemistry.by.ru/katalog/sernayakislota.htm
http://schoolchemistry.by.ru/katalog/sernayakislota.htm
CD/ издательство «Учитель» компакт-диск -2009 г.
Новый справочник по химии. М., «Большая медведица», 1999г.
Мультимедийное приложение к УМК «Химия» 9 класс. Электронное учебное издание. Дрофа.
Энциклопедический словарь юного химика., М., Педагогика, 2005 г
http://schoolchemistry.by.ru/katalog/sernayakislota.htm
http://schoolchemistry.by.ru/katalog/sernayakislota.htm