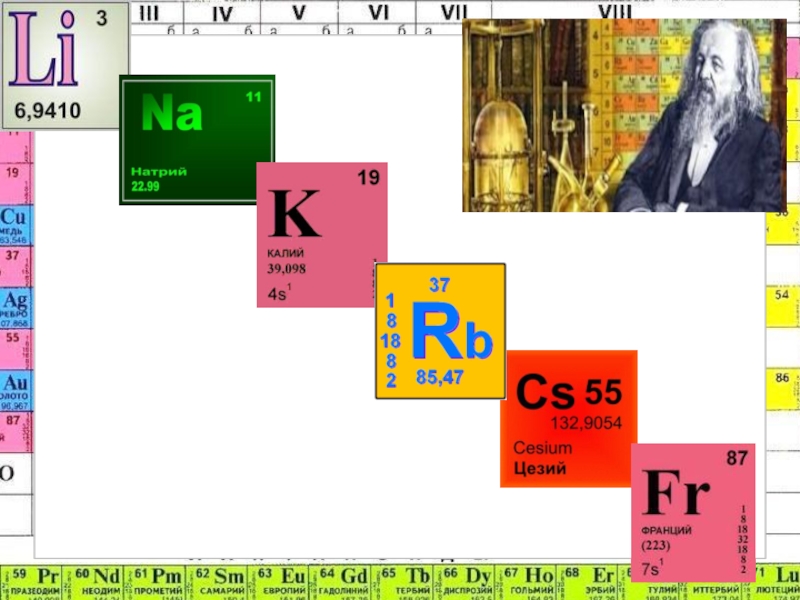
в) калий;
б) цезий; г) медь.
2. Электронная формула 1s2 2s2 2p6 3s2 3p6 4s1 соответствует элементу:
а) литию; в) калию;
б) натрию; г) меди.
3. Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически; в) не изменяется;
б) увеличивается; г) уменьшается.
4. Щелочные металлы проявляют очень сильные:
а) окислительные свойства; в) восстановительные свойства;
б) амфотерные свойства; г) нейтральные свойства.
5. Во всех своих соединениях щелочные металлы проявляют степень окисления:
а) +1; в) +2;
б) +3; г) +4.
6. К физическим свойствам щелочных металлов не относится:
а) серебристо-белые; в) хорошие электропроводники;
б) мягкие и легкие; г) тугоплавкие.
7. При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота; в) оксид и выделяется водород;
б) щелочь и выделяется водород; г) соль .
8. При взаимодействии кислорода со щелочными металлами пероксид образуется только с:
а) литием; в) цезием
б) натрием; г) рубидием.
9. Натрий и калий хранят в керосине, потому что они:
а) имеют резкий запах; в) легко окисляются на воздухе;
б) очень легкие; г) сильные окислители
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Соединения щелочных металлов (9 класс)
Содержание
- 1. Презентация по химии на тему Соединения щелочных металлов (9 класс)
- 2. Тест по теме «Щелочные металлы»1. К щелочным
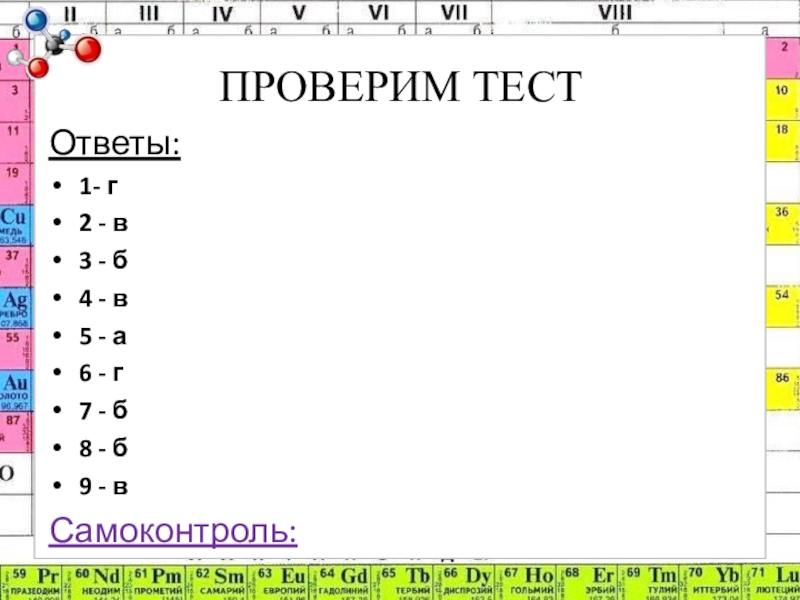
- 3. ПРОВЕРИМ ТЕСТОтветы: 1- г 2 - в
- 4. Слайд 4
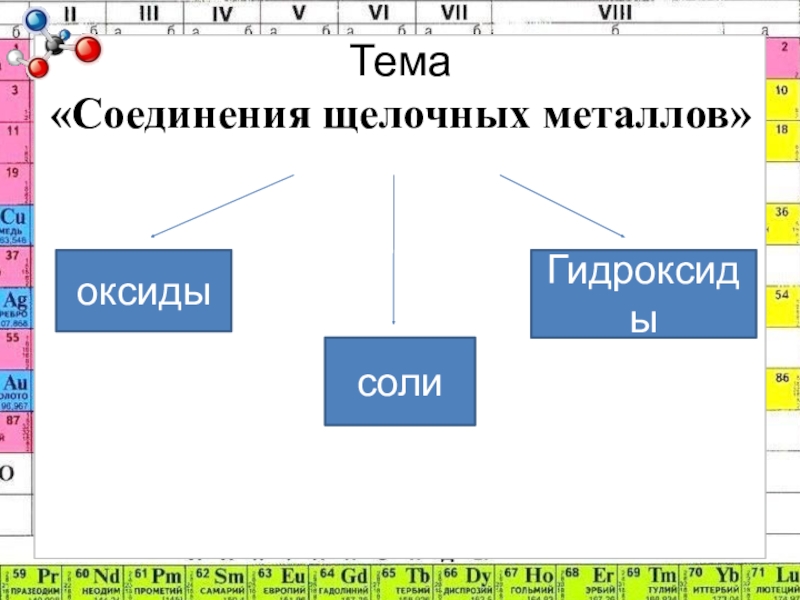
- 5. Тема «Соединения щелочных металлов»оксидыГидроксидысоли
- 6. Оксиды Щ.М.
- 7. Гидроксиды Щ.М.Твёрдые белые вещества, очень гигроскопичны. Хорошо
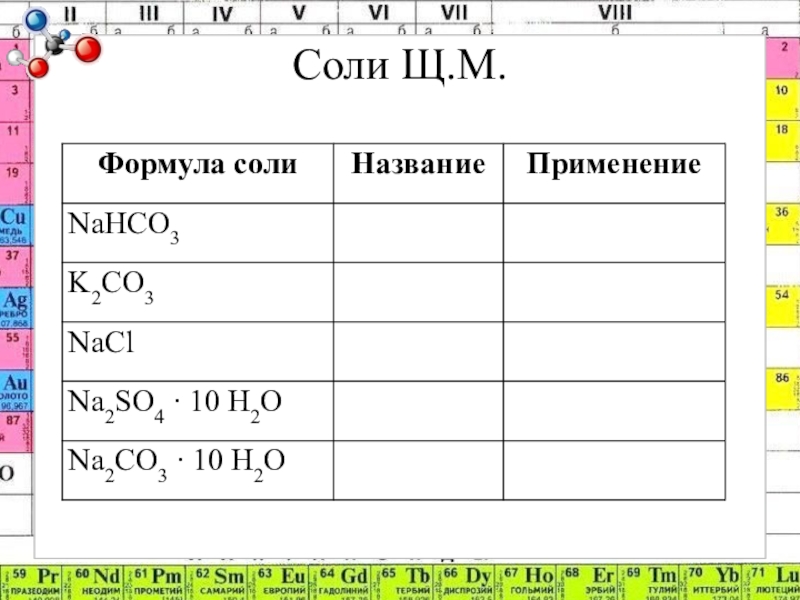
- 8. Соли Щ.М.
- 9. Слайд 9
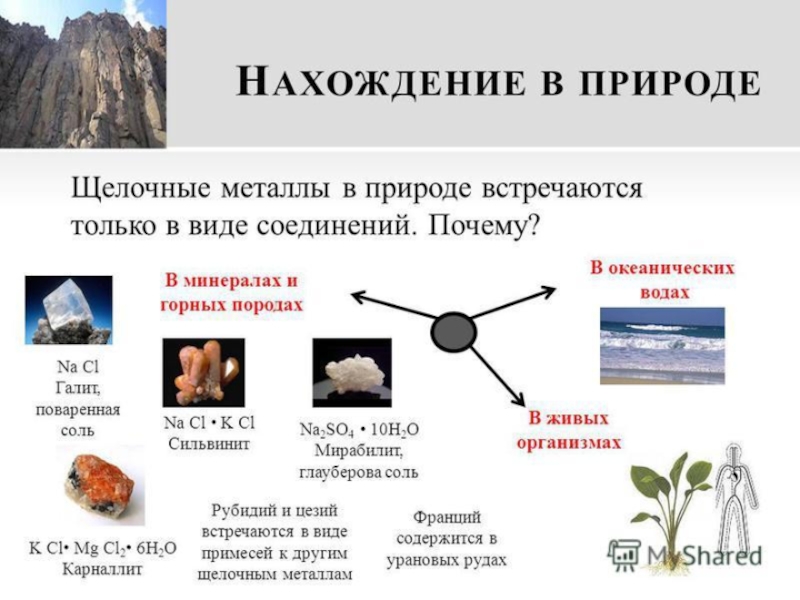
- 10. Слайд 10
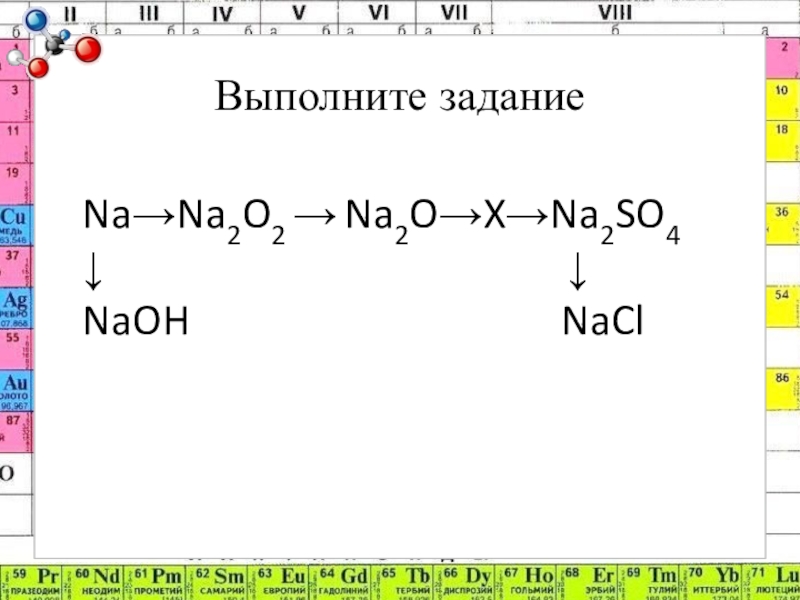
- 11. Выполните заданиеNa→Na2O2 → Na2O→X→Na2SO4↓
- 12. Ответим на вопросы1. Что нового вы узнали
- 13. Домашнее задание § 14 упр. 1
Тест по теме «Щелочные металлы»1. К щелочным металлам не относится: а) рубидий; в) калий; б) цезий;
Слайд 3ПРОВЕРИМ ТЕСТ
Ответы:
1- г
2 - в
3 - б
4
- в
5 - а
6 - г
7 - б
8 - б
9 - в
Самоконтроль:
нет ошибок – «5»,
1,2 ошибки – «4»,
3,4 ошибки – «3»,
более – «2»
5 - а
6 - г
7 - б
8 - б
9 - в
Самоконтроль:
нет ошибок – «5»,
1,2 ошибки – «4»,
3,4 ошибки – «3»,
более – «2»
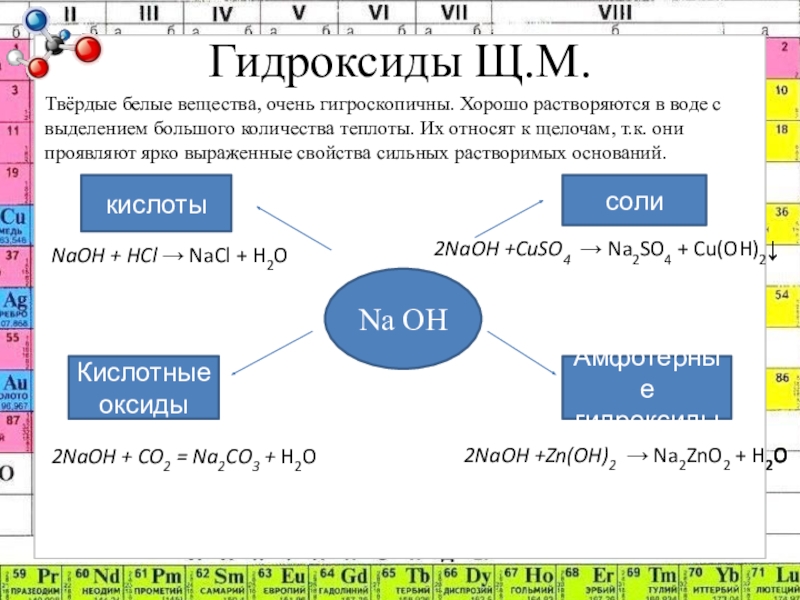
Слайд 7Гидроксиды Щ.М.
Твёрдые белые вещества, очень гигроскопичны. Хорошо растворяются в воде с
выделением большого количества теплоты. Их относят к щелочам, т.к. они проявляют ярко выраженные свойства сильных растворимых оснований.
Na OH
соли
Амфотерные гидроксиды
кислоты
Кислотные оксиды
NaOH + HCl → NaCl + H2O
2NaOH +CuSO4 → Na2SO4 + Cu(OH)2↓
2NaOH +Zn(OH)2 → Na2ZnO2 + H2O
2NaOH + CO2 = Na2CO3 + H2O
Слайд 12Ответим на вопросы
1. Что нового вы узнали сегодня на уроке?
2. Какие
затруднения у вас возникли при работе?
3. Помогло ли вам выполнение лабораторной работы при изучении нового материала?
4. Остались ли вопросы по новой теме
3. Помогло ли вам выполнение лабораторной работы при изучении нового материала?
4. Остались ли вопросы по новой теме