- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Сложные эфиры
Содержание
- 1. Презентация по химии на тему Сложные эфиры
- 2. Сложные эфиры (1)Сложными эфирами называют производные карбоновых
- 3. Общая формула сложных эфиров такая же, как
- 4. Номенклатура сложных эфиров Сложные эфиры в большинстве
- 5. Изомерия сложных эфиров Изомерия сложных эфиров определяется
- 6. Физические свойства сложных эфировСложные эфиры простейших и
- 7. Сложные эфиры низших карбоновых кислот и простейших
- 8. Такие реакции с кислородными нуклеофилами (водой и
- 9. Таблица 1. Показатели пожарной опасности сложных эфиров
- 10. Этилацетат – жидкость с приятным запахом, легко
- 11. Синтез эфировОсновные методы получения эфиров
- 12. Этерификация — взаимодействие кислот и спиртов в условиях
- 13. взаимодействие ангидридов или галогенангидридов карбоновых кислот со
- 14. Алкоголиз нитрилов в присутствии кислот: RCN +
- 15. ПрименениеЭфиры муравьиной кислоты:HCOOCH3 — метилформиат, tкип = 32 °C;
- 16. Эфиры уксусной кислоты:CH3COOCH3 — метилацетат, tкип = 58 °C;
- 17. Эфиры масляной кислоты:C3H7COOCH3 — метилбутират, tкип = 102,5 °C;
- 18. Применение в медицинеВ конце XIX — начале XX
- 19. Жиры(2)
- 20. Жиры́, или триглицери́ды — природные органические соединения, полные
- 21. Слайд 21
- 22. Состав жировСостав жиров определили французские ученые М.
- 23. Природные жиры содержат в своём составе три
- 24. Природные жиры чаще всего содержат следующие жирные кислоты:Насыщенные: Алкановые кислоты:стеариновая (C17H35COOH)маргариновая (C16H33COOH)пальмитиновая (C15H31COOH)капроновая (C5H11COOH)масляная (C3H7COOH)
- 25. Ненасыщенные:1)Алкеновые кислоты:пальмитолеиновая (C15H29COOH, 1 двойная связь)олеиновая (C17H33COOH,
- 26. Животные жирыЧаще всего в животных жирах встречаются
- 27. Растительные маслаВ растениях жиры содержатся в сравнительно
- 28. Свойства жировЭнергетическая ценность жира приблизительно равна 9,3
- 29. Кислоты в жирах
- 30. Физические свойстваЖиры — вязкие жидкости или твёрдые вещества,
- 31. Номенклатура жировНоменклатура жиров довольно сложная. По систематической
- 32. Слайд 32
- 33. Гидролиз жировГидролиз для жиров характерен, так как
- 34. Гидрирование жировВ составе растительных масел содержатся остатки
- 35. Пищевые свойства жировЖиры являются одним из основных
- 36. Применение жиров Пищевая промышленность (в частности, кондитерская). Фармацевтика Производство мыла и косметических изделий Производство смазочных материалов
- 37. Мыла(3)
- 38. — жидкий или твёрдый продукт, содержащий поверхностно-активные
- 39. СоставВ химическом отношении основным компонентом твёрдого мыла
- 40. С увеличением молярной массы растворимость мыла в
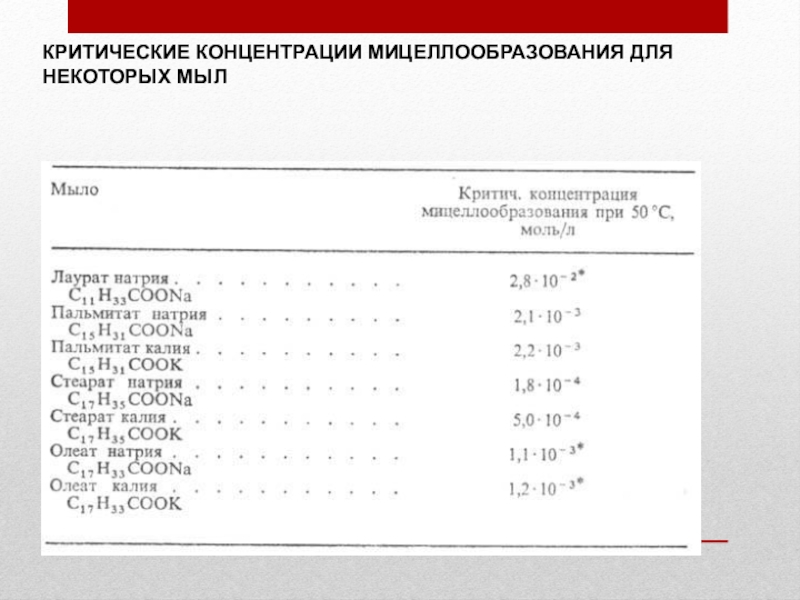
- 41. КРИТИЧЕСКИЕ КОНЦЕНТРАЦИИ МИЦЕЛЛООБРАЗОВАНИЯ ДЛЯ НЕКОТОРЫХ МЫЛ
- 42. Виды мыла1)Хозяйственное мылоПри охлаждении клеевого мыла получается
- 43. 2)Мыло ручной работыМыло возможно производить вручную несколькими
- 44. Мыло ручной работы может быть также сделано
- 45. 3)Жидкое мылоПо консистенции является вязкой жидкостью. По
- 46. ДозаторыДозатор позволяет использовать различные виды жидкого мыла.
- 47. дозатор
Слайд 2Сложные эфиры (1)
Сложными эфирами называют производные карбоновых кислот, в которых атом
Слайд 3Общая формула сложных эфиров такая же, как и у карбоновых кислот:CnH2nO2
Cложные
Слайд 4Номенклатура сложных эфиров Сложные эфиры в большинстве своем называют по тем кислотам
Слайд 5Изомерия сложных эфиров
Изомерия сложных эфиров определяется изомерией радикалов кислот и
Сложные эфиры являются межклассовыми изомерами с карбоновыми кислотами, имея одинаковую общую формулу.
Слайд 6Физические свойства сложных эфиров
Сложные эфиры простейших и средних представителей кислот и
Слайд 7Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие
В ИК-спектрах сложных эфиров присутствуют характеристические полосы карбоксильной группы — валентных колебаний связей C=O на 1750—1700 см−1 и С—О на 1275—1050 см−1.
Слайд 8Такие реакции с кислородными нуклеофилами (водой и спиртами) зачастую катализируются кислотами
RCOOR1 + H+ \to RC+OHOR1,
который далее реагирует с водой (гидролиз) или спиртом (переэтерификация). Гидролиз сложных эфиров в условиях кислотного катализа является обратимым, гидролиз же в щелочной среде необратим из-за образования карбоксилат-ионов RCOO−, не проявляющих электрофильных свойств.
Низшие сложные эфиры реагируют с аммиаком, образуя амиды, уже при комнатной температуре: так, например, этилхлорацетат реагирует с водным аммиаком, образуя хлорацетамид уже при 0 °C[2], в случае высших сложных эфиров аммонолиз идет при более высоких температурах.
Слайд 10Этилацетат – жидкость с приятным запахом, легко испаряется, плохо растворяется в
Слайд 12Этерификация
— взаимодействие кислот и спиртов в условиях кислотного катализа, например получение
Частным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами: R'COOR'' + R'''OH = R'COOR''' + R''OHR'COOR'' + R'''COOH = R'''COOR'' + R'COOHR'COOR'' + R'''COOR'''' = R'COOR'''' + R'''COOR'‘ .
Реакции этерификации и переэтерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды; в последнем случае при относительно низких температурах кипения исходных веществ используется отгонка воды в составе азеотропных смесей).
Слайд 13взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата
взаимодействие солей кислот с алкилгалогенидами RCOOMe + R'Hal = RCOOR' + MeHal
Присоединение карбоновых кислот к алкенам в условиях кислотного катализа (в том числе и кислотами Льюиса): RCOOH + R'CH=CHR'' = RCOOCHR'CH2R''
Слайд 14Алкоголиз нитрилов в присутствии кислот: RCN + H+ RC+=NHRC+=NH + R’OH
Алкилирование карбоновых кислот арилиакилтриазенами: ArN=NNHR + R1COOH R1COOR+ ArNH2 + N2
Слайд 15Применение
Эфиры муравьиной кислоты:
HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и
HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины.
HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
HCOOCH2C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.
HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
Слайд 16Эфиры уксусной кислоты:
CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен
CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат), используется как компонент грушевой и банановой эссенций.
CH3COOC8H17 — н-октилацетат имеет запах апельсинов.
Слайд 17Эфиры масляной кислоты:
C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
C3H7COOC2H5 —
C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C;
C3H7COOC5H11 — н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
Эфиры изовалериановой кислоты:
(CH3)2CHCH2COOCH2CH2CH(CH3)2 — изоамилизовалерат (изопентилизовалерат) имеет запах яблока.
Слайд 18Применение в медицине
В конце XIX — начале XX века, когда органический синтез
Слайд 20Жиры́, или триглицери́ды — природные органические соединения, полные сложных эфиров глицерина и
В живых организмах выполняют, прежде всего, структурную и энергетическую функции: они являются основным компонентом клеточной мембраны, а в жировых клетках сохраняется энергетический запас организма.
Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жидкие жиры растительного происхождения обычно называют маслами — так же, как и сливочное масло.
Слайд 22Состав жиров
Состав жиров определили французские ученые М. Шеврель и М. Бертло.
R¹, R² и R³ — радикалы (одинаковых или различных) жирных кислот.
Слайд 23Природные жиры содержат в своём составе три кислотных радикала, имеющих неразветвлённую
Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях и частично растворимы в этаноле (5—10 %).
Слайд 24Природные жиры чаще всего содержат следующие жирные кислоты:
Насыщенные:
Алкановые кислоты:
стеариновая (C17H35COOH)
маргариновая (C16H33COOH)
пальмитиновая
капроновая (C5H11COOH)
масляная (C3H7COOH)
Слайд 25Ненасыщенные:
1)Алкеновые кислоты:
пальмитолеиновая (C15H29COOH, 1 двойная связь)
олеиновая (C17H33COOH, 1 двойная связь)
2)Алкадиеновые кислоты:
линолевая
3)Алкадиеновые кислоты:
линоленовая (C17H29COOH, 3 двойные связи)
арахидоновая (C19H31COOH, 4 двойные связи, реже встречается)
В состав некоторых входят остатки и насыщенных, и ненасыщенных карбоновых кислот.
Слайд 26Животные жиры
Чаще всего в животных жирах встречаются стеариновая и пальмитиновая кислоты,
Слайд 27Растительные масла
В растениях жиры содержатся в сравнительно небольших количествах, за исключением
Слайд 28Свойства жиров
Энергетическая ценность жира приблизительно равна 9,3 ккал на грамм, что
При сильном взбалтывании с водой жидкие (или расплавленные) жиры образуют более или менее устойчивые эмульсии (см. гомогенизация). Природной эмульсией жира в воде является молоко.
Слайд 30Физические свойства
Жиры — вязкие жидкости или твёрдые вещества, легче воды. Их плотность
Слайд 31Номенклатура жиров
Номенклатура жиров довольно сложная. По систематической номенклатуре их называют триацилглицеринами.
В номенклатуре жиров также используются более простые тривиальные названия.
Слайд 33Гидролиз жиров
Гидролиз для жиров характерен, так как они являются сложными эфирами.
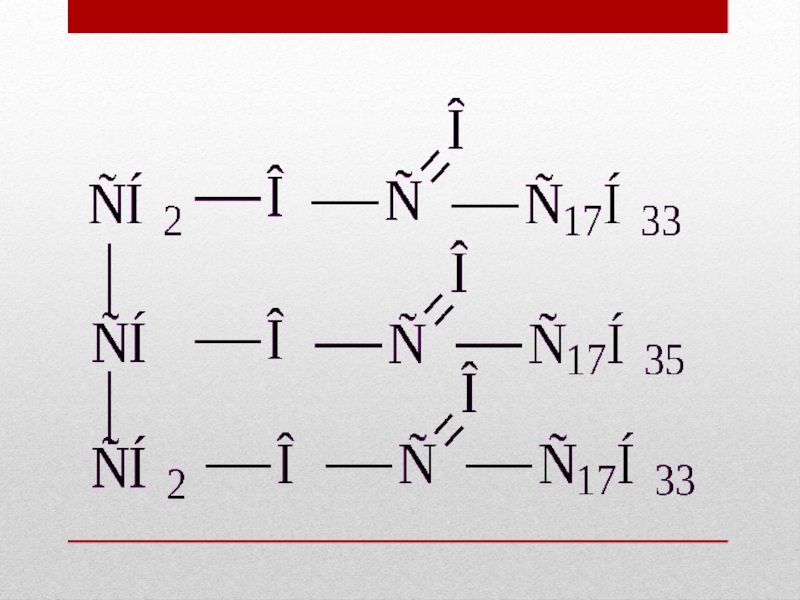
Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омыление жиров. С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло)
Слайд 34Гидрирование жиров
В составе растительных масел содержатся остатки ненасыщенных карбоновых кислот, поэтому
Слайд 35Пищевые свойства жиров
Жиры являются одним из основных источников энергии для млекопитающих.
Насыщенные жиры расщепляются в организме на 25—30 %, а ненасыщенные жиры расщепляются полностью.
Благодаря крайне низкой теплопроводности жир, откладываемый в подкожной жировой клетчатке, служит термоизолятором, предохраняющим организм от потери тепла (у китов, тюленей и др.).
Слайд 36Применение жиров
Пищевая промышленность (в частности, кондитерская).
Фармацевтика
Производство мыла и
Производство смазочных материалов
Слайд 38— жидкий или твёрдый продукт, содержащий поверхностно-активные вещества, в соединении с
Мыла, соли высших жирных (С8-С18), нафтеновых и смоляных кислот; одни из основных моющих средств. Технические смеси водорастворимых (калиевых, натриевых, аммониевых и три-этаноламмониевых) солей этих кислот называют щелочными мылами, водонерастворимые соли, содержащие металлы II, III и других групп (например, Са, Mg, Ni, Mn, Al, Co, Pb и других) - металлическими.
Щелочные мыла получают главным образом из стеариновой, пальмитиновой, лауриновой, олеиновой, нафтеновых кислот, канифоли и таллового масла.
Слайд 39Состав
В химическом отношении основным компонентом твёрдого мыла является смесь растворимых солей
Один из вариантов химического состава твёрдого мыла — C17H35COONa (жидкого — C17H35COOK).
Дополнительно в составе мыла могут быть и другие вещества, обладающие моющим действием, а также ароматизаторы, красители и порошки.
Слайд 40С увеличением молярной массы растворимость мыла в воде уменьшается. Растворимость высокомолекулярных
Слайд 42Виды мыла
1)Хозяйственное мыло
При охлаждении клеевого мыла получается хозяйственное мыло. Твёрдое мыло
Слайд 432)Мыло ручной работы
Мыло возможно производить вручную несколькими способами. При этом в
Один из способов — перетирание и расплавление уже готового мыла (например, детского). Кусок мыла измельчают на тёрке или ножом, разбавляют водой или иной желаемой жидкостью (например, отвары трав), затем вся масса растапливается на водяной бане. Когда масса становится однородной, её снимают с огня и добавляют эфирные масла и другие ингредиенты по желанию. Трудность этого способа состоит в том, что готовое мыло, используемое мыловаром, довольно тугоплавко и процесс его переваривания долгий. Этот способ используется новичками в мыловарении, поскольку не требует значительных финансовых затрат.
Слайд 44Мыло ручной работы может быть также сделано из специальной мыльной основы,
Мыло, произведённое из непосредственно щёлочи и жиров вручную, требует от мыловара соблюдения техники безопасности при работе с щёлочью. С другой стороны, полный контроль за процессом создания мыла позволяет мыловару создать именно тот продукт, который ему нужен.