- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Скорость химических реакций
Содержание
- 1. Презентация по химии на тему: Скорость химических реакций
- 2. Цель: выясним, что есть скорость химической реакции,
- 3. Что такое химическая реакция?Что такое гомогенная и
- 4. Элементарный акт химической реакцииЭто активное столкновение молекул,
- 5. При протекании химических реакций происходит изменение концентраций
- 6. Скорость реакции определяется изменением количества вещества в единицу времени.
- 7. Анализ таблицы, выводы:по приведённым формулам можно рассчитать
- 8. Задача на применение знаний по «Скорости химических
- 9. Самопроверка
- 10. Факторы, влияющие на скорость реакцииПрирода реагирующих веществПлощадь поверхности твердого веществаКонцентрация реагирующих веществТемператураКатализатор
- 11. 1. Природа реагирующих веществ.Под природой реагирующих веществ
- 12. Природа реагирующих веществ (Попробуй сам)Налейте в пробирку
- 13. Площадь поверхности твердого вещества (попробуй сам) Налейте
- 14. 2.Поверхность соприкосновения реагирующих веществ.Скорость реакции увеличивается благодаря:
- 15. Концентрация реагирующих веществ. (подумай сам)в две пробирки
- 16. На основе большого экспериментального материала в 1867
- 17. Закон действующих массМатематически зависимость скорости от концентрации
- 18. Думай самостоятельноНапиши выражение закона действующих масс для
- 19. Догадался… Молодец!Для реакции: 2Н2 + О2 =
- 20. Константа скорости k численно равна скорости, если
- 21. Задачи1. 2 л раствора вещества А (концентрация
- 22. Влияние температуры на скорость реакцииВ 2 пробирки
- 23. Правило Вант - ГоффаПри увеличении температура на
- 24. Математическое выражение правила Вант- Гоффа
- 25. Энергия активации Рассмотрим реакцию, которая происходит
- 26. Энергия активацииМерой "энергичности" молекул может служить, например,
- 27. Начальное и конечное состояние вещества в химической
- 28. Энергия активации и скорость реакцииДо сих пор
- 29. Почему все возможные реакции ещё не произошли?Итак,
- 30. Катализ (попробуй сам)Налейте в пробирку небольшое количество
- 31. Вещества, принимающие участие, но не расходующиеся в
- 32. Проверь себяА1. Катализатор повышает скорость реакции, так
- 33. Проверь себяБ1. Скорость синтеза аммиака при повышении
- 34. Выводы по теме урокаХимические реакции протекают с
- 35. Выводы по теме урокаВеличина энергии активации веществ
Слайд 1
Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Подготовила
Учитель химии
МБОУ
Батынкова Г.А.
Слайд 2
Цель: выясним, что есть скорость химической реакции, и от каких факторов
В ходе урока познакомимся с теорией вопроса по вышеназванной теме. На практике подтвердим некоторые наши теоретические предположения.
Слайд 3
Что такое химическая реакция?
Что такое гомогенная и гетерогенная реакция?
Что происходит с
Какими энергетическими процессами сопровождается химическая реакция?
Вспомни
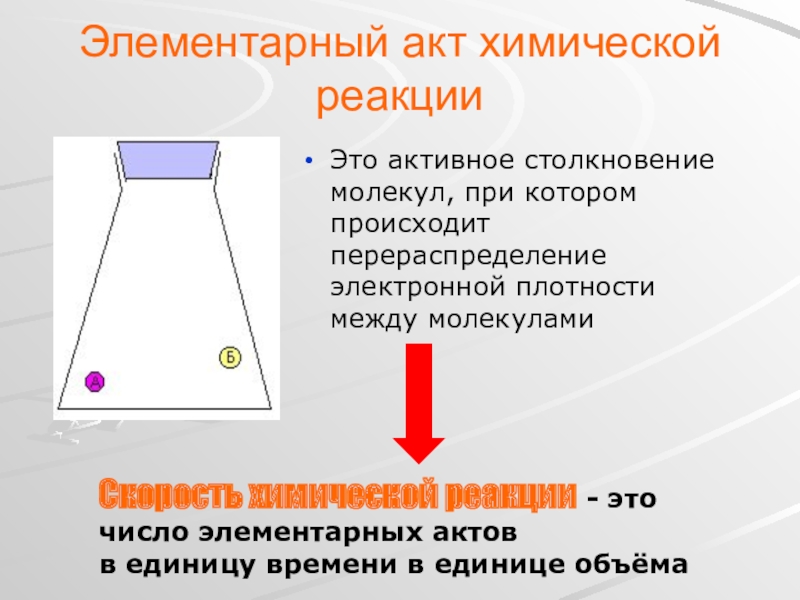
Слайд 4Элементарный акт химической реакции
Это активное столкновение молекул, при котором происходит перераспределение
Скорость химической реакции - это число элементарных актов
в единицу времени в единице объёма
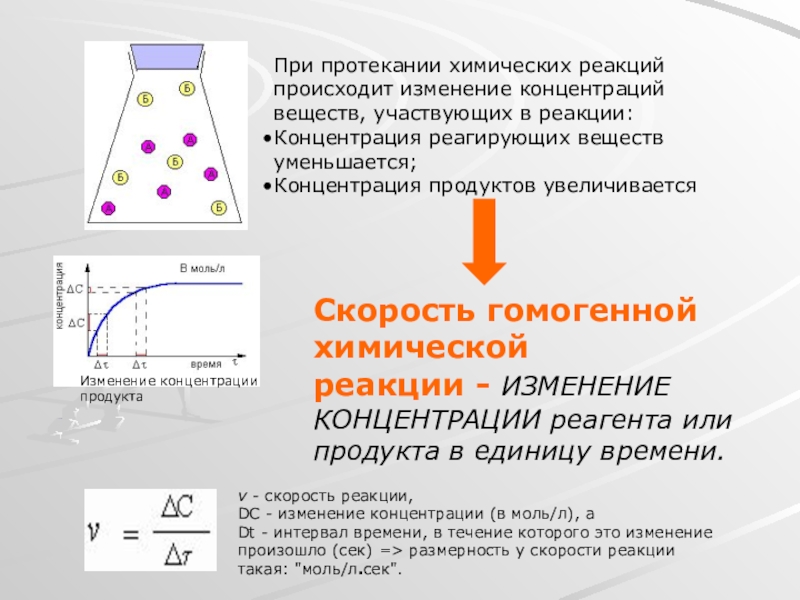
Слайд 5При протекании химических реакций происходит изменение концентраций веществ, участвующих в реакции:
Концентрация
Концентрация продуктов увеличивается
Изменение концентрации
продукта
Скорость гомогенной химической
реакции - ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
v - скорость реакции,
DC - изменение концентрации (в моль/л), а
Dt - интервал времени, в течение которого это изменение произошло (сек) => размерность у скорости реакции такая: "моль/л.сек".
Слайд 7Анализ таблицы, выводы:
по приведённым формулам можно рассчитать лишь некоторую среднюю скорость
рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества.
Например, для реакции 2Н2 +О2 = 2Н2О:
v (по Н2) = 2v (по О2) = v (по Н2О)
Слайд 8Задача на применение знаний по «Скорости химических реакций»
Химическая реакция протекает в
б) концентрацию вещества В через 20 мин.
Слайд 10Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Площадь поверхности твердого вещества
Концентрация реагирующих
Температура
Катализатор
Слайд 111. Природа реагирующих веществ.
Под природой реагирующих веществ понимают их состав, строение,
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Слайд 12Природа реагирующих веществ
(Попробуй сам)
Налейте в пробирку соляную кислоту и добавьте несколько
во вторую пробирку с гранулами цинка прилейте уксусную кислоту.
Напиши уравнения химических реакций.
В какой пробирке реакция протекала быстрее? Почему?
Слайд 13Площадь поверхности твердого вещества
(попробуй сам)
Налейте в 2 пробирки соляную кислоту
В одну
Растолките кусочек мела и высыпьте в вторую пробирку
Напишите уравнение реакции
Как зависит скорость реакции от площади поверхности твердого вещества?
Каким образом вы увеличили площадь поверхности твердого вещества?
Слайд 142.Поверхность соприкосновения реагирующих веществ.
Скорость реакции увеличивается благодаря:
-увеличению площади поверхности соприкосновения
-повышению реакционной способности частиц на поверхности образующихся при измельчении микрокристаллов;
-непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция.
Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество, жидкость - другая жидкость, твердое вещество - другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций.
Слайд 15Концентрация реагирующих веществ.
(подумай сам)
в две пробирки налейте соляную кислоту:
В 1-ую –
Во 2-ую – добавьте гранулы цинка без добавления воды.
Как влияет концентрация кислоты на скорость реакции?
Как влияет
концентрация
реагирующих веществ
на скорость
химической реакции?
Почему?
Слайд 16На основе большого экспериментального материала в 1867 г. норвежские учёные К.
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют
законом действующих масс.
3. Концентрации реагирующих веществ.
Слайд 17Закон действующих масс
Математически зависимость скорости от концентрации для реакции: А +
выражается следующим образом:
v = k[А][Б], где
V – скорость реакции;
K – константа скорости;
[А] и [Б] – концентрации веществ А и Б соответственно
Слайд 18Думай самостоятельно
Напиши выражение закона действующих масс для реакции:
(подсказка: представь реакцию в следующем виде Н2 + Н2 + О2 = 2Н2О)
Напиши выражение закона действующих масс для реакции:
аА + bВ = С
Слайд 19Догадался… Молодец!
Для реакции: 2Н2 + О2 = 2Н2О
Для реакции: аА + bВ = С
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Если реакция гетерогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Слайд 20
Константа скорости k численно равна скорости, если концентрации реагентов постоянны и
Константа скорости k дает химикам возможность КОЛИЧЕСТВЕННО обсуждать вопросы, связанные с изучением скоростей реакций. Приведем пример.
Измеренные константы скоростей приведенных реакций позволяют уже не просто говорить о том, что реакция нейтрализации (H+ + OH-) протекает намного быстрее реакции разложения иона аммония. Можно рассуждать количественно: при 20оС реакция нейтрализации протекает в 6*109 раз быстрее, чем реакция распада иона аммония на аммиак и ион водорода.
Константа скорости
Слайд 21Задачи
1. 2 л раствора вещества А (концентрация 0,6 моль/л) смешали для
2. Оксид азота (II) NO окисляется кислородом О2 с образованием оксида азота (IV) NO2 (в газовой фазе). Кинетическое уравнение этой реакции соответствует полному химическому уравнению. Как изменится скорость реакции, если давление увеличить в два раза?
3. Реакция А + Б = В является бимолекулярной. Начальные концентрации веществ таковы: [А]н = 2,5 моль/л, [Б]н = 1,5 моль/л. Константа скорости реакции k = 0,8 л/моль.сек. Вычислите концентрацию вещества [А] и скорость реакции к моменту, когда концентрация вещества [Б] составит 0,5 моль/л.
Слайд 22Влияние температуры на скорость реакции
В 2 пробирки налейте cоляной кислоты и
Одну пробирку нагрейте.
Вопрос. В какой из пробирок реакция пойдет быстрее? Почему? Как влияет температура на скорость реакции?
Слайд 23Правило Вант - Гоффа
При увеличении температура на каждые 100 скорость реакции
Подумай! Если температуру увеличить на 300 (Υ= 2), во сколько раз увеличится скорость реакции?
Слайд 24Математическое выражение правила Вант- Гоффа
V2/ V1 = ΥΔt/10
Задача.
Определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10° до 50° С;
б) при понижении температуры от 10° – 0° С. Температурный коэффициент реакции равен 3.
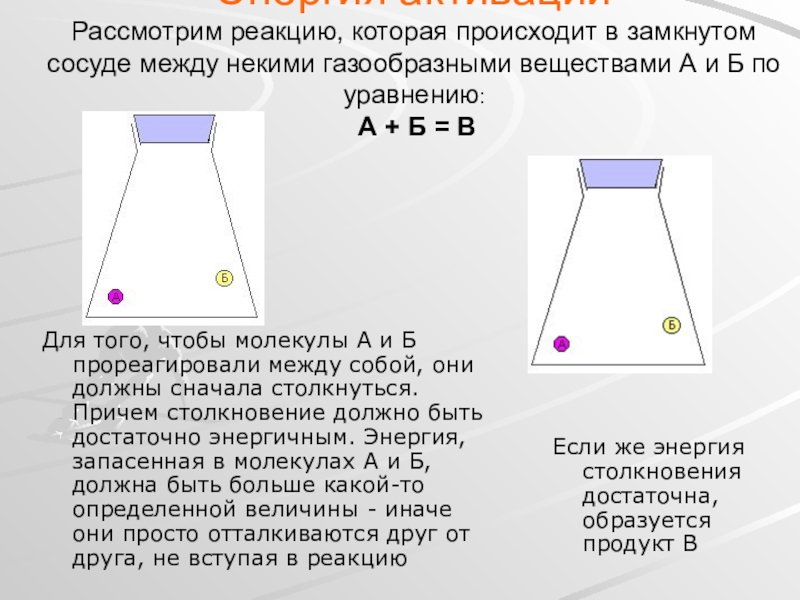
Слайд 25Энергия активации Рассмотрим реакцию, которая происходит в замкнутом сосуде между некими
Для того, чтобы молекулы А и Б прореагировали между собой, они должны сначала столкнуться. Причем столкновение должно быть достаточно энергичным. Энергия, запасенная в молекулах А и Б, должна быть больше какой-то определенной величины - иначе они просто отталкиваются друг от друга, не вступая в реакцию
Если же энергия столкновения достаточна, образуется продукт В
Слайд 26Энергия активации
Мерой "энергичности" молекул может служить, например, скорость их движения, которая
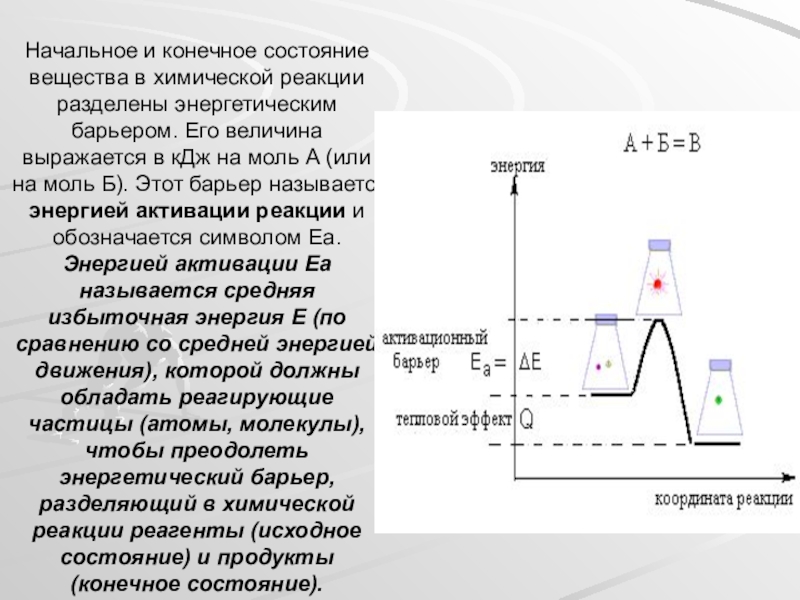
Слайд 27Начальное и конечное состояние вещества в химической реакции разделены энергетическим барьером.
Слайд 28Энергия активации и скорость реакции
До сих пор мы сравнивали ОДНУ И
Для каждой химической реакции характерно свое собственное значение Еа (не зависящее от температуры). В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Чем НИЖЕ активационный барьер Еа какой-либо химической реакции, тем БЫСТРЕЕ она идет в данных условиях, потому что большее число молекул А и Б способны преодолевать барьер в единицу времени.
Если в другой химической реакции активационный барьер ВЫШЕ, то такая реакция в тех же условиях идет МЕДЛЕННЕЕ. Если барьер очень высок, в системе вообще нет молекул, способных преодолеть активационный барьер и реакция не происходит.
Подумай! Какие реакции протекают мгновенно, так как их энергия активации равна нулю?
Слайд 29Почему все возможные реакции ещё не произошли?
Итак, мы видим, что для
Например, если бы не было активационного барьера, реакция горения метана в кислороде начиналась бы сразу после соприкосновения метана с воздухом. В этом случае не только природный газ (в нем 95% метана), но и нефть, бензин, уголь, бумагу, одежду, мебель, деревянные постройки и все, что в принципе может гореть, пришлось бы тщательно изолировать от воздуха. К счастью, на пути самопроизвольного протекания этих экзотермических реакций стоит активационный барьер Еа.
Когда мы подносим горящую спичку к открытой конфорке газовой плиты, мы заставляем какую-то часть молекул метана и кислорода "перескочить" активационный барьер, не преодолимый при комнатной температуре. В дальнейшем энергия активации для взаимодействия все новых и новых молекул метана и кислорода черпается уже из тепла самой экзотермической реакции.
Слайд 30Катализ
(попробуй сам)
Налейте в пробирку небольшое количество перекиси водорода и добавьте оксида
Оксид марганца является катализатором реакции разложения перекиси водорода.
Подумай! 1.Почему стало возможно протекание данной реакции при комнатной температуре?
2. Почему тлеющая лучинка вспыхнула в пробирке? Что повлияло на скорость реакции горения?
Слайд 31Вещества, принимающие участие, но не расходующиеся в процессе реакции, называются катализаторами.
Медленно протекающая реакция A + B → А…B → AB в присутствии катализатора идет с большей скоростью в две стадии:
А + К = АК;
АК + Б = АБ + К
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Механизм каталитического действия для них не одинаков, однако и в том и в другом случае происходит ускорение реакции за счет снижения энергии активации.
Слайд 32Проверь себя
А1. Катализатор повышает скорость реакции, так как:
А) увеличивает число столкновений
Б) увеличивает скорость движения молекул;
В) увеличивает энергию активации реакции;
Г) уменьшает энергию активации реакции.
А2. Для какой реакции кинетическое уравнение имеет вид: V=k[О2]
А) S + O2 = SO2 Б) 2Н2 + О2 = 2Н2О
В) N2 + O2 = 2NO Г) 2СО + О2 = 2СО2
А3. Константа скорости химической реакции зависит от:
А) температуры и концентрации реагирующих веществ;
Б) концентрации и природы реагирующих веществ;
В) концентрации и площади соприкосновения реагирующих веществ;
Г) температуры и природы реагирующих веществ.
Слайд 33Проверь себя
Б1. Скорость синтеза аммиака при повышении концентраций азота и водорода
Б2. Для того, чтобы скорость реакции 2NO + O2 = 2NO2 возросла в 1000 раз, давление в системе нужно увеличить в … раз. (Ответ запишите цифрами).
Б3. При повышении температуры на 600 скорость химической реакции увеличилась в 64 раза. Следовательно, температурный коэффициент этой реакции равен … (Ответ запишите цифрами).
Б4. Две реакции протекают при 200 с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, а второй – 4. Отношение скоростей этих реакций при 700 равно…(Ответ запишите цифрами).
Слайд 34Выводы по теме урока
Химические реакции протекают с различными скоростями. Величина скорости
На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа.
Скорость реакции зависит от факторов:
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
- действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 35Выводы по теме урока
Величина энергии активации веществ – это фактор, посредством
При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза.
Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.
















![Презентация по химии на тему: Скорость химических реакций Догадался… Молодец!Для реакции: 2Н2 + О2 = 2Н2О Догадался… Молодец!Для реакции: 2Н2 + О2 = 2Н2О V = k[Н2]2[О2]Для](/img/thumbs/87fdfc8a49dd0232ef2428a492f44098-800x.jpg)