- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Углерод С - первый элемент главной подгруппы IV группы Периодической системы.
Содержание
- 1. Углерод С - первый элемент главной подгруппы IV группы Периодической системы.
- 2. Степень окисленияАтомы углерода содержат на внешнем энергетическом
- 3. Углерод - простое веществоУглерод образует аллотропные модификации - алмаз и графит.
- 4. АлмазАлмаз - прозрачное кристаллическое вещество, самое твёрдое
- 5. Алмазы Алмазы – это не только камни
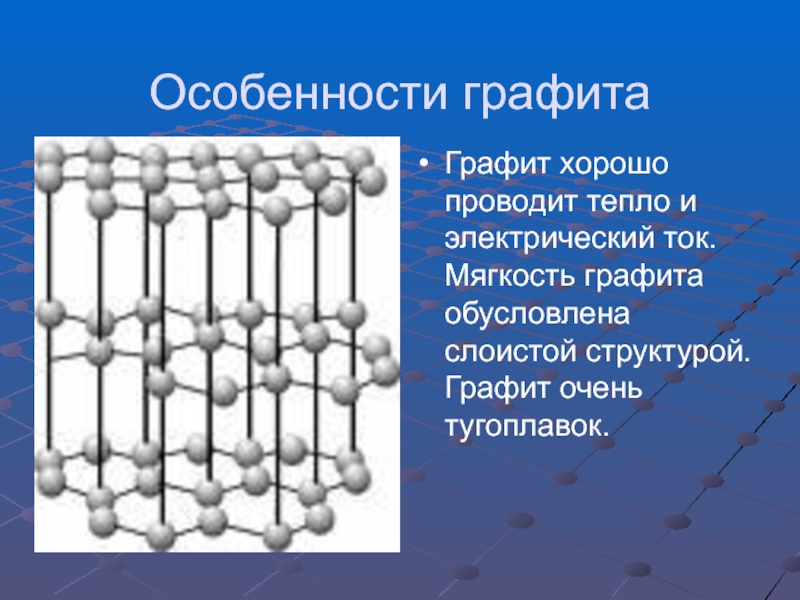
- 6. ГрафитГрафит – тёмно-серое, жирное на ощупь кристаллическое
- 7. Особенности графитаГрафит хорошо проводит тепло и электрический ток. Мягкость графита обусловлена слоистой структурой. Графит очень тугоплавок.
- 8. Применение графитаИз графита изготовляют электроды, твёрдые смазки, стержни для карандашей.
- 9. Древесный угольЕго получают при сухой перегонке древесины.
- 10. Активированный угольЧтобы увеличить поглотительную способность, древесный уголь
- 11. Применение углерода
- 12. Спирт, черная краска
- 13. Углекислый газАлмаз и графит соединяются с кислородом
- 14. Углерод + металлС металлами углерод при нагреваний
- 15. МетанЕсли водой подействовать на карбид алюминия, то
- 16. Оксид меди (II) + древесный угольМетан можно
- 17. Оксид углерода (II)СО – бесцветный, не имеющий
- 18. Отравление угарным газом
- 19. Оксид углерода (II) - СООксид СО относят
- 20. Выплавка чугунаОксид углерода (II) способен отнимать кислород
- 21. Оксид углерода (IV) СО2Другое название - углекислый
- 22. Сухой лёд
- 23. Оксид углерода (IV) СО2СО2- это типичный кислотный
- 24. Сажа
- 25. Получение углекислого газаУглекислый газ получают, действуя на
- 26. Применение углекислого газаУглекислый газ используют также для изготовления шипучих напитков и для получения соды.
- 27. Образование сталактитов При избытке углекислого газа в
- 28. Накипь на элементах питания
- 29. Список источников:О.С. Габриелян «Химия» 9кл.www.google.ruwww.ya.ru
- 30. Презентацию выполнила:Пушкарева Анжелла 81 класс
Степень окисленияАтомы углерода содержат на внешнем энергетическом уровне 4 электрона, поэтому они могут принимать 4 электрона, приобретая степень окисления - 4, также проявлять восстановительные св-ва, приобретая степень окисления +4.
Слайд 2Степень окисления
Атомы углерода содержат на внешнем энергетическом уровне 4 электрона, поэтому
они могут принимать 4 электрона, приобретая степень окисления - 4, также проявлять восстановительные св-ва, приобретая степень окисления +4.
Слайд 4Алмаз
Алмаз - прозрачное кристаллическое вещество, самое твёрдое из всех природных веществ.
Такая твёрдость алмаза обусловлена особой структурой его атомной кристаллической решетки.
Слайд 5Алмазы
Алмазы – это не только камни ювелиров. Благодаря высокой твёрдости алмазов
они применяются для изготовления буров, свёрл, шлифовальных инструментов, резки стекла.
Слайд 6Графит
Графит – тёмно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском.
Графит очень мягкий и оставляет след на бумаге.
Слайд 7Особенности графита
Графит хорошо проводит тепло и электрический ток. Мягкость графита обусловлена
слоистой структурой. Графит очень тугоплавок.
Слайд 9Древесный уголь
Его получают при сухой перегонке древесины. Благодаря своей пористой поверхности
обладает замечательной способностью поглощать газы и растворённые вещества. Это свойство называется АДСОРБЦИЕЙ.
Слайд 10Активированный уголь
Чтобы увеличить поглотительную способность, древесный уголь обрабатывают горячим водяным паром.
Такой уголь наз-ся АКТИВИРОВАННЫЙ или АКТИВНЫЙ.
Если бросить кусочки этого угля в колбу с бурым газом NO2 , то бурая окраска в колбе исчезнет.
Если бросить кусочки этого угля в колбу с бурым газом NO2 , то бурая окраска в колбе исчезнет.
Слайд 13Углекислый газ
Алмаз и графит соединяются с кислородом при очень высокой температуре.
Результата взаимодействия таков - образуется углекислый газ.
Слайд 14Углерод + металл
С металлами углерод при нагреваний образует карбиды.
4Al + 3C = Al4C3
Карбид алюминия – светло-желтые прозрачные кристаллы.
Карбид алюминия – светло-желтые прозрачные кристаллы.
Слайд 15Метан
Если водой подействовать на карбид алюминия, то получится газ – метан
CH4 :
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Слайд 16Оксид меди (II) + древесный уголь
Метан можно получить также синтезом из
углерода и водорода при нагревании.
Если в пробирке прокалить смесь черного порошка оксид меди (II) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди:
C + 2CuO = 2Cu + CO2↑
Если в пробирке прокалить смесь черного порошка оксид меди (II) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди:
C + 2CuO = 2Cu + CO2↑
Слайд 17Оксид углерода (II)
СО – бесцветный, не имеющий запаха газ, малорастворимый в
воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя карбоксигемоглобин, лишая тем самым возможности гемоглобин переносить кислород.
Слайд 19Оксид углерода (II) - СО
Оксид СО относят к несолеобразующим оксидам, так
как, будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами, однако этого не наблюдается. СО- хороший восстановитель. Он сгорает в кислороде, образуя углекислый газ:
2СО + О2 = 2СО2
2СО + О2 = 2СО2
Слайд 20Выплавка чугуна
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т.
е. восстанавливать металлы из их оксидов:
Fe2O3 + 3CO=2Fe + 3CO2↑
Именно это свойство оксида углерода (II) используется в металлургии при выплавке чугуна.
Fe2O3 + 3CO=2Fe + 3CO2↑
Именно это свойство оксида углерода (II) используется в металлургии при выплавке чугуна.
Слайд 21Оксид углерода (IV) СО2
Другое название - углекислый газ – бесцветный не
имеющий запаха газ. Он в 1,5 тяжелее воздуха. При давлении 60атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твёрдую снегообразную массу, которую в промышленности прессуют, получая сухой лёд.
Слайд 23Оксид углерода (IV) СО2
СО2- это типичный кислотный оксид: взаимодействует со щелочами,
с основными оксидами и водой. Он не горит и поэтому применяется при тушении пожаров, но магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
СО2 + 2Mg = 2MgO + C
СО2 + 2Mg = 2MgO + C
Слайд 25Получение углекислого газа
Углекислый газ получают, действуя на соли угольной кислоты –
карбонаты растворами соляной, азотной или даже уксусной кислот.
В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты.
В промышленности большие количества углекислого газа получают обжигом известняка.
В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты.
В промышленности большие количества углекислого газа получают обжигом известняка.
Слайд 26Применение углекислого газа
Углекислый газ используют также для изготовления шипучих напитков и
для получения соды.
Слайд 27Образование сталактитов
При избытке углекислого газа в присутствии воды карбонаты могут
превращаться в гидрокарбонаты и образуется растворимый гидрокарбонат кальция. Именно наличием этой соли и объясняется временная жесткость воды – эта реакция приводит к образовании накипи, а в природе, в пещерах формируются сталактиты.