- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Скорость химических реакций и факторы влияния на неё
Содержание
- 1. Презентация по химии на тему Скорость химических реакций и факторы влияния на неё
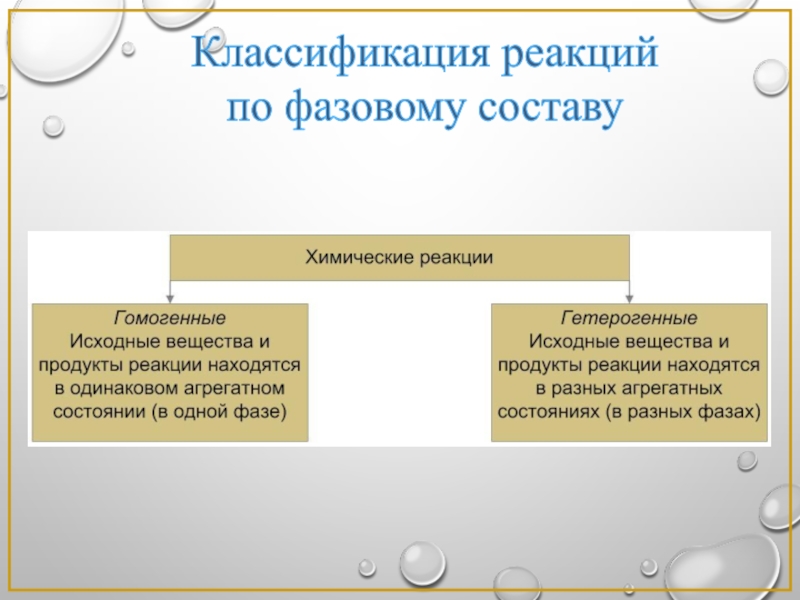
- 2. Классификация реакций по фазовому составу
- 3. Средняя скорость гомогенной реакции- определяется изменением количества
- 4. Средняя скорость гетерогенной реакции- определяется изменением количества
- 5. Факторы, влияющие на скорость химической реакцииПрирода реагирующих
- 6. Природа реагирующих веществРеакционная активность веществ определяется:характером химических
- 7. КонцентрацияДля взаимодействия веществ их молекулы должны столкнуться.
- 8. Сванте Аррениус (1859-1927)Объяснение зависимости скорости реакции
- 9. Якоб Вант-Гофф (1852-1911)Температура повышает количество столкновений
- 10. КатализаторыЙенс Якоб Берцелиусввел термин «катализ»в 1835 г.
- 11. ДавлениеДавление сильно влияет на скорость реакций с
- 12. Площадь соприкосновенияСкорость гетерогенной реакции прямо пропорциональна площади
Слайд 1«Скорость химической реакции и факторы влияющие на нее»
Учитель химии и биологии
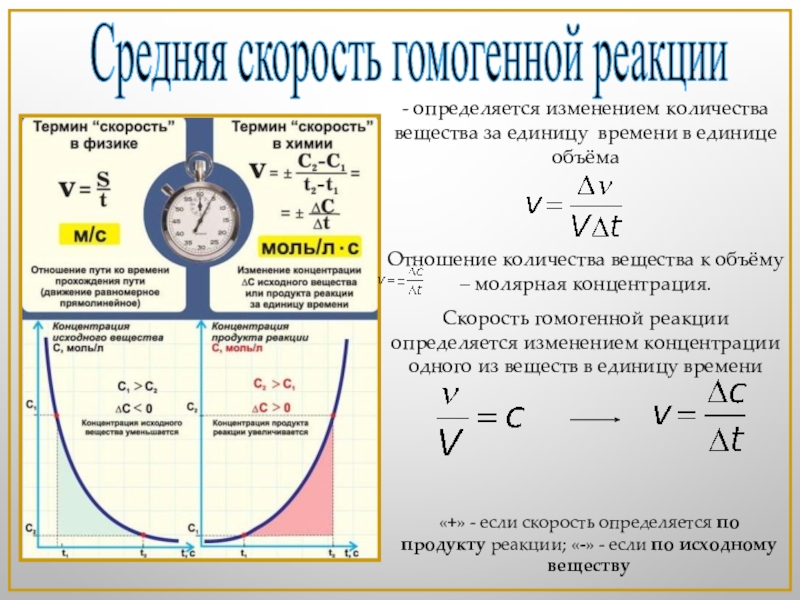
Слайд 3Средняя скорость гомогенной реакции
- определяется изменением количества вещества за единицу времени
Отношение количества вещества к объёму – молярная концентрация.
Скорость гомогенной реакции определяется изменением концентрации одного из веществ в единицу времени
«+» - если скорость определяется по продукту реакции; «-» - если по исходному веществу
Слайд 4Средняя скорость гетерогенной реакции
- определяется изменением количества вещества, вступившего в реакцию
Взаимодействие происходит только на поверхности раздела между веществами
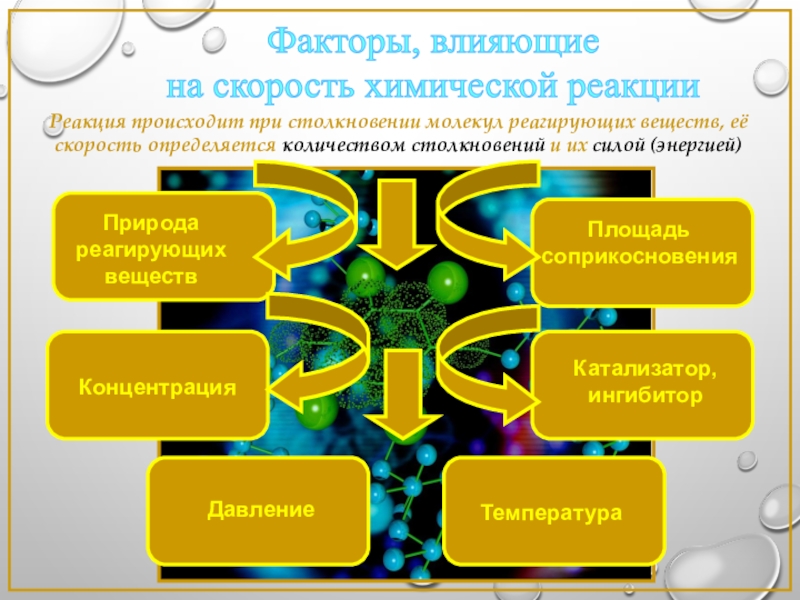
Слайд 5Факторы, влияющие
на скорость химической реакции
Природа реагирующих веществ
Концентрация
Температура
Катализатор, ингибитор
Площадь соприкосновения
Реакция происходит
Давление
Слайд 6Природа реагирующих веществ
Реакционная активность веществ определяется:
характером химических связей
скорость больше у
скорость меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества)
их строением
скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома)
скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
Слайд 7Концентрация
Для взаимодействия веществ их молекулы должны столкнуться. Число столкновений пропорционально числу
Закон действующих масс:
Скорость элементарной химической реакции пропорциональна произведению молярных концентраций реагирующих веществ, возведённых в степени равные их коэффициентам:
1867 г. К.Гульдберг и П.Вааге сформулировали закон действующих масс
Слайд 8Сванте Аррениус
(1859-1927)
Объяснение зависимости скорости реакции от температуры было дано
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц , зависящую от температуры.
молекула - энергетически выгодное образование
химические вещества на энергетической диаграмме занимают положение в "ямках"
для превращения этих веществ в другие, им надо сообщить энергию, достаточную для того, чтобы они выбрались из "ямки", перевалили через "барьер" (энергию активации)
Температура
Слайд 9Якоб Вант-Гофф
(1852-1911)
Температура повышает количество столкновений молекул.
В интервале температур от 0°С до 100°С при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
Правило Вант-Гоффа не имеет силу закона. Лабораторная техника была несовершенна, поэтому:
оказалось, что температурный коэффициент в значительном температурном интервале непостоянен
невозможно было изучать как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются тысячи лет)
реакции с участием больших молекул сложной формы (например, белков) не подчиняются правилу Вант-Гоффа
Слайд 10Катализаторы
Йенс Якоб Берцелиус
ввел термин «катализ»
в 1835 г.
Вильгельм Оствальд
1909 г. –
«в признание работ по катализу»
вещества, изменяющие скорость химической реакции за счёт изменения энергии активации, но сами при этом не расходующиеся. Процесс в присутствии катализатора – катализ. Реакция с катализатором – каталитическая.
Положительные катализаторы – ускоряют реакцию!
Отрицательные катализаторы (ингибиторы) – замедляют реакцию!
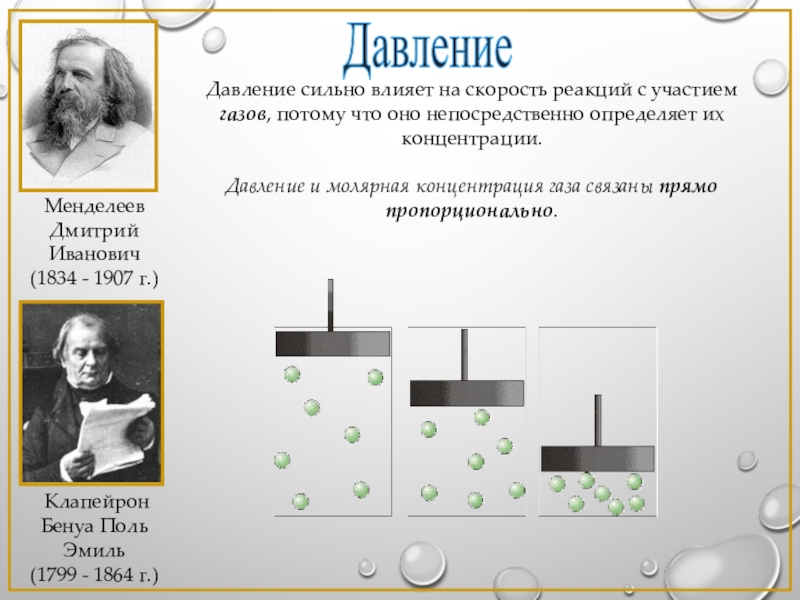
Слайд 11Давление
Давление сильно влияет на скорость реакций с участием газов, потому что
Давление и молярная концентрация газа связаны прямо пропорционально.
Клапейрон Бенуа Поль Эмиль
(1799 - 1864 г.)
Менделеев Дмитрий Иванович
(1834 - 1907 г.)
Слайд 12Площадь соприкосновения
Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов.
При
соприкосновения реагирующих веществ, при этом возрастает скорость реакции
Скорость гетерогенной реакции зависит от:
а) скорости подвода реагентов к границе раздела фаз;
б) скорости реакции на поверхности раздела фаз, которая зависит от площади этой поверхности;
в) скорости отвода продуктов реакции от границы раздела фаз.
Стадии (а) и (в) называются диффузионными, а стадия (б) – кинетической. Та стадия, которая протекает наиболее медленно, называется лимитирующей – именно она определяет скорость реакции в целом.