- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Скорость химической реакции
Содержание
- 1. Презентация по химии на тему Скорость химической реакции
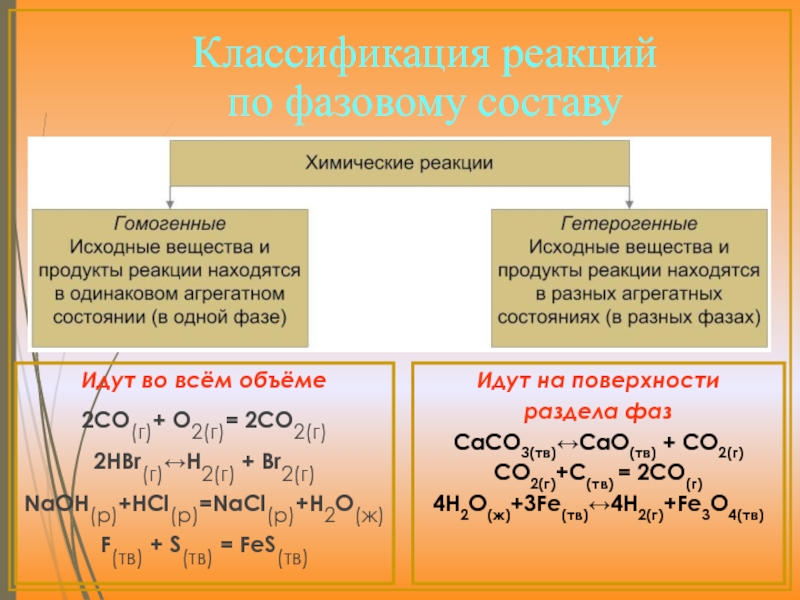
- 2. - это раздел химии, который изучает скорости
- 3. : коррозия, фотосинтез, биосинтез белка.704-7
- 4. (г)2(г)2(г)(г)2(г)2(г)(р)(р)(р)2(ж)(тв)(тв)(тв)3(тв)(тв)2(г)2(г)(тв) (г)2(ж)(тв)2(г)34(тв)
- 5. -определяется изменением количества вещества за единицу времени
- 6. -определяется изменением количества вещества, вступившего в реакцию
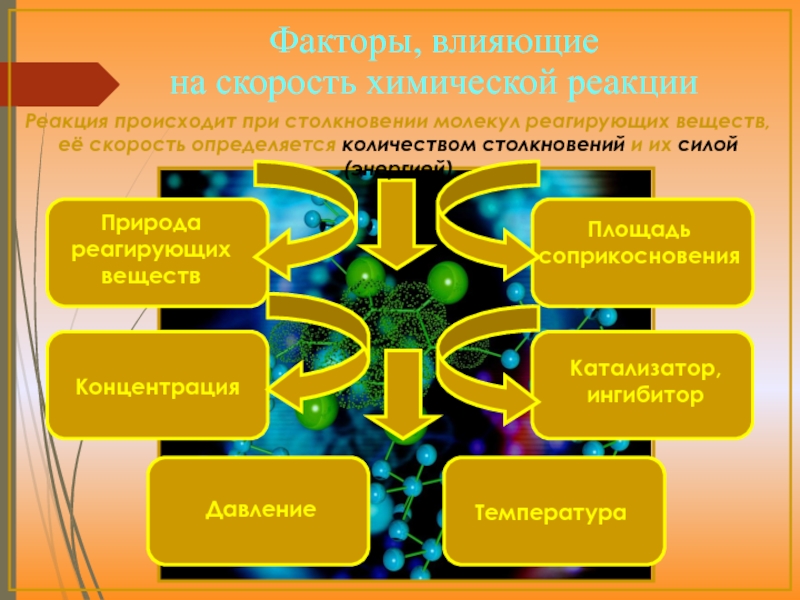
- 7. количеством столкновенийсилой (энергией)
- 8. Реакционная активность веществ определяется:характером химических связей -скорость
- 9. Закон действующих масс:Скорость элементарной химической реакции пропорциональна
- 10. Объяснение зависимости скорости реакции от температуры было
- 11. В газе при нормальных условиях каждая из
- 12. Температура повышает количество столкновений молекул.
- 13. катализ вещества, изменяющие скорость химической реакции за
- 14. 3H2 + N2 ↔ 2NH3FeAl2O3K2O2↔42NiCe
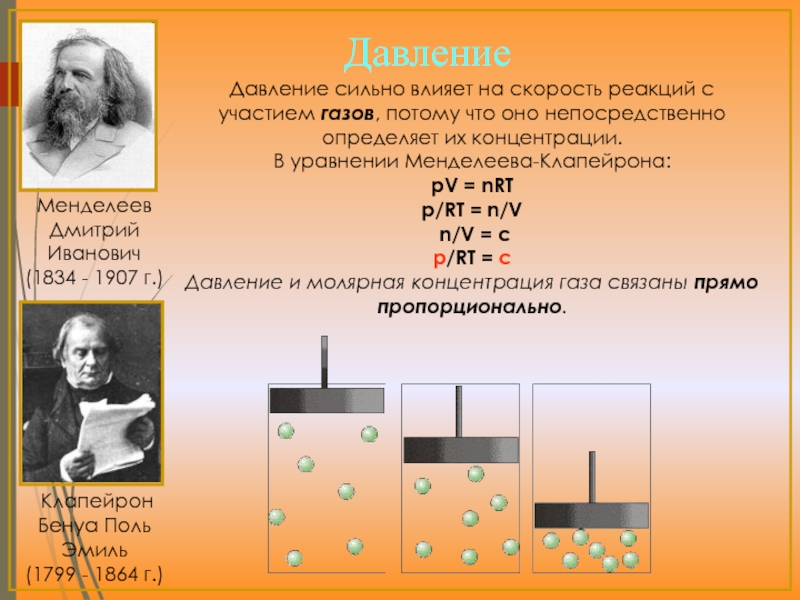
- 15. Давление сильно влияет на скорость реакций с
- 16. прямо пропорциональнаСкорость гетерогенной реакции зависит от: а)
- 17. 1. Вычислите среднюю скорость химической реакции, если
- 18. Дано:При уменьшенииобъёма смеси в 5раз концентрациякаждого веществавозрасла
- 19. Дано:c1 (А)= 1моль/лс1(В) = 2моль/лНайти: v1/v21) закон
- 20. 4. Как изменится скорость реакции 2Al +
- 21. 1) выражение зависимости скорости реакции от температуры:
- 22. 6. Реакция при 20°С протекает за 2
- 23. 7. Скорость реакции при охлаждении от 50°
Слайд 2
- это раздел химии, который изучает скорости химических реакций, их зависимость
Быстрые химические процессы: взрывы, ионные реакции в растворах, передача нервного импульса
Слайд 5
-определяется изменением количества вещества за единицу времени в единице объёма
Отношение количества
Скорость гомогенной реакции определяется изменением концентрации одного из веществ в единицу времени
«+» - если скорость определяется по продукту реакции;
«-» - если по исходному веществу
Слайд 6
-определяется изменением количества вещества, вступившего в реакцию или образовавшегося в результате
Взаимодействие происходит только на поверхности раздела между веществами
S – площадь поверхности
Слайд 8
Реакционная активность веществ определяется:
характером химических связей
-скорость больше у веществ с
-скорость меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества)
υ(Zn + HCl = H2 + ZnCl2) > υ(Zn + CH3COOH = H2 + Zn(CH3COO)2
их строением
-скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома)
-скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
υ(2K + 2H2O = H2 + 2KOH) > υ(2Na + 2H2O = H2 + 2NaOH)
Слайд 9
Закон действующих масс:
Скорость элементарной химической реакции пропорциональна произведению молярных концентраций реагирующих
закон действующих масс
Слайд 10
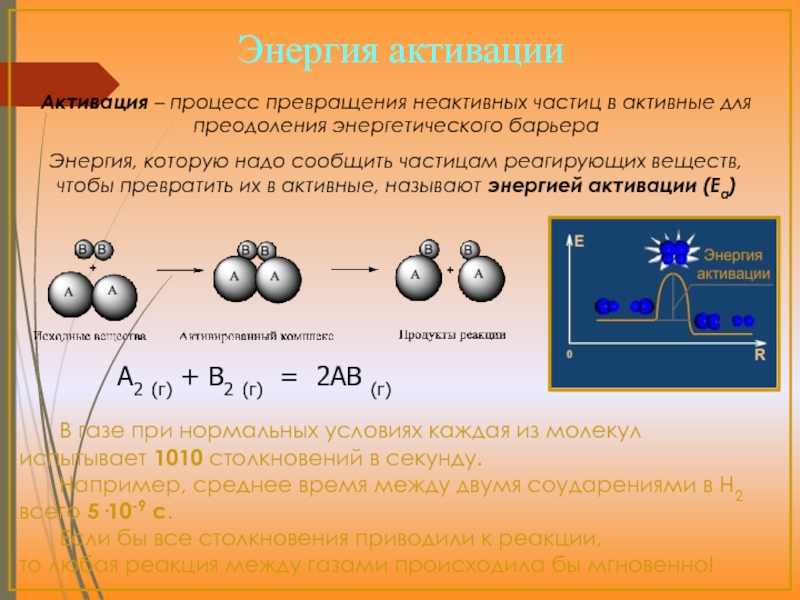
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом.
К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц , зависящую от температуры.
энергию, достаточную для того, чтобы они выбрались из "ямки", перевалили через "барьер" (энергию активации)
Слайд 11
В газе при нормальных условиях каждая из молекул
1010
25·10-9 с
2(г)2(г)(г)
–
энергией активации (Еа)
Слайд 12
Температура повышает количество столкновений молекул.
Правило Вант-Гоффа (сформулировано на основании экспериментального изучения реакций)
В интервале температур от 0°С до 100°С при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
v = v0·g∆τ/10
- температурный коэффициент Вант-Гоффа
Слайд 13
катализ
вещества, изменяющие скорость химической реакции за счёт изменения энергии активации,
ускоряютуменьшая Еа
замедляютувеличивая Еа
12
Слайд 15
Давление сильно влияет на скорость реакций с участием газов, потому что
В уравнении Менделеева-Клапейрона:
pV = nRT
p/RT = n/V
n/V = c
p/RT = c
Давление и молярная концентрация газа связаны прямо пропорционально.
Слайд 16
прямо пропорциональна
Скорость гетерогенной реакции зависит от:
а) скорости подвода реагентов к границе
Стадия, которая протекает наиболее медленно, называется лимитирующей – именно она определяет скорость реакции в целом.
Слайд 17
1. Вычислите среднюю скорость химической реакции, если через 30 с от
Дано:
τ1 = 30c
τ2 = 40c
c1 = 0,05моль/л
с2 = 0,04моль/л
Найти: v
Расчёт ведём по исходному веществу,
значит перед формулой ставим знак «-»
υ = -∆с/∆τ
υ = -(с2-с1)/(τ2- τ1)
υ = -(0,04-0,05)/(40-30) = 0,001 (моль/(л∙с))
Ответ: скорость реакции 0,001 моль/(л∙с)
Слайд 18Дано:
При уменьшении
объёма смеси в 5
раз концентрация
каждого вещества
возрасла в 5 раз
c2 (смеси)/с1(смеси)
Найти: v2/v1
2. Как изменится скорость химической реакции 2СО + О2 = 2СО2, если уменьшить объем газовой смеси в 5 раз?
2СО + О2 = 2СО2
1) выражение закона действующих
масс для исходной смеси и после сжатия
v1 = k · c(СО)2 · c(О2)
v2 = k · c(2СО)2 · c(2О2) = k · 25c(СО)2 · 5c(О2) =
= 125k · c(СО)2 · c(О2)
2) отношение скоростей:
v2/v1 = (125k · c(СО)2 · c(О2))/ (k · c(СО)2 · c(О2)) = 125
Ответ: скорость реакции возрастёт в 125 раз
Слайд 19Дано:
c1 (А)= 1моль/л
с1(В) = 2моль/л
Найти: v1/v2
1) закон действующих масс для данной
v = k∙с(A)∙ с(B)2
2) начальная скорость реакции:
v1 = k · c(А) · c(В)2 = k · 1 ∙ 4 = 4k
3) новые концентрации веществ:
с2(А) = 0,5 ∙ с1(А) = 0,5 ∙ 1 = 0,5 (моль/л)
с2(В) = 2– 2 ∙ с1(А) = 2 – 0,5 ∙ 1 = 1 (моль/л)
4) конечная скорость реакции:
v2 = k · c2(А) · c2(В)2 = k · 0,5 ∙ 1 = 0,5k
5) отношение скоростей:
v1/v2 = 4k/0,5k = 8
Ответ: скорость уменьшится в 8 раз.
3. Во сколько раз уменьшится скорость простой реакции А + 2В = С, когда прореагирует половина вещества А, по сравнению с начальной скоростью? Начальные концентрации: 1 моль/л вещества А и 2 моль/л вещества В.
Слайд 204. Как изменится скорость реакции 2Al + 3Cl2 = 2AlCl3, если
Дано:
Давление системы
увеличили в 2 раз
c2(Cl2)/с1(Cl2) = 2
Найти: v2/v1
2Al + 3Cl2 = 2AlCl3
1) выражение закона действующих
масс для исходной смеси и после сжатия
(только для газов)
v1 = k · c(Cl2)3
v2 = k · c(2Cl2)3 = 8 ∙ k ∙ c(Cl2)3
2) отношение скоростей:
v2/v1 = 8 ∙ k ∙ c(Cl2)3/k · c(Cl2)3 = 8
Ответ: скорость реакции возрастёт в 8 раз
Слайд 211) выражение зависимости скорости
реакции от температуры:
υ2 =
2) отношение скоростей:
v2/v1 = γ∆τ/10 = 2(150-100)/10 = 25 = 32
Ответ: скорость реакции возрастёт в 32 раза
5. Во сколько раз увеличится скорость химической реакции при повышении температуры от 100° до 150 °С, если температурный коэффициент равен 2?
Дано:
τ1 = 100°С
τ2 = 150°С
γ = 2
Найти: v2/v1
Слайд 226. Реакция при 20°С протекает за 2 мин. За какое время
Дано:
τ1 = 20°С
∆t1 = 2 мин =120 сек
τ2 = 40°С
γ = 2
Найти: ∆t2
1) во сколько раз возрастёт скорость
реакции при повышении температуры с 20°С
до 40°С:
vτ2/vτ1 = γ∆t/10 = 2(40-20)/10 = 22 = 4 (раз)
2) время, за которое закончится эта
реакция при температуре 40°С:
∆t2 = 120 сек : 4 = 30сек
Ответ: реакция закончится за 30 секунд.
Слайд 237. Скорость реакции при охлаждении от 50° до 30°С уменьшилась в
Дано:
τ1 = 50°С
τ2 = 30°С
v1/v2 = 9
Найти: γ
Найдём отношение скоростей реакций:
v2/v1 = γ∆τ/10
Составим и решим уравнение:
2 = γ(50°-30°)/10
9 = γ2
γ = 3
Ответ: температурный коэффициент равен 3.