Г.И.Гурьева»
Прасолова Светлана Владимировна.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Скорость химической реакции (9 класс)
Содержание
- 1. Презентация по химии на тему Скорость химической реакции (9 класс)
- 2. Тема урока:Скорость химических реакций и факторы её зависимости.
- 3. Цели урока:Дать понятие о скорости химических реакций
- 4. Оборудование и реактивы.Оборудование: штативы с пробирками, спиртовка.Реактивы:
- 5. Девиз урока:«Знания, не проверенные опытом, бесплодны и
- 6. Подготовка к восприятию
- 7. Одна из задач химиков характеризовать быстроту протекания
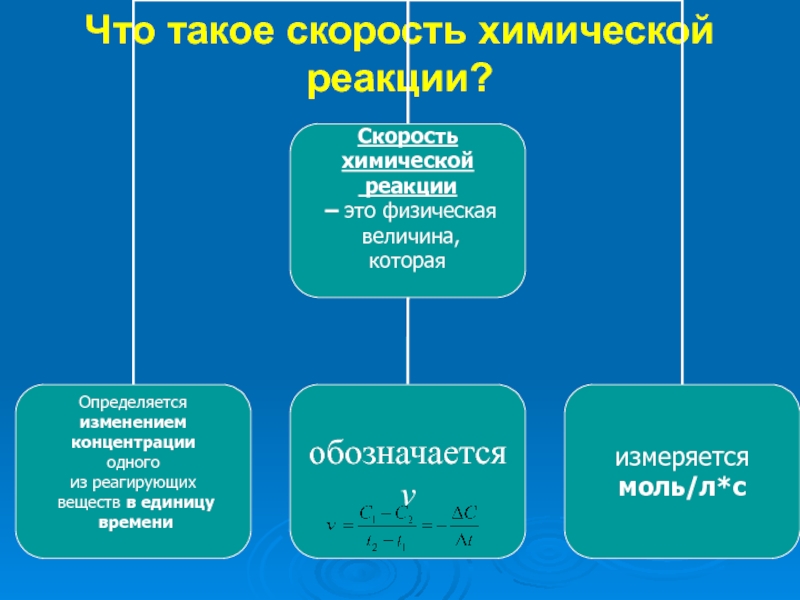
- 8. Что такое скорость химической реакции?
- 9. ТЕРМИН «СКОРОСТЬ»В ФИЗИКЕ И ХИМИИ.
- 10. Факторы, влияющие на скорость химической реакции1. Природа
- 11. 1. Каково влияние природы реагирующих веществ на
- 12. 2. Каково влияние температуры на скорость химической
- 13. 3. Каково влияние концентрации на скорость химической
- 14. 4. Каково влияние поверхности соприкосновения реагирующих веществ?Демонстрационный
- 15. 5. Каково влияние катализаторов?Демонстрационный опыт.Взаимодействие цинка гранулированного
- 16. Проверка усвоения темы урока учащимися.- Какой раздел
- 17. Спасибо за урок!
Тема урока:Скорость химических реакций и факторы её зависимости.
Слайд 3Цели урока:
Дать понятие о скорости химических реакций и единицах её измерения.
Показать влияние на скорость реакций таких факторов, как природа реагирующих веществ, их концентрация, площадь соприкосновения и температура.
Дать понятие о катализаторах, рассмотреть особенности ферментов как катализаторов, показать их значение.
Дать понятие о катализаторах, рассмотреть особенности ферментов как катализаторов, показать их значение.
Слайд 4Оборудование и реактивы.
Оборудование: штативы с пробирками, спиртовка.
Реактивы: цинк в гранулах и
порошке, алюминий, железо, оксид меди(II), сульфат меди.
Растворы: соляная, серная, уксусная кислоты, тиосульфат натрия, пероксид водорода.
Растворы: соляная, серная, уксусная кислоты, тиосульфат натрия, пероксид водорода.
Слайд 6Подготовка к восприятию темы урока.
Понятие
«скорость»
Мера количества вещества. (моль, кмоль, м.моль)
Молярная концентрация (отношение количества вещества к объёму) С=n/V(моль/л).
Химические реакции по фазности делятся на гомогенные(однофазные) и гетерогенные(разнофазные).
Мера количества вещества. (моль, кмоль, м.моль)
Молярная концентрация (отношение количества вещества к объёму) С=n/V(моль/л).
Химические реакции по фазности делятся на гомогенные(однофазные) и гетерогенные(разнофазные).
Слайд 7Одна из задач химиков характеризовать быстроту протекания химических реакций, чтобы уметь
управлять скоростью химических реакций в своих интересах.
Раздел химии, изучающий скорость химической реакции называется кинетикой.
Слайд 10Факторы, влияющие на скорость химической реакции
1. Природа реагирующих веществ.
2. Температура.
3. Концентрация.
4. Поверхность соприкосновения веществ.
5. Катализатор и ингибитор.
Слайд 111. Каково влияние природы реагирующих веществ на скорость химической реакции?
Демонстрационный опыт.
1. Взаимодействие алюминия и железа с
соляной кислотой.
2. Взаимодействие цинка с растворами соляной и уксусной кислот.
Вывод: чем активнее вещество, которое вступает в реакцию, тем выше скорость реакции.
соляной кислотой.
2. Взаимодействие цинка с растворами соляной и уксусной кислот.
Вывод: чем активнее вещество, которое вступает в реакцию, тем выше скорость реакции.
Слайд 122. Каково влияние температуры на скорость химической реакции?
Демонстрационный опыт.
Взаимодействие оксида меди
(II) с серной
кислотой при разной температуре
Вывод: при повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа).
кислотой при разной температуре
Вывод: при повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа).
Слайд 133. Каково влияние концентрации на скорость химической реакции?
Демонстрационный опыт.
Взаимодействие алюминия и
железа с соляной кислотой с соляной кислотой разной концентрации.
Как концентрация реагирующих веществ влияет на скорость химической реакции? Почему?
Вывод: Чем выше концентрация, тем чаше происходит столкновение – скорость реакции больше.
Как концентрация реагирующих веществ влияет на скорость химической реакции? Почему?
Вывод: Чем выше концентрация, тем чаше происходит столкновение – скорость реакции больше.
Слайд 144. Каково влияние поверхности соприкосновения реагирующих веществ?
Демонстрационный опыт.
Взаимодействие цинка гранулированного и
порошкообразного с соляной кислотой.
Вывод: для гетерогенных систем скорость прямо пропорциональна поверхности соприкосновения реагирующих веществ.
Вывод: для гетерогенных систем скорость прямо пропорциональна поверхности соприкосновения реагирующих веществ.
Слайд 155. Каково влияние катализаторов?
Демонстрационный опыт.
Взаимодействие цинка гранулированного и порошкообразного с соляной
кислотой.
Вывод: наличие катализаторов приводит к увеличению скорости реакции.
Вывод: наличие катализаторов приводит к увеличению скорости реакции.
Слайд 16Проверка усвоения темы урока учащимися.
- Какой раздел химии называется химической кинетикой?
-
Какие реакционные системы называют гомогенными?
- Какие системы называют гетерогенными?
- По какой формуле вычисляют скорость реакции?
- Какие факторы влияют на скорость реакции?
- Какие вещества называют катализаторами? Ингибиторами?
- Какие системы называют гетерогенными?
- По какой формуле вычисляют скорость реакции?
- Какие факторы влияют на скорость реакции?
- Какие вещества называют катализаторами? Ингибиторами?