8
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Сильные и слабые электролиты ( 8 класс)
Содержание
- 1. Презентация по химии на тему Сильные и слабые электролиты ( 8 класс)
- 2. Диссоциация растворов веществ
- 3. .отношение числа диссоциированных молекул к общему числу
- 4. Сильные и слабые электролиты
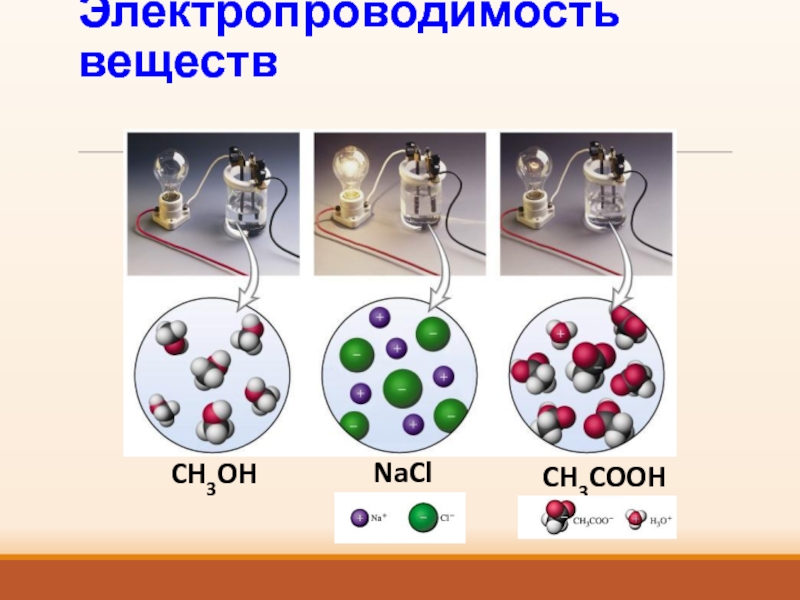
- 5. Электропроводимость веществCH3OHNaClCH3COOH
- 6. Сильные и слабые электролитыСильные элкторолиты при растворении
- 7. Диссоциация сильного и слабого электролита
- 8. Электролиты по степени диссоциацииПочти все солиЩелочиКислоты: HClO4,
- 9. Степень диссоциации зависит: от природы растворителя;
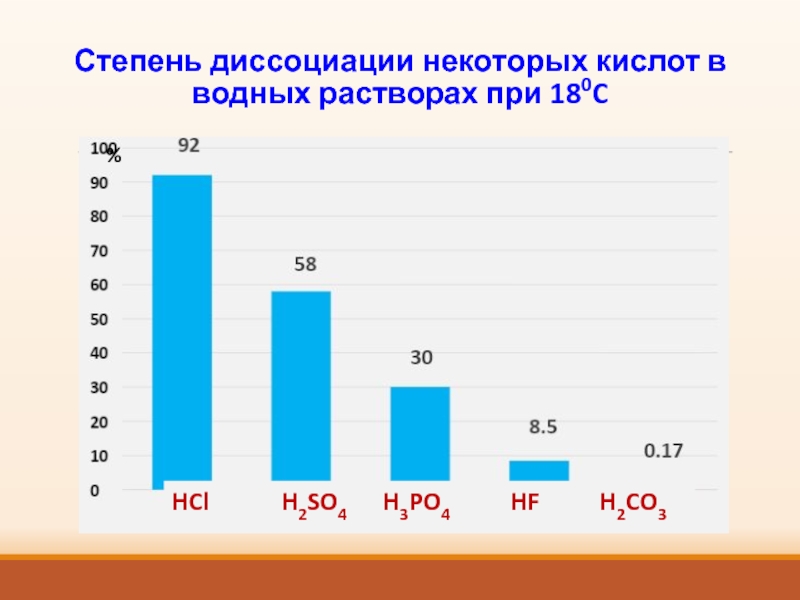
- 10. Степень диссоциации некоторых кислот в водных растворах
- 11. Диссоциация солей, кислот, оснований
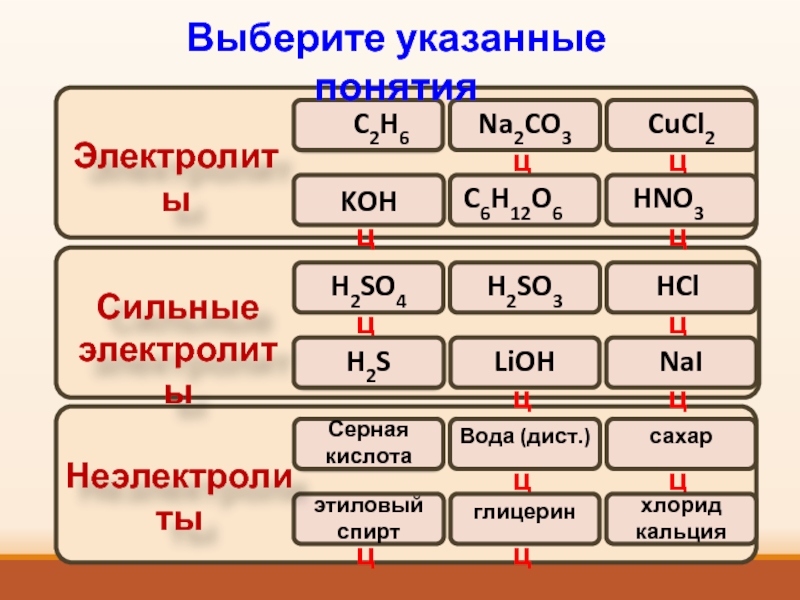
- 12. ОшибкаМолодецМолодецОшибкаМолодецМолодецСильные электролитыKOHЭлектролитыНеэлектролитыВыберите указанные понятия
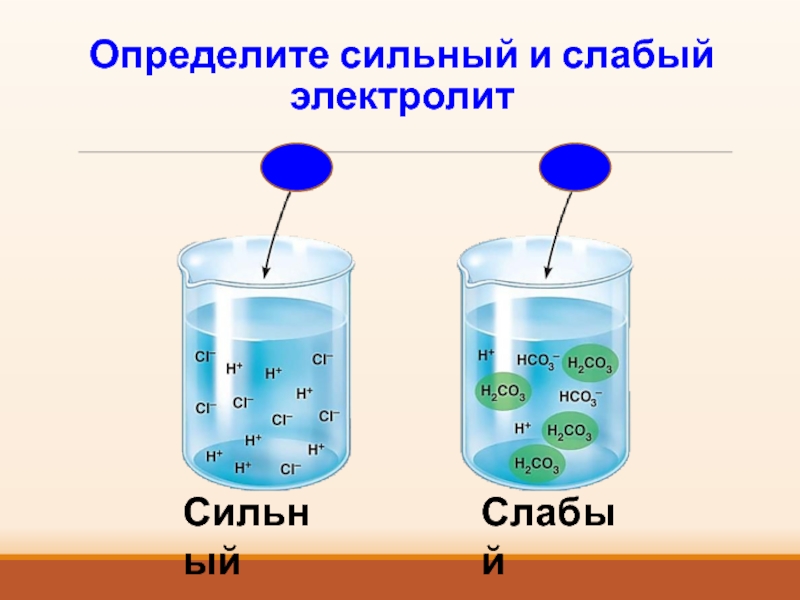
- 13. Определите сильный и слабый электролитСильныйСлабый
- 14. Интернет-ресурсыСильные и слабые электролиты http://www.chem-mind.com/wp-content/uploads/2017/04/%D0%BC%D0%BE%D0%BC%D0%B8-%D0%B8.pnghttp://900igr.net/up/datai/146061/0018-016-.jpgДиссоциация веществ http://bangkusekolah.com/wp-content/uploads/2015/01/asam-basa-garam.jpg
Диссоциация растворов веществ
Слайд 3.
отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе.
Степень электролитической
диссоциации (α) -
α =
Nд
Nр
Сильные электролиты α > 30%
Слабые электролиты
α< 30%
Слайд 6Сильные и слабые электролиты
Сильные элкторолиты при растворении в воде практически полностью
диссоциируют на ионы.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы.
Слайд 8Электролиты по степени диссоциации
Почти все соли
Щелочи
Кислоты: HClO4, H2SO4,HNO3, HCl, HI, HBr
H2SO3,
H3PO4
Вода
Соли тяжелых металлов
Нерастворимые основания
Кислоты:H2S,H2SiO3,HNO2,H2CO3,CH3COOH и другие органические кислоты
Сильные
электролиты
Слабые
электролиты
Электролиты средней силы
30%
3%
Слайд 9Степень диссоциации зависит:
от природы растворителя;
природы растворяемого вещества;
концентрации раствора
(при разбавлении степень диссоциации сильно возрастает);
температуры.
температуры.
Концентрированный
раствор
Разбавленный
раствор