- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Серная кислота (9 класс)
Содержание
- 1. Презентация по химии на тему Серная кислота (9 класс)
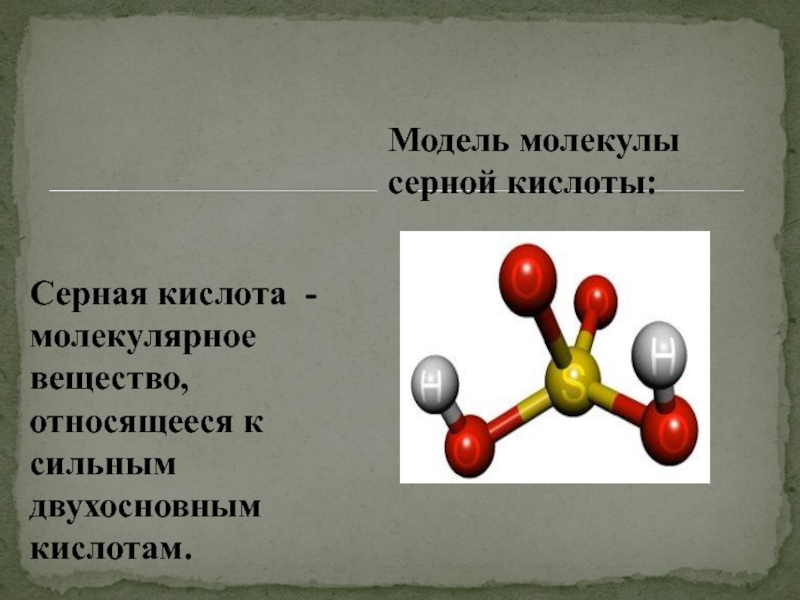
- 2. Серная кислота - молекулярное вещество, относящееся к сильным двухосновным кислотам.Модель молекулы серной кислоты:
- 3. Немного истории. Серная кислота известна
- 4. Это тяжёлая жидкость, которая в любом соотношении
- 5. Физические свойстваАгрегатное состояние – жидкость. Тяжелая маслянистая
- 6. Химические свойства серной кислоты При разбавлении
- 7. Слайд 7
- 8. Слайд 8
- 9. H2SO4 способна обугливать углеводы. Отщепляя
- 10. Промышленный (контактный) способВ промышленности серную кислоту получают
- 11. Нитрозный (башенный) способРаньше серную кислоту получали исключительно
- 12. В производстве минеральных удобрений;Как электролит в свинцовых
- 13. Слайд 13
- 14. Если утверждения верны, то поставь «+», если
Серная кислота - молекулярное вещество, относящееся к сильным двухосновным кислотам.Модель молекулы серной кислоты:
Слайд 2Серная кислота - молекулярное вещество, относящееся к сильным двухосновным кислотам.
Модель молекулы
серной кислоты:
Слайд 3Немного истории.
Серная кислота известна с древности, встречаясь в природе
в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Абу Абдаллах Джабир ибн Хайян аль-Азди ас-Суфи. В средневековой Европе был известен под латинизированным именем Гебер.
Слайд 4Это тяжёлая жидкость, которая в любом соотношении смешивается с водой, имеет
молекулярную решётку и ковалентную полярную связь.
H2SO4 Характеристика:
По основности: двухосновная
По наличию кислорода: кислородосодержащая
По силе: сильный электролит
Слайд 5Физические свойства
Агрегатное состояние – жидкость. Тяжелая маслянистая жидкость («купоросное масло», ее
плотность - r = 1,84 г/см3 ) Нелетучая, очень хорошо растворима в воде – с сильным нагревом (бывает разбавленная и концентрированная кислота) t°кип. = 296°С
Слайд 6Химические свойства серной кислоты При разбавлении кислоту вливать в воду! Разбавленная – как
обычная кислота.
Концентрированная
1. образование гидратов
2. обугливание органических веществ (сахар,бумага,древесина, волокна)
3. а)С Ме после водорода – SO2
б) с активными Ме – S,H2S, SO2
Слайд 9H2SO4 способна обугливать углеводы.
Отщепляя воду от органических соединений и
оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ:
Слайд 10Промышленный (контактный) способ
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся
в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %):
2SО2 + O2 = 2SO3
SO3 + Н2О = H2SO4
2SО2 + O2 = 2SO3
SO3 + Н2О = H2SO4
Получение серной кислоты
Слайд 11Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных
башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога:
SО2 + NO2 + H2O = H2SO4 + NO
SО2 + NO2 + H2O = H2SO4 + NO
Слайд 12В производстве минеральных удобрений;
Как электролит в свинцовых аккумуляторах;
Для получения различных
минеральных кислот и солей;
В нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
В пищевой промышленности (пищевая добавка Е513).
В нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
В пищевой промышленности (пищевая добавка Е513).
Применение H2SO4
Слайд 14Если утверждения верны, то поставь «+», если нет, то знак «-»:
Концентрированная
серная кислота является восстановителем.
Концентрированная серная кислота взаимодействует с неметаллами.
Разбавленная серная кислота взаимодействует с медью.
На холоде в концентрированной серной кислоте железо пассивируется.
Концентрированная серная кислота обугливает сахар.
Алюминий в концентрированной серной кислоте разрушается.
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария.
Концентрированная серная кислота практически полностью диссоциирует на ионы водорода и сульфат-ионы.
Концентрированная серная кислота взаимодействует с медью.
Разбавленная серная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода.
Концентрированная серная кислота взаимодействует с неметаллами.
Разбавленная серная кислота взаимодействует с медью.
На холоде в концентрированной серной кислоте железо пассивируется.
Концентрированная серная кислота обугливает сахар.
Алюминий в концентрированной серной кислоте разрушается.
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария.
Концентрированная серная кислота практически полностью диссоциирует на ионы водорода и сульфат-ионы.
Концентрированная серная кислота взаимодействует с медью.
Разбавленная серная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода.
Проверим себя.