- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Сера
Содержание
- 1. Презентация по химии на тему Сера
- 2. Сера принадлежит к числу веществ,
- 3. В живой природе:Входит в состав животных и
- 4. Самородная сера, серный колчедан FeS2, медный колчедан
- 5. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ Сера ромбическаяСера пластическая
- 6. СЕРА
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРЫ Сера – твердое кристаллическое
- 8. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ S Реагирует с металлами
- 9. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИСоединения серы с металлами носят
- 10. ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИСера – окислительH2 + S
- 11. ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИСера восстановительS0 + O20 =
- 12. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ3S + 2KClO3 =
- 13. ПРИМЕНЕНИЕ СЕРЫ S
- 14. РЕФЛЕКСИЯЯ знаю физические и химические свойства серыЯ
Слайд 2 Сера принадлежит к числу веществ, известных человечеству испокон веков.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII—XIV вв., после появления пороха и огнестрельного оружия.
Сера – от санскритского слова сира – «светло-желтый».
ОТКРЫТИЕ СЕРЫ
Слайд 3В живой природе:
Входит в состав животных и растительных белков, витаминов, гормонов.
СЕРА
Сера – относится к числу распространенных элементов: земная кора содержит 0,047% серы по массе, Земля в целом – 0,7%.
Основные месторождения самородной серы: Мексика, Польша, США, Япония, Италия, в России – по берегам Волги.
Слайд 4
Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS
Ангидрит CaSO4, гипс CaSO4∙2H2O и гипс пластинчатый
СОЕДИНЕНИЯ СЕРЫ
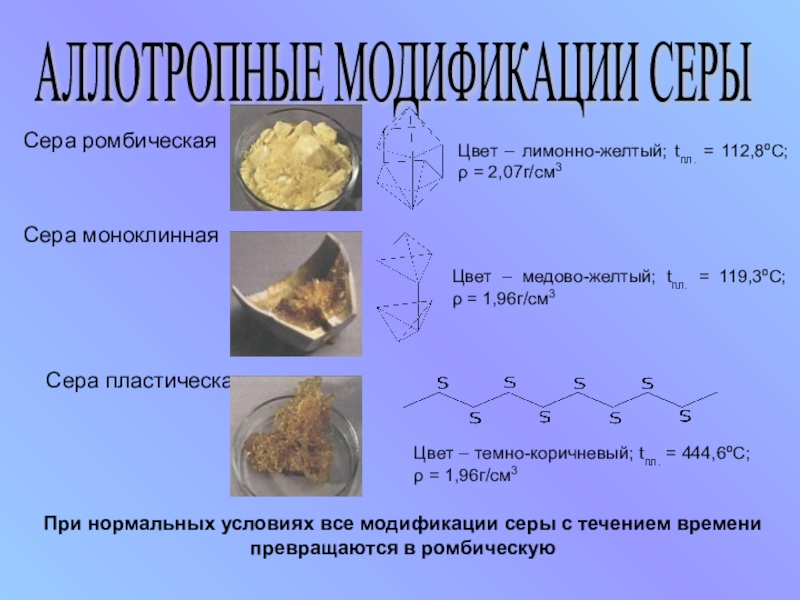
Слайд 5АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ
Сера ромбическая
Сера пластическая
Сера моноклинная
Цвет – лимонно-желтый;
Цвет – медово-желтый; tпл. = 119,3ºС; ρ = 1,96г/см3
Цвет – темно-коричневый; tпл. = 444,6ºС; ρ = 1,96г/см3
При нормальных условиях все модификации серы с течением времени превращаются в ромбическую
Слайд 6СЕРА
nº=16
ē=16
Z=+16
Степени окисления серы: −2 (окислительные свойства); 0;
+2, +4, +6 (восстановительные свойства).
Сера входит в главную подгруппу шестой группы, третий период (малый).
Сера – неметалл
1s22s22p63s23p4
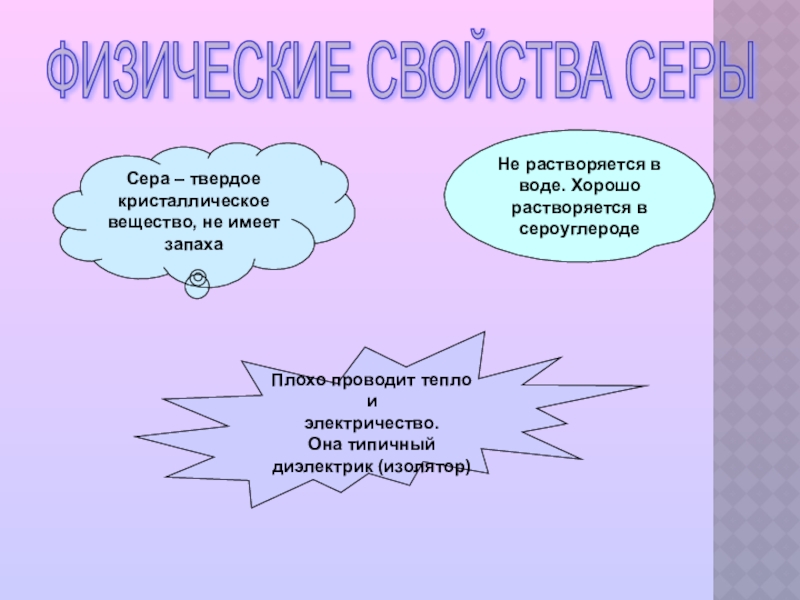
Слайд 7ФИЗИЧЕСКИЕ СВОЙСТВА СЕРЫ
Сера – твердое кристаллическое вещество, не имеет запаха
Не
Плохо проводит тепло и
электричество.
Она типичный
диэлектрик (изолятор)
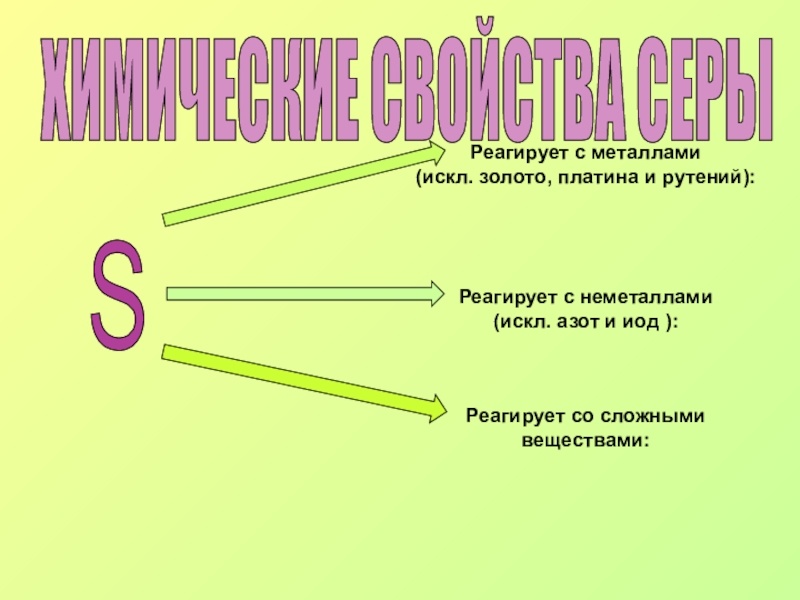
Слайд 8ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ
S
Реагирует с металлами
(искл. золото, платина и
Реагирует с неметаллами (искл. азот и иод ):
Реагирует со сложными веществами:
Слайд 9ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
Соединения серы с металлами носят названия сульфидов и принадлежат
2Na + S = Na2S;
Zn + S = ZnS;
2Al + 3S = Al2S3;
2Cu + S = Cu2S;
Fe + S = FeS;
Нg + S = HgS ;
Слайд 10ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
Сера – окислитель
H2 + S = H2S (сероводород)
S0 +
H20 - 2ē = 2H+ восстановитель
2S + C = C+4S2-2
S0 + + 2ē = S2- 2 окислитель
C0 - 4ē = C+4 1 восстановитель
Слайд 11ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
Сера восстановитель
S0 + O20 = S4+O2-2 (сернистый газ)
O20 + 4ē = 2O-2 окислитель
S0 + 3F20 = S6+F6-1 (фторид серы)
S0 - 6ē = S+4 1 восстановитель
F20 + 2ē = 2F- 3 окислитель
Слайд 12ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
3S + 2KClO3 = 2KCl + 3SO2;
S +
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Слайд 14РЕФЛЕКСИЯ
Я знаю физические и химические свойства серы
Я умею составлять уравнения реакции,
Я могу сравнивать свойства простых веществ и кислорода, разъяснять эти свойства в свете представлений об окислительно-восстановительных процессах