- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Сера (9 класс)
Содержание
- 1. Презентация по химии на тему Сера (9 класс)
- 2. 1. Определить положение в ПСХЭ.2. Рассмотреть строение атома.
- 3. Нахождение в природе:1. В самородном виде.Входит в
- 4. Содержание серы в продуктахГорохФасольОвсяные хлопьяПшеницаМясоРыбаПлодыСок манго
- 5. Залежи свободной серы имеются в Западной Украине,
- 6. Соединения серы в природе:Самородная сераСерный колчедан FeS2Медный
- 7. Физические свойства серыСера твердое кристаллическое вещество. Желтого
- 8. Слайд 8
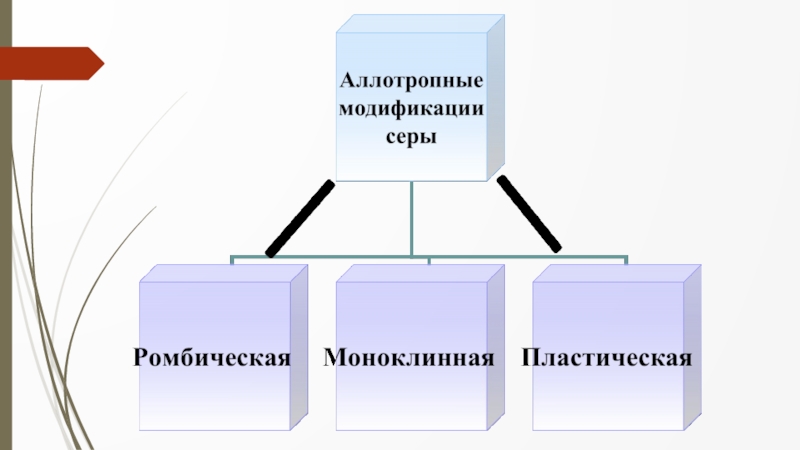
- 9. Ромбическая сера Ромбическая (α-сера) - S8 желтого цвета t°пл. = 113°C; Наиболее устойчивая модификация.
- 10. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые
- 11. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная)
- 12. Химические свойства серыВзаимодействие серы с простыми веществамиА)
- 13. ПолучениеНеполное окисление сероводородаВосстановление сернистого газаИз самородных залежей водяным паром
- 14. НЕЗЕМНЫЕ ПЕЙЗАЖИ ВУЛКАНА ДАЛЛОЛ (ЭФИОПИЯ)
- 15. Слайд 15
- 16. Слайд 16
- 17. Применение серыВ медицинеВ сельском хозяйствеДля производства серной кислотыПроизводство спичекПроизводство взрывчатых веществПроизводство резиныПроизводство красителей
- 18. ОТВЕТЬТЕ НА ВОПРОСЫ:Охарактеризуйте положение серы в периодической системе химических элементов Д.И. Менделеева.
- 19. ОТВЕТЬТЕ НА ВОПРОСЫ:В каком виде сера находится в природе?
- 20. ОТВЕТЬТЕ НА ВОПРОСЫ:Охарактеризуйте физические свойства серы.
- 21. Выберите правильный ответ:С каким веществом реагирует сера образуя сульфид:А) водойБ) водородомВ) натрием
- 22. Выберите правильный ответ:1. Строение атома серы:2. Для атома
- 23. Выберите правильный ответ:3. Какой модификации серы не
- 24. Слайд 24
1. Определить положение в ПСХЭ.2. Рассмотреть строение атома.
Слайд 3Нахождение в природе:
1. В самородном виде.
Входит в состав различных минералов, руд
и горных пород (сульфиды и сульфаты), нефти, природного газа, каменного угля.
Содержание серы в организме человека массой 70 кг – 140 г.
В сутки человеку необходим 1 г серы.
Сера входит в состав гормонов, витаминов, она есть в хрящевой ткани, волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, и выпадение волос.
Содержание серы в организме человека массой 70 кг – 140 г.
В сутки человеку необходим 1 г серы.
Сера входит в состав гормонов, витаминов, она есть в хрящевой ткани, волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, и выпадение волос.
Слайд 5Залежи свободной серы имеются в Западной Украине, в Туркмении
в пустыне
Каракум, в Узбекистане, по берегам Волги.
Слайд 6Соединения серы в природе:
Самородная сера
Серный колчедан FeS2
Медный колчедан CuS2
Свинцовый блеск PbS
с цинковой обманкой ZnS
Гипс CaSO4 * 2H2O
Гипс CaSO4 * 2H2O
1
2
3
4
5
Слайд 7Физические свойства серы
Сера твердое кристаллическое вещество. Желтого цвета
Не имеет запаха
Не растворима
в воде
Хорошо растворима в сероуглероде, ацетоне
Плохо проводит тепло, электричество, является диэлектриком
Хорошо растворима в сероуглероде, ацетоне
Плохо проводит тепло, электричество, является диэлектриком
Слайд 9Ромбическая сера
Ромбическая (α-сера) - S8
желтого цвета
t°пл.
= 113°C;
Наиболее устойчивая модификация.
Наиболее устойчивая модификация.
Слайд 10Моноклинная сера
Моноклинная (β –сера)- S8,
темно-желтые иглы,
t°пл. = 119°C;
устойчивая при
температуре более 96°С;
при обычных условиях превращается в ромбическую
при обычных условиях превращается в ромбическую
Слайд 11Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через
некоторое время становится хрупкой,
приобретёт желтый цвет, т.е
превращается в ромбическую серу.
приобретёт желтый цвет, т.е
превращается в ромбическую серу.
Слайд 12Химические свойства серы
Взаимодействие серы с простыми веществами
А) с металлами, образуя сульфиды
(иск. золото, платина и рутений)
Б) с неметаллами (водородом, кислородом, фтором, иск. азот, иод)
Взаимодействие серы со сложными веществами
Кислотами
Щелочами
Б) с неметаллами (водородом, кислородом, фтором, иск. азот, иод)
Взаимодействие серы со сложными веществами
Кислотами
Щелочами
Слайд 13Получение
Неполное окисление сероводорода
Восстановление сернистого газа
Из самородных залежей водяным паром
Слайд 17Применение серы
В медицине
В сельском хозяйстве
Для производства серной кислоты
Производство спичек
Производство взрывчатых веществ
Производство
резины
Производство красителей
Производство красителей
Слайд 18ОТВЕТЬТЕ НА ВОПРОСЫ:
Охарактеризуйте положение серы в периодической системе химических элементов Д.И.
Менделеева.
Слайд 21Выберите правильный ответ:
С каким веществом реагирует сера образуя сульфид:
А) водой
Б) водородом
В)
натрием
Слайд 22Выберите правильный ответ:
1. Строение атома серы:
2. Для атома серы наиболее характерны степени
окисления:
а) –2, +2, +4, +6; б) –2, +4, +5, +6;
в) –2, +1, +3, +6; г) –2, +2, +4.
а) –2, +2, +4, +6; б) –2, +4, +5, +6;
в) –2, +1, +3, +6; г) –2, +2, +4.
Слайд 23Выберите правильный ответ:
3. Какой модификации серы не существует:
а) ромбической;
б) тетраэдрической;
в) моноклинной; г) пластической?
4. Сера не растворяется в:
а) ацетоне; б) воде;
в) сероуглероде; г) толуоле.
в) моноклинной; г) пластической?
4. Сера не растворяется в:
а) ацетоне; б) воде;
в) сероуглероде; г) толуоле.