- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
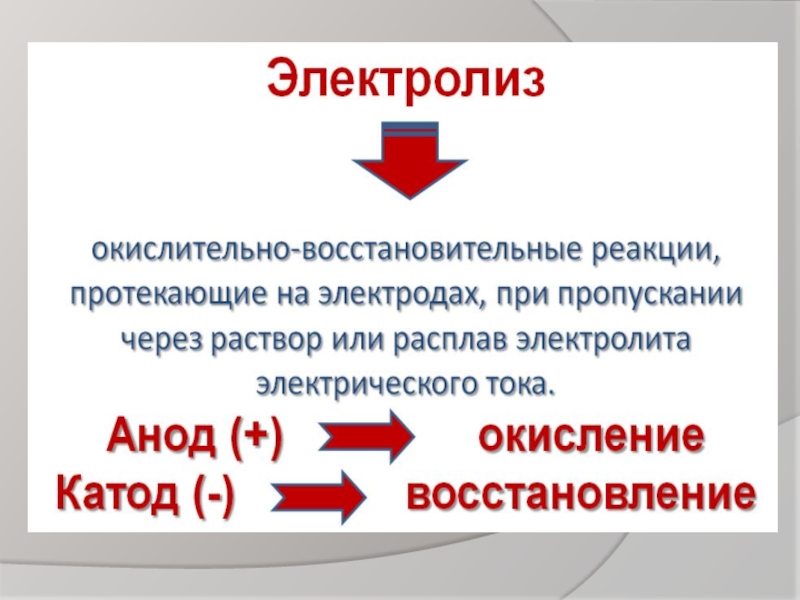
Презентация, доклад для учащихся 11 класса по предмету химия по теме: Электролиз
Содержание
- 1. Презентация для учащихся 11 класса по предмету химия по теме: Электролиз
- 2. Что произойдёт, если в раствор или расплав
- 3. Слайд 3
- 4. Слайд 4
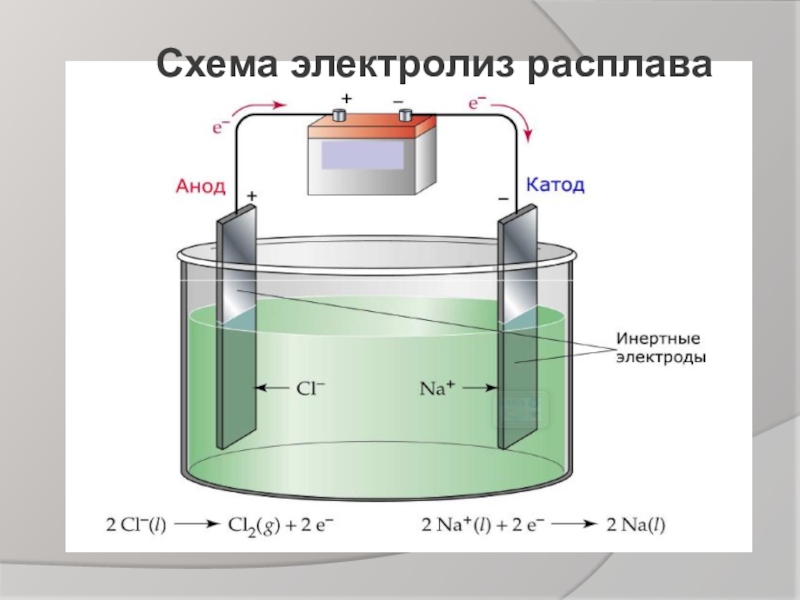
- 5. Схема электролиз расплава
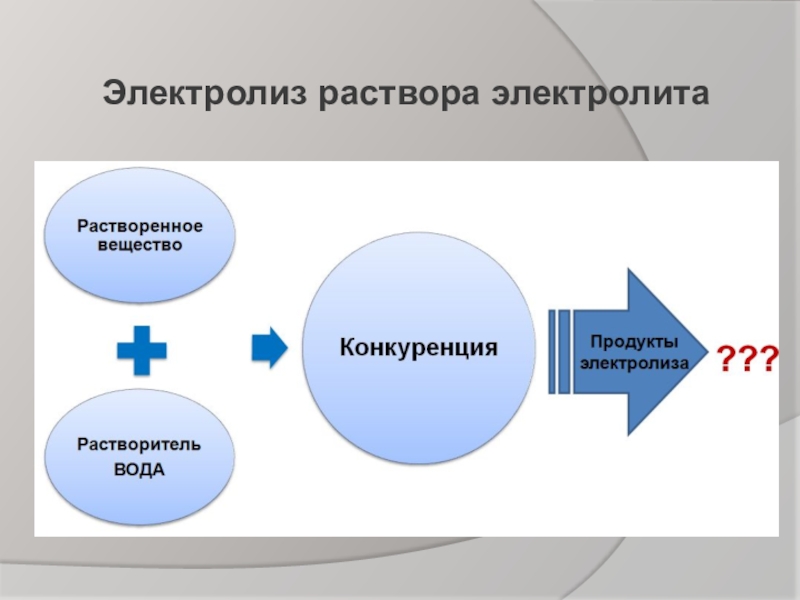
- 6. Электролиз раствора электролита
- 7. Слайд 7
- 8. Правила электролиза растворовПроцесс на катоде не зависит
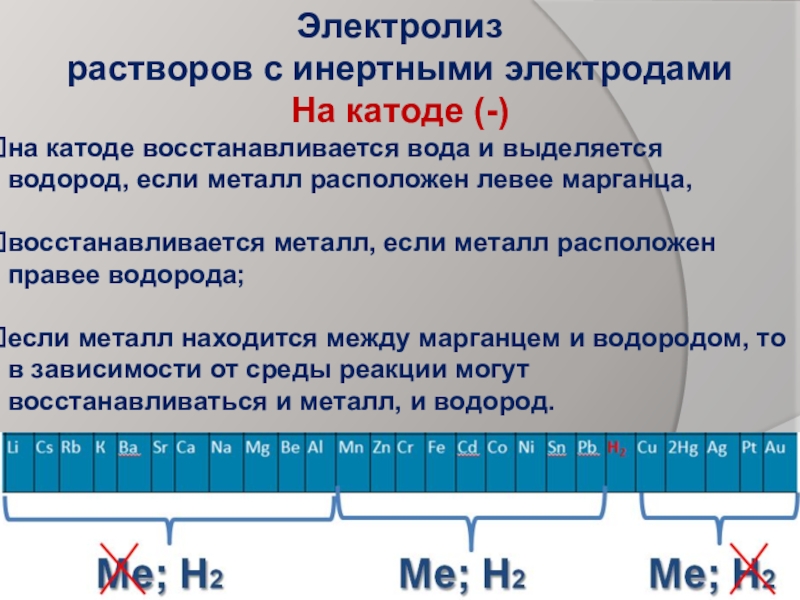
- 9. Электролиз растворов с инертными электродами На катоде
- 10. На аноде (-)На аноде окисление аниона, если
- 11. 1.На инертных электродах с кислородосодержащим остатком CuSO4
- 12. 3.На инертных электродах электролиз основанийKOH = K+ +
- 13. Рефлексия: Установите соответствие между формулой вещества и
- 14. Домашнее задание: § 18 (стр.234-240), №22-27, подготовить презентацию «Применение электролиза»
Слайд 2Что произойдёт, если в раствор или расплав электролита опустить электроды, которые
Проблемный вопрос.
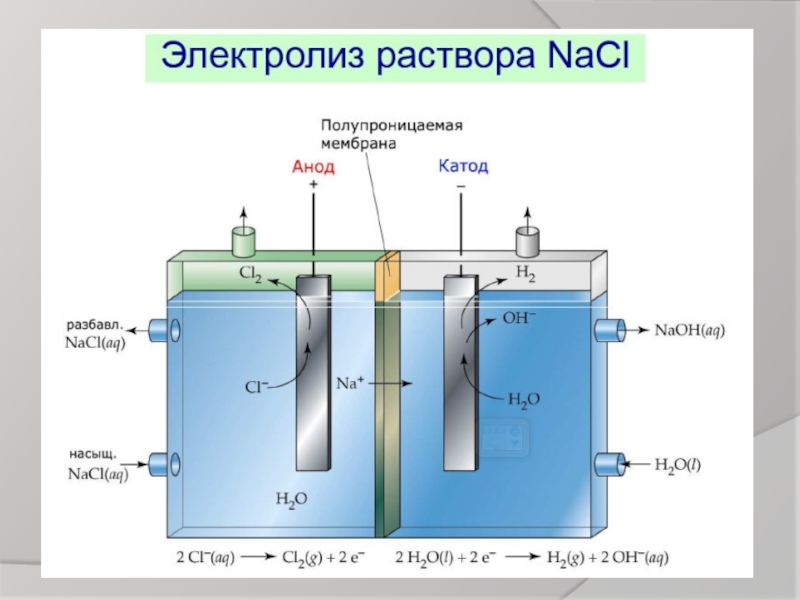
Слайд 8Правила электролиза растворов
Процесс на катоде не зависит от материала катода, а
Процесс на аноде зависит от материала анода и от природы аниона
Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то результаты зависят от анионов кислотных остатков.
Если анод растворимый ( железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идёт окисление металла анода.
Слайд 9Электролиз
растворов с инертными электродами
На катоде (-)
на катоде восстанавливается вода
восстанавливается металл, если металл расположен правее водорода;
если металл находится между марганцем и водородом, то в зависимости от среды реакции могут восстанавливаться и металл, и водород.
Слайд 10На аноде (-)
На аноде окисление аниона, если соль содержит бескислородный кислотный
2Cl- + 2e = Cl20↑
На аноде окисление воды, выделяется кислород, анионы остаются в растворе если соль содержит кислородосодержащий кислотный остаток: OH¯,SO4²¯, CO3²¯, NO3¯,F¯,
2H2O – 4e = O2↑ + 4H+ (кислотная или нейтральная среда)
OН - – 4e = O2↑ + 2H2O (щелочная среда)
Электролиз растворов с инертными электродами зависит от природы аниона:
Слайд 11
1.На инертных электродах с кислородосодержащим остатком
CuSO4 → Cu2+ +
H2O
Катод (-) Cu2+ SO42- Анод (+)
Cu2+ + 2e = Cu0 2H2O – 4e = O2↑ + 4H+
восстановление окисление
: Суммарное уравнение
2CuSO4 + 2H2O = 2Cu0 + O2↑ + 2H2SO4
2.На инертных электродах с бескислородным остатком
KCl ↔ K+ + Cl-
Катод (-) К+ Cl - Анод (+)
2H2O + 2 ē = H2↑+ 2OH- 2Cl- - 2ē = Cl20↑ Суммарное уравнение 2 KCl +2H2O = H2↑+ 2KOH- + Cl20↑
Алгоритм составления уравнений электролиза
Слайд 123.На инертных электродах электролиз оснований
KOH = K+ + OH-
Катод (-) К+
2H2O + 2 ē = H2↑+ 2OH- OН - – 4e = O2↑ + 2H2O Суммарное уравнение 2H2O = H2↑+ О20↑
4. На растворимом аноде (серебряный)
AgNO3=Ag+ + NO3-
Катод (-) Ag+ NO3- - Анод (+)
Ag+ + ē = Ag 0 Ag 0 – ē = Ag+
Суммарное уравнение
невозможно, так как электролиз раствора нитрата серебра сводится к переносу серебра с анода на катод
Слайд 13Рефлексия:
Установите соответствие между формулой вещества и продуктами электролиза его водного
1) NaBr А)Na, Br2, H2;
2) ZnSO4 Б) Mn, H2, Cl2;
3) NaNO3 В) Na, H2, N2O5
4) MnCl2 Г) Zn, H2, O2;
Д) H2, O2;
Е) H2, Br2.
1)CaCl2 А) Ca, Cl2
2)Fe(NO3)3 Б) Fe, H2, Cl2
3)K2SO4 В) K, H2, SO3
4)FeCl3 Г) Fe, H2, O2
Д) H2, Cl2
Е) H2, O2
Задание № 1.
Задание № 2