- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Решение задач на определение состава органического соединения (10-11 класс)
Содержание
- 1. Презентация по химии на тему Решение задач на определение состава органического соединения (10-11 класс)
- 2. АЛГОРИТМ решения расчетных задач
- 3. Задание №396610При взаимодействии 11,6 г предельного альдегида с
- 4. 1 этап – химическая часть
- 5. 1 этап – химическая часть
- 6. 1 этап – химическая часть
- 7. Задание №396610При взаимодействии 11,6 г предельного альдегида с
- 8. 1 этап – химическая часть
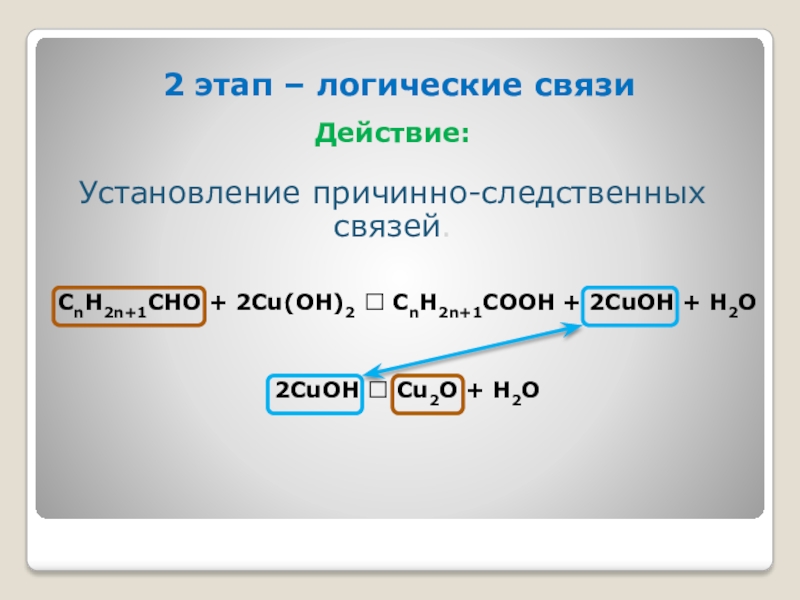
- 9. 2 этап – логические связи
- 10. 3 этап – план решения задачи Действие: Составляем план решения.
- 11. Слайд 11
- 12. .СnH2n+1CHO + 2Cu(OH)2 СnH2n+1COOH +
Слайд 1Решение задач на определение состава органического соединения
Учитель химии МБОУ СОШ №1
Кадыров Азат Талгатович
Слайд 2
АЛГОРИТМ
решения расчетных задач
разбить условие задачи на смысловые фрагменты (химическая
установить логические связи между количествами веществ реагентов и продуктов реакции;
составить план решения задачи;
провести математические расчеты.
Слайд 3Задание №396610
При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при
Открытая часть КИМов ЕГЭ по химии
(opengia.ru)
Слайд 4
1 этап – химическая часть задачи
При взаимодействии 11,6 г предельного альдегида с
Действие:
Выделяем ключевые слова и понятия,
составляем уравнения реакций
При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г.
Слайд 5
1 этап – химическая часть задачи
1. Тип реакции - окисление
2. Окисление
3. Альдегид предельный
Действие:
Выделяем ключевые слова и понятия
.
СnH2n+1CHO
Слайд 6
1 этап – химическая часть задачи
СnH2n+1CHO + 2Cu(OH)2 СnH2n+1COOH +
2CuOH Cu2O + H2O
Действие:
Составляем уравнения реакций
.
Слайд 7Задание №396610
При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при
Слайд 8
1 этап – химическая часть задачи
Выведите молекулярную формулу альдегида
Действие:
Выделяем ключевые слова
.
Выведите
СnH2n+1CHO
СnH2n+1CHO
Слайд 9
2 этап – логические связи
Действие:
Установление причинно-следственных связей.
СnH2n+1CHO + 2Cu(OH)2 СnH2n+1COOH
2CuOH Cu2O + H2O
Слайд 12
.
СnH2n+1CHO + 2Cu(OH)2 СnH2n+1COOH + 2CuOH + H2O
2CuOH Cu2O
Запись уравнений химических реакций
Расчет количества вещества Cu2O
Расчет количества вещества альдегида
Расчеты молярной массы альдегида двумя способами
Нахождение формулы альдегида