- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Реакции ионного обмена
Содержание
- 1. Презентация по химии на тему Реакции ионного обмена
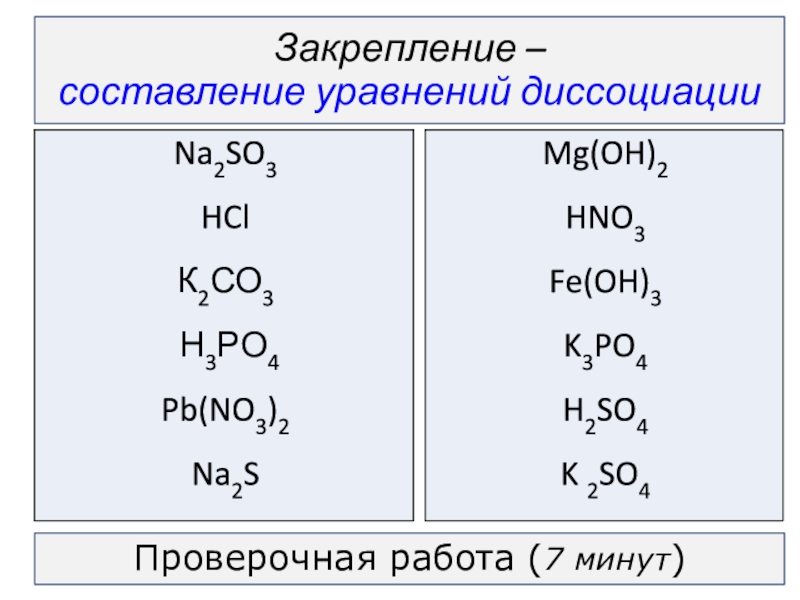
- 2. Закрепление – составление уравнений диссоциацииПроверочная работа (7 минут)
- 3. Реакции ионного обменаэто реакции в водных растворах электролитов между ионами
- 4. Уравненияреакций ионного обмена называют ионными уравнениями
- 5. Реакции ионного обмена в растворах электролитов
- 6. Алгоритм составления ионных уравнений1. Напишите уравнение реакции
- 7. Если вещество выпадает в осадокмолекулярное уравнениеNa2SO4
- 8. KBr + AgNO3 = AgBr↓ + KNO3K
- 9. Если образуется малодиссоциирующее вещество (например, Н2О)NaOH +
- 10. Реакция взаимодействия сильной кислоты со щелочьюназываетсяреакцией нейтрализацииЭто частный случай реакции обмена
- 11. Реакция обмена между кислотами и нерастворимыми основаниямиCu(OH)2
- 12. Если выделяется газNa2CO3 + 2HCl = 2NaCl
- 13. Запомни !!! 1. Реакции ионного обмена.2. Молекулярное и ионные уравнения реакций.3. Реакции нейтрализации.
- 14. Спасибо за внимание!п. 38 упр. 1-5
Слайд 5Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в
образуется осадок (↓ )
образуется малодиссоциирующее вещество (например, Н2О)
выделяется газ (↑ )
Слайд 6
Алгоритм составления ионных уравнений
1. Напишите уравнение реакции в молекулярной форме.
2. Определите
3. Запишите ионы диссоциирующих веществ, указав их число и заряды.
4. Отметьте одинаковые ионы ( они не принимают участие в реакции ) в левой и правой частях уравнения реакции.
5. Запишите строчкой ниже оставшиеся ионы и вещества.
6.Сформулируйте вывод на основе сокращенного ионного уравнения.
Слайд 7Если вещество выпадает в осадок
молекулярное уравнение
Na2SO4 + BaCl2 = BaSO4
полное ионное уравнение
2Na++ SO42-+ Ba2++ 2Cl - = BaSO4 ↓ + 2Na++ 2Cl -
сокращенное ионное уравнение
Ba2+ + SO42- = BaSO4 ↓
Вывод: реакция ионного обмена протекает до конца, т.к. образуется осадок
Слайд 9Если образуется малодиссоциирующее вещество (например, Н2О)
NaOH + HCl = NaCl +
Na++ OH - + H ++ Cl - = Na++ Cl - + H2O
H + + OH - = H2O
Вывод:
реакция ионного обмена идет до конца, т.к. образуется малодиссоциирующее вещество Н2О
Слайд 10
Реакция взаимодействия сильной кислоты со щелочью
называется
реакцией нейтрализации
Это частный случай реакции обмена
Слайд 11Реакция обмена между кислотами и нерастворимыми основаниями
Cu(OH)2 ↓ + H2SO4 =
CuSO4
Cu(OH)2 ↓ + 2H++ SO42-=
Cu2++ SO42-+ 2H2O
Cu(OH)2 ↓ + 2H+ = Cu2+ + 2H2O
Вывод: реакция обмена прошла до конца,
осадок растворился
Слайд 12Если выделяется газ
Na2CO3 + 2HCl =
2NaCl + H2O + CO2↑
2Na++
+ H2O + CO2↑
CO32-+ 2H+ = H2O + CO2↑
Вывод: реакция идет до конца, т.к. выделяется газ